- 2021-07-03 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年高二化学新教材人教版必修第二册教师用书:5
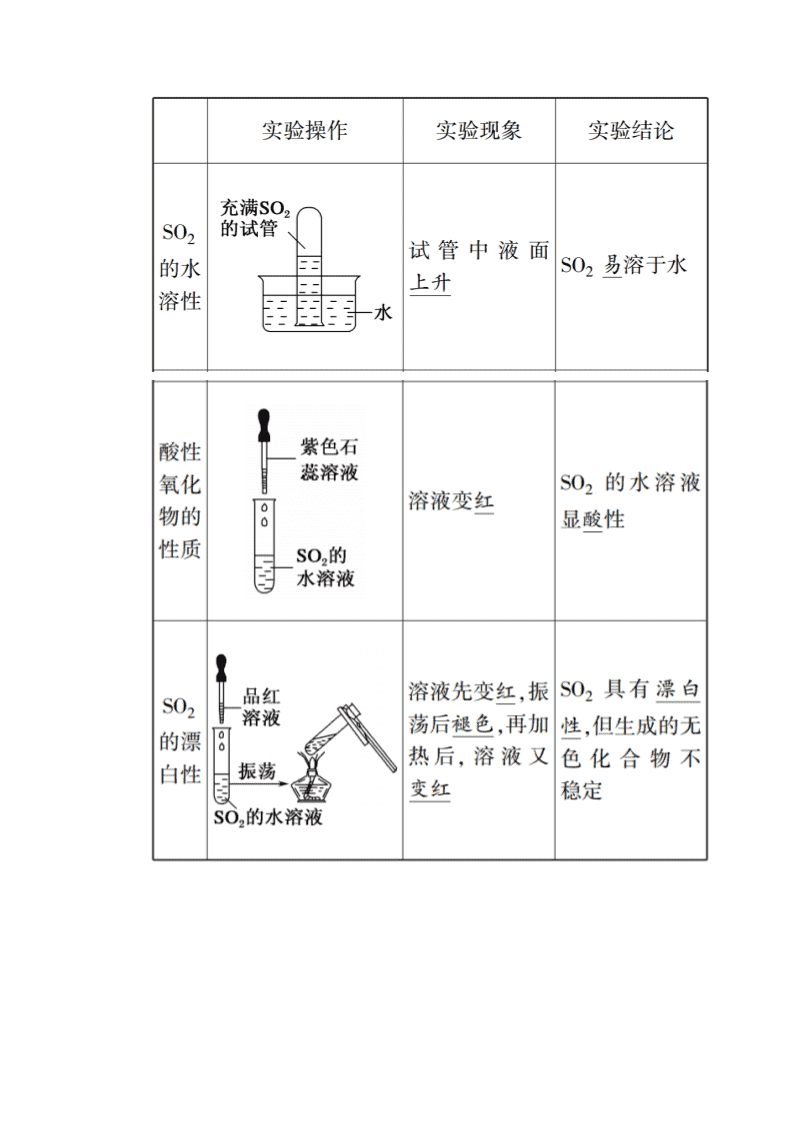
www.ks5u.com 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物 第1课时 硫和二氧化硫 课前自主预习 1.硫单质 (1)硫元素在自然界中的存在形式 (2)硫的物理性质 (3)硫的化学性质 ③与强氧化剂反应(如浓硫酸):S+2H2SO4(浓)===3SO2+2H2O,表现还原性。 ④与碱溶液反应:3S+6NaOH2Na2S+Na2SO3+3H2O,表现氧化性和还原性。 2.二氧化硫 (1)SO2的物理性质 SO2是无色、有刺激性气味的有毒气体,密度比空气的大,容易液化,易溶于水(常温常压下,1体积水大约能溶解40体积的SO2)。SO2是一种主要的大气污染物。 (2)SO2性质的实验探究 (3)SO2的化学性质 3.SO3的性质 (1)物理性质 标准状况下,SO3是一种无色固体,熔点、沸点较低。 (2)化学性质 SO3是酸性氧化物,具有酸性氧化物的通性。 ①SO3与水反应 SO3+H2O===H2SO4,反应放出大量的热,产物能使紫色石蕊溶液变红。 ②SO3与碱性氧化物反应 SO3+CaO===CaSO4 ③SO3与碱反应 SO3+Ca(OH)2===CaSO4+H2O 4.可逆反应 (1)定义 在同一条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。 (2)特点 ①二同:a.相同条件下;b.正、逆反应同时进行。 ②一小:反应物与生成物同时存在;任一组分的转化率都小于100%。 (3)表示 在化学方程式中用“”表示。 课堂互动探究 SO2的漂白性及常见漂白剂的漂白原理 1.SO2和Cl2的漂白性比较 SO2的漂白原理是与有色物质结合生成不稳定的无色物质,Cl2的漂白原理是和H2O反应生成的HClO具有强氧化性,二者原理不同。 2.常见漂白剂的漂白原理 (1)漂白原理分类 ①氧化型 漂白剂本身是一种强氧化剂,利用其强氧化性氧化有色物质而使之失去原有的颜色,特点是不可逆。此类物质有:HClO、Ca(ClO)2、NaClO、Na2O2、H2O2等强氧化性物质。 ②加合型 漂白剂与有色物质结合生成新的无色物质,使有色物质失去原有的颜色,当受热时漂白剂从有色物质中脱离,使之又恢复原有的颜色,特点是可逆,如SO2使品红溶液褪色,加热又恢复原有颜色(SO2不漂白酸碱指示剂)。 ③吸附型 有些物质的固体疏松、多孔,具有较大的表面积,可以吸附一些有色物质而使之失去原来的颜色,如活性炭、胶体等。 (2)漂白异同点比较 常用于漂 白的物质 二氧化硫 氯水 双氧水 漂白粉 活性炭 漂白 原理 二氧化硫 与有色物 质结合生 成不稳定 的化合物 次氯酸的 强氧化性 将有色物 质氧化为 无色物质 双氧水的 强氧化性 将有色物 质氧化为 无色物质 在酸性条 件下生成 次氯酸具 有强氧化 性 吸附 作用 品红 溶液 褪色,加 热后恢复 红色 褪色,加 热后不恢 复红色 褪色,加 热后不恢 复红色 褪色,加 热后不恢 复红色 褪色 石蕊 溶液 变红,不 褪色 先变红, 后褪色 先变红, 后褪色 先变蓝, 后褪色 褪色 漂白后所 得物质的 稳定性 不稳定 稳定 稳定 稳定 是否是化 学变化 是 是 是 是 否 SO2与CO2性质的比较 1.物理性质 SO2 CO2 气味 有刺激性气味 无味 毒性 有毒 无毒 溶解性 易溶(体积比140) 可溶(体积比11) 2.化学性质 3.SO2与CO2的鉴别 (1)利用SO2的还原性,用酸性KMnO4溶液或溴水作试剂,观察溶液是否褪色。 (2)利用SO2的漂白性,用品红溶液鉴别。 典例题组训练 题组一 硫的单质 1.下列说法不正确的是( D ) ①硫是一种能溶于水的黄色晶体 ②火山喷出物中含有大量含硫化合物 ③硫在空气中燃烧的产物是二氧化硫 ④硫在纯氧中燃烧的产物是三氧化硫 A.①② B.②③ C.③④ D.①④ 解析: 硫是一种不溶于水的黄色晶体;硫不论在空气中还是纯氧中,燃烧的产物都是SO2。 2.(双选)下列说法中不正确的是( AD ) A.在自然界中无游离态的硫存在 B.试管内壁的硫粉可以用热的碱液除去 C.硫与变价金属反应,生成金属的低价态化合物 D.硫的氧化性比氯气的强 解析:游离态的硫存在于火山喷口附近或地壳的岩层里,A错误。S可以与热的烧碱反应,B正确。硫的氧化性较弱,与变价金属化合时,只能生成低价态金属硫化物,如S与Fe、Cu的反应,生成FeS和Cu2S;氯气的氧化性较强,Cl2与Fe、Cu反应生成高价态金属化合物FeCl3、CuCl2,C正确,D错误。 (1)硫与变价金属反应时生成低价态的金属硫化物,而氯气与变价金属反应时生成高价态的金属氯化物。如Fe与S反应生成FeS,Fe与Cl2反应生成FeCl3,从而体现出Cl2的氧化性强于S。 (2)S与氧气反应只能生成SO2,与反应条件、反应物的用量无关。 (3)金属汞洒落在地面可撒些硫黄覆盖,防止汞蒸气中毒,因为常温下,Hg+S===HgS。 题组二 二氧化硫的性质 3.(双选)下图所示装置可用于收集SO2并验证SO2的某些化学性质,下列说法正确的是( AB ) 选项 试剂 现象 结论 A 酸性KMnO4 溶液 溶液褪色 SO2有还原性 B 品红溶液 溶液褪色 SO2有漂白性 C NaOH溶液 无明显现象 SO2与NaOH溶液不反应 D 紫色石 蕊溶液 溶液变红 后不褪色 SO2有酸性,没有漂白性 解析:SO2使酸性KMnO4溶液褪色,体现其还原性,A项正确;SO2为酸性氧化物,能与NaOH溶液反应,2NaOH+SO2===Na2SO3+H2O(或NaOH+SO2===NaHSO3),但无明显现象,C项错误;SO2能使紫色石蕊溶液变红是由于SO2与H2O反应生成的H2SO3具有酸性,但SO2无酸性,SO2具有漂白性,能使品红溶液褪色,但不能使酸碱指示剂褪色,B项正确,D项错误。 4.向BaCl2溶液中通入SO2气体后,未见沉淀,继续通入下列物质仍未出现明显变化的是( C ) A.NH3 B.Cl2 C.CO2 D.H2S 解析:向BaCl2溶液中通入SO2气体后,二氧化硫与水反应生成亚硫酸,亚硫酸不与氯化钡反应,故未见沉淀。若继续通入NH3,则其可以与亚硫酸反应生成亚硫酸铵,进而与氯化钡反应生成亚硫酸钡沉淀。若继续通入Cl2,其可以把亚硫酸氧化为硫酸,进而与氯化钡反应生成硫酸钡沉淀。若继续通入H2S,则其可以与亚硫酸反应生成硫单质。只有通入CO2仍未出现明显变化,故选C。 在分析SO2性质的相关题目时要注意SO2性质的多样性:酸性氧化物的通性、还原性、氧化性、漂白性,尤其要区分褪色与漂白性的对应关系。 题组三 二氧化硫的漂白性 5.(双选)下列说法正确的是( BC ) A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色 B.能使品红溶液褪色的不一定是SO2 C.SO2、漂白粉、活性炭都能使红墨水褪色,其原理不相同 D.将SO2和Cl2等物质的量混合后,通入装有湿润的有色布条的集气瓶中,漂白效果更好 解析:A项中SO2能使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红溶液褪色才体现其漂白性,SO2不能使石蕊溶液褪色;B项中能使品红溶液褪色的物质很多,不仅仅是SO2;C项中各漂白剂的漂白原理不尽相同;D项中SO2和Cl2等物质的量混合后与H2O发生反应SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。 (1)SO2的漂白原理与氯水不同,其原理是SO2与有色物质结合生成不稳定的无色物质,加热后,无色物质分解为原来的物质和SO2。 (2)SO2 能漂白品红、鲜花等有机色素,不能漂白酸碱指示剂,如酚酞、石蕊等 题组四 鉴别CO2和SO2 6.有一无色混合气体,其成分是CO2和SO2,试设计实验证明该气体的成分,并画出装置图。 答案: 将气体依次通过:品红溶液―→酸性KMnO4溶液―→品红溶液―→澄清石灰水。①中品红溶液褪色,可验证SO2的存在,③中品红溶液不褪色,且④中澄清石灰水变浑浊可验证CO2的存在。 解析:验证SO2通常用品红溶液,验证CO2通常用澄清石灰水,但SO2也可使澄清石灰水变浑浊,因此验证CO2前应先除尽SO2,一般选用酸性KMnO4溶液除去SO2,用品红溶液验证其是否除尽。 (1)鉴别SO2和CO2,不能用澄清的石灰水,因为二者通入澄清石灰水时,现象相同:开始产生白色沉淀,后来沉淀又逐渐溶解。 (2)要检验SO2、CO2混合气体中的CO2,必须先除去SO2(一般用溴水或KMnO4酸性溶液),再通入澄清的石灰水。 题组五 SO3的性质 7.下列有关三氧化硫的说法中,正确的是( A ) A.三氧化硫与水反应生成H2SO4 B.SO3不属于酸性氧化物 C.硫粉在过量的氧气中燃烧生成SO3 D.SO2、SO3均具有漂白性,能使石蕊试液褪色 解析:SO3是酸性氧化物,硫粉与过量O2反应只生成SO2,SO2具有漂白性,SO2、SO3均能使石蕊试液变红。 核心素养 1.检验SO2和CO2同时存在的一般流程 SO2和CO2均可使澄清石灰水变浑浊,若通入的气体过量,沉淀都可以溶解消失。检验SO2、CO2混合气体中存在CO2的一般流程如下: 2.漂白性物质分类汇总 【例1】 某学生课外活动小组利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液颜色变为红色,冷却后恢复无色,则( ) A.溶有SO2的品红溶液 B.溶有NH3的酚酞溶液 C.溶有SO2的酚酞溶液 D.溶有Cl2的品红溶液 【解析】 二氧化硫和有色物质反应生成无色物质,但二氧化硫的漂白性不稳定,加热时溶液又恢复原来的颜色,所以溶有二氧化硫的品红溶液符合题意,A正确;氨气和水反应生成一水合氨,一水合氨电离出OH-而使溶液呈碱性,酚酞遇碱变红色,加热条件下,一水合氨易分解生成氨气而使溶液褪色,B错误;二氧化硫和水反应生成亚硫酸,酚酞在酸性溶液中为无色,二氧化硫不能使酸碱指示剂褪色,C错误;氯气和水反应生成次氯酸,次氯酸具有强氧化性而使品红溶液褪色,且次氯酸的漂白性具有不可逆性,D错误。 【答案】 A 【例2】 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。 (1)有同学认为制得的SO2中可能混有杂质,其化学式为________和________,原因是_________________________________。 (2)为验证气体成分,兴趣小组同学设计了下图所示装置进行了实验探究。 ①为验证并吸收SO2,装置B中加入的试剂为________,装置C中品红溶液的作用是_____________________________________; ②装置D中加入的试剂为_______________________________; ③装置G中可能出现的现象为__________________________; ④装置H的作用为__________________________。 (3)兴趣小组设计如图装置验证二氧化硫的化学性质。 ①能验证SO2具有氧化性的实验现象为__________________________________________________; ②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验: 方案Ⅰ:向第一份溶液加入品红溶液,红色褪去 方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀 方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成 上述方案中合理的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________。 【解析】 (1)铁钉中含有的C在加热条件下会和浓硫酸反应生成CO2;随着反应进行,浓硫酸变稀,铁与稀硫酸反应产生氢气,故制得的SO2中可能混有的杂质为CO2和H2。 (2)①装置B中加入酸性KMnO4溶液能检验并吸收SO2,若SO2被吸收完全,装置C中品红溶液不褪色;②装置D中加入澄清石灰水,可检验气体中是否有CO2;③装置E中浓硫酸可干燥气体,装置F中CuO与H2反应生成H2O,G中无水硫酸铜吸收水蒸气后变蓝色;④装置H装有干燥剂,其作用为防止空气中H2O进入干燥管而影响H2的检验。 (3)①Na2S和SO2发生氧化还原反应生成S,故a试管中有淡黄色沉淀生成;②方案Ⅱ合理,SO2被氧化生成SO,和Ba2+反应生成白色沉淀,据此能证明SO2的还原性,试管b中发生反应的离子方程式为Cl2+SO2+2H2O===4H++2Cl-+SO。 【答案】 (1)CO2 H2 铁钉中含有的C在加热条件下会和浓硫酸反应生成CO2 ;随着反应进行,浓硫酸变稀,铁与稀硫酸反应产生氢气 (2)①酸性KMnO4溶液(或其他合理答案也可) 验证SO2是否吸收完全 ②澄清石灰水 ③无水硫酸铜变蓝色 ④防止空气中H2O进入干燥管而影响H2的检验 (3)①a试管中有淡黄色沉淀生成 ②Ⅱ Cl2+SO2+2H2O===4H++2Cl-+SO查看更多