【化学】山西省长治市第二中学2019-2020学年高二上学期期末考试(解析版)
山西省长治市第二中学2019-2020学年高二上学期期末考试
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Si-28 Cr-52 Fe-56 I-127
第Ⅰ卷(选择题 共48分)
一、选择题(每小题3分,共48分。每小题只有一个正确选项,将正确答案填在答题卡上)
1.化学与社会、生活密切相关。下列说法正确的是
A. 棉花、羊毛、蚕丝和麻是天然纤维
B. 蛋白质溶液中,加入浓的硫酸铵溶液有沉淀析出,加水后沉淀不溶解
C. 油脂是单位质量内产生能量最高的营养物质,有共同的水解产物乙二醇
D. 聚乳酸是一种可降解高分子材料,它是由单体之间通过加聚而合成的
【答案】A
【解析】
【详解】A. 棉花、羊毛、蚕丝和麻均是自然界原有的或经人工培植的植物上、人工饲养的动物上直接取得的纺织纤维,均属于天然纤维,故A符合题意;
B. 浓的硫酸铵溶液可使蛋白质盐析,盐析是可逆的,加水后蛋白质又会溶解,故B不符合题意;
C.油脂属于高级脂肪酸甘油酯,其水解的共同产物是丙三醇,故C不符合题意;
D. 聚乳酸是由羟基和羧基脱水而形成的,属于缩聚反应,而不是 加聚反应,故D不符合题意;
综上,本题选A。
2.下列由电子排布式或排布图所得的结论错误的是
选项
电子排布式或排布图
结论
A
1s22s22p63s23px2
违背洪特规则
B
1s22s22p63s23p63d3
违背能量最低原理
C
Ni原子的价电子排布图
该原子处于基态
D
S原子的电子排布图
违背泡利原理
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.3p轨道上的两个电子应排在不同轨道上, 违背洪特规则,故A不符合题意;
B. 排布时应先排能量低的4s轨道,而不是排能量高的3d,违反了能量最低原理,故B不符合题意;
C. Ni原子序数为28,其价电子排布式为3d84s2,当价电子排布图为时,该原子处于基态,故C不符合题意;
D. S原子电子排布图,违背了洪特规则,故D符合题意;
综上,本题选D。
【点睛】解决此类问题应熟记泡利原理以及洪特规则。泡利原理指出:在一个原子轨道里,最多只能容纳两个电子,而且它们的自旋状态相反;洪特规则指出:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
3.山萘酚结构简式如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是
A. 山萘酚含有苯环和羟基、醚键、羰基、碳碳双键五种官能团
B. 可发生取代反应、水解反应、加成反应
C. 可与NaOH反应,不能与NaHCO3反应
D. 1 mol山萘酚与溴水反应最多可消耗4 mol Br2
【答案】C
【解析】
【分析】
从山萘酚结构简式入手,分析该物质中含有的官能团,从而推测其性质。如:该物质中含有羟基、醚键、羰基、碳碳双键四种官能团,可发生加成反应、取代反应等
【详解】A.苯环不属于官能团,山萘酚含有羟基、醚键、羰基、碳碳双键四种官能团,故A不符合题意;
B.由结构简式可知,山萘酚中不含酯基、卤原子这类能水解的官能团,不能发生水解反应,故B不符合题意;
C.山萘酚中含有酚羟基,具有酸性,但酸性比碳酸弱,则可与NaOH反应,不能与NaHCO3反应,故C符合题意;
D.山萘酚分子中含有3个酚羟基,共有4个邻位H原子可被取代,且含有1个碳碳双键,可与溴发生加成反应,共需5mol,故D不符合题意;
综上,本题选C。
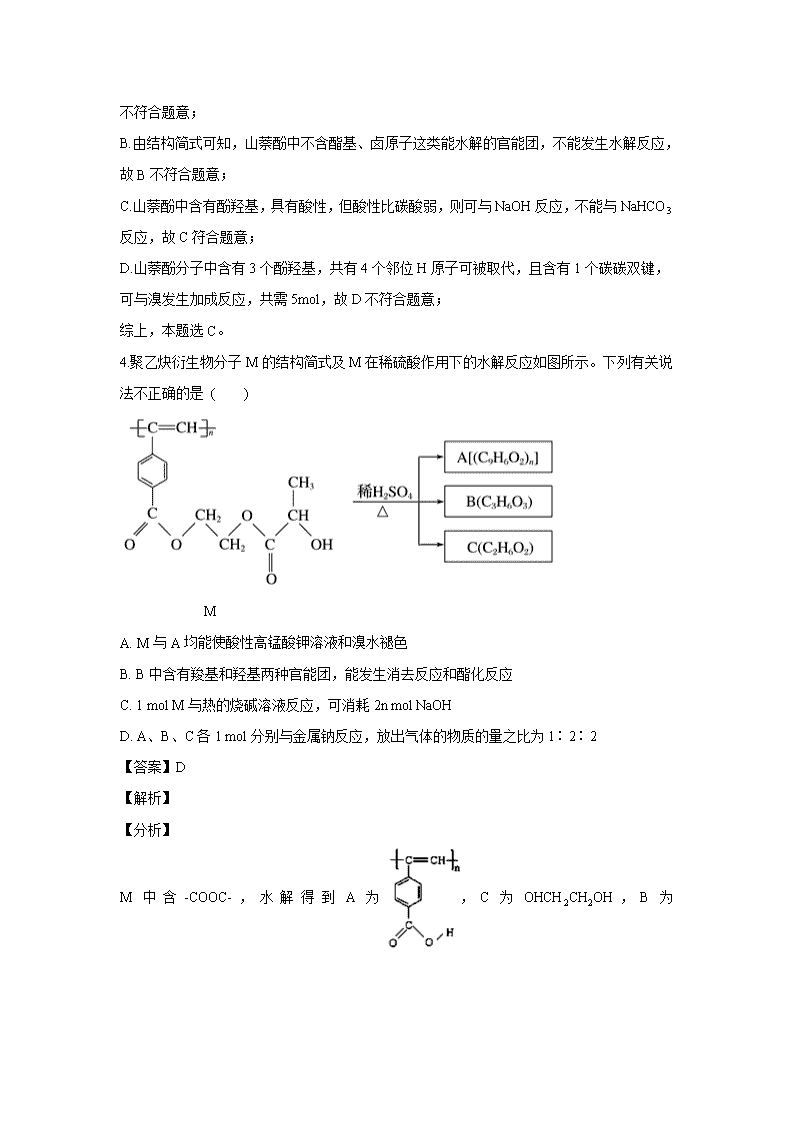
4.聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
【答案】D
【解析】
【分析】
M中含-COOC-,水解得到A为,C为OHCH2CH2OH,B为
,据此分析作答。
【详解】A、M、A中均含碳碳双键,则均能使酸性高锰酸钾溶液和溴水褪色,正确;
B、B中含-OH、-COOH,-OH可发生消去反应,-OH、-COOH可发生酯化反应,正确;
C、1molM中含2nmol-COOC-,则1molM与热的烧碱溶液反应,可消耗2n mol的NaOH,正确;
D、由2-COOH~2-OH~H2↑可知,A、B、C各1mol分别与金属钠反应,放出的气体的物质的量之比为n:2:2,错误;
答案选D。
5.铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。下列说法正确的是
A. Fe3+基态核外价电子排布式[Ar]3d5
B. 1 mol丙酮能与2mol Ag(NH3)2OH发生反应
C. C、H、O三种元素的原子半径按由小到大的顺序为H
e;电负性:d>a
C. 气态氢化物的稳定性:a>e>d
D. a与b形成的化合物不可能含有共价键
【答案】C
【解析】
【分析】
短周期元素中a为-2价、e为+6价,处于VIA族,可推知a为O、e为S,b有+1价,原子序数大于氧,则b为Na,由原子序数可以知道c、d处于第三周期,化合价分别为+3、+5,则c为Al、d为P,据此分析;
【详解】A. 33e和34e互为同位素,化学性质不会有明显不同,故A不符合题意;
B.同周期从左到右第一电离能增大,但是原子外层电子为全满或半充满状态,第一电离能较大,则第一电离能d>e,电负性dS>P,则气态氢化物的稳定性:a>e>d,故C符合题意;
D.a为O,b为Na,形成的化合物Na2O2中含有共价键,故D不符合题意;
综上,本题选C。
13.X、Y、Z、W 为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙,丙常用于制作光导纤维。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是
A. 四种元素中,W的原子半径最大
B. 反应①②③都属于氧化还原反应
C Na着火时,不可用甲扑灭
D. 一定条件下,x与甲反应生成丁
【答案】A
【解析】
【分析】
本题主要考查元素周期表和元素周期律,碳、硅及其化合物之间的性质,结合元素周期律进行分析。W形成的最高价氧化物丙常用于制作光导纤维,则W为Si。X、W为同一主族,则X为C。在高温下碳与二氧化硅反应生成W和丁,则丁为一氧化碳。y2为氧气,碳与氧气反应生成甲为二氧化碳,Z为镁,镁在二氧化碳中点燃生成碳和乙(为氧化镁)。
【详解】A.同周期元素原子半径自左而右逐渐减小,同主族元素原子半径自上而下逐渐增大,所以镁原子半径最大,故A符合题意;
B.反应①二氧化碳与镁反应、反应②碳与氧气反应、反应③高温下碳与二氧化硅反应都属于氧化还原反应,故B不符合题意;
C.Na可以在二氧化碳中继续燃烧,故C不符合题意;
D.高温下碳与二氧化碳反应生成一氧化碳,故D不符合题意;
综上,本题选A。
14.下列有机物同分异构体数目判断错误的是
选项
有机物
同分异构体数目
A
某烃相对氢气的密度为28,且不能使溴的四氯化碳溶液褪色
2
B
萘的七氯代物
4
C
分子式为C5H12O,可被氧化为醛
4
D
分子式为C3H8O的醇与分子式为C4H8O2的羧酸形成的酯
4
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.相对氢气的密度为28,则摩尔质量为56g/mol,可知分子式为C4H8,不能使溴的四氯化碳溶液褪色,说明不含碳碳双键,满足该条件的同分异构体数目共2种:甲基环丙烷和环丁烷,故A不符合题意;
B.萘中共含有9个氢,其七氯代物和二氯代物的同分异构体是一样多的。先根据等效氢找一氯代物, 由结构对称可知,萘中含2种位置的H,则其一氯代物有2种(),二氯代物有10种,同理,萘的七氯代物共有10种,故B符合题意;
C.分子式为C5H12O,可被氧化为醛的有机分子中含有-CH2OH结构,所以符合条件的分子的种类,即是丁基的种数,共四种,故C不符合题意;
D.C3H8O分子式可对应的醇有2种:CH3CH2CH2OH、CH3CHOHCH3,分子式为C4H8O2的羧酸有2种:CH3CH2CH2COOH、CH3CH(CH3)COOH,两者之间组合形成的酯有4种,故D不符合题意;
综上,本题选B。
15.常温下,下列有关溶液的说法正确的是
A. pH相等的①NH4Cl ②NH4Al(SO4)2 ③NH4HSO4溶液:浓度的大小顺序为①>②>③
B. HA的电离常数Ka =4.93×10−10,则等浓度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A−)
C. NaHCO3溶液加水稀释,c(Na+)与c(HCO3−)的比值将减小
D. 已知在相同条件下酸性HF >CH3COOH,则物质的量浓度相等的NaF与CH3
COOK溶液中:c(Na+) – c(F−) >c(K+ ) − c(CH3COO−)
【答案】A
【解析】
A.NH4Cl水解时氯离子不影响铵根离子水解,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于NH4Cl,NH4Al(SO4)2中铝离子水解抑制铵根离子的水解,因此NH4Al(SO4)2中NH4+的浓度大于NH4Cl,浓度的大小顺序应为:①>②>③,选项A正确;B、NaA中水解平衡常数Kb=,水解平衡常数大于电离平衡常数,c(HA)−),选项B错误;C、NaHCO3溶液加水稀释,促进碳酸氢根离子水解,钠离子物质的量不变,碳酸氢根 减小,c(Na+)与c(HCO3-)的比值保持增大,选项错误;D、HF 、CH3COOH都是弱酸,所以NaF与CH3COOK都是强碱弱酸盐,由于酸性HF >CH3COOH,水解程度F-<CH3COO-,水解程度越大剩余离子浓度越小,故c(Na+) – c(F−)<c(K+ ) − c(CH3COO−),选项D错误。答案选A。
16.化合物A经李比希法和质谱法分析得知其分子式是C8H8O2,相对分子质量为136。A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,不正确的是
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. 符合题中A分子结构特征的有机物只有一种
C. 1mol A在一定条件下可与3mol H2发生加成反应
D. 与A属于同类化合物的同分异构体只有3种
【答案】D
【解析】
【分析】
有机物A的分子式C8H8O2
,不饱和度为5,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,峰面积之比为1:2:2:3,则四种氢原子个数之比=1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为
【详解】A.A分子中含有酯基,属于酯类化合物,在一定条件下能发生水解反应,故A不符合题意;
B.符合题中A分子结构特征的有机物为,只有一种,故B不符合题意;
C.1mol有机物A含有1mol苯环,可以与3mol氢气发生加成反应,故C不符合题意;
D.与A属于同类化合物,应含有酯基、苯环,若为羧酸与醇形成的酯有:甲酸苯甲酯,若为羧酸与酚形成的酯,可以是乙酸酚酯,可以是甲酸与酚形成的酯,甲基有邻、间、对三种位置,故5种异构体,故D符合题意;
综上,本题选D。
第Ⅱ卷(非选择题 共52分)
二、非选择题
17.X、Y、Z、M、R、Q为元素周期表中前四周期元素,且原子序数之和为105。X位于周期表的s区,有两种氧化物;Y是良好的半导体材料,晶体Y结构与金刚石类似;Z原子价电子层的p轨道半充满,核外电子总数是最外层电子数的3倍;X+与M-相差一个电子层;M原子得到一个电子后3p轨道全充满;R有“生物金属”之称,R4+离子和氩原子的核外电子排布相同。
请回答下列问题:
(1)六种元素中电负性最大的是____________(填元素符号),其最高能级电子云的形状是______形;Z的价电子排布图为____________;Y、Z、M最高价含氧酸的酸性由强到弱的顺序是__________________。(用化学式表示)
(2)X、Y、Z、M的第一电离能由小到大的顺序是____________(填元素符号),若M元素第一次电离能突变出现在In,则n=_____。
(3)Q元素可形成两种常见的离子Q2+与Q3+,其中化学性质较稳定的是__________(填离子符号),其原因是______________________。
(4)与R位于同周期的元素中,基态原子的电子排布中4s轨道上只有1个电子的元素有____________(填元素名称)。
【答案】 (1). Cl (2). 哑铃(纺锤) (3). (4). HClO4 >H3PO4 >H2SiO3 (5). NaH3PO4>H2SiO3,故答案为:Cl、哑铃(纺锤)、、HClO4 >H3PO4 >H2SiO3;
(2) Na、Si、P、Cl处于同一周期,随原子序数递增,第一电离能逐渐增大,故第一电离能由小到大的顺序是:Na”“<”或“=”)。
(2)下列各项可说明反应达到平衡状态的是_______
a.容器内压强保持不变 b.v(N2)正 = 3v(H2)逆
c.容器内N2、H2、NH3浓度比为1:3:2
d.混合气体平均摩尔质量保持不变
e.混合气体密度保持不变
(3)以下措施中,既能加快反应速率,又能增大 H2转化率的是______
a.升高温度 b.减小容器体积 c.使用催化剂d.不断增加 H2的浓度 e.移走NH3
(4)某温度下,在1L恒温恒容容器中充入1mol N2和3mol H2进行上述反应,10min达平衡,此时容器内压强变为原来的。
①该过程的平均反应速率v(NH3)=__________
②N2的平衡转化率为_______
③此温度下的平衡常K=________(保留至小数点后两位)
④此时若保持容器温度和体积不变,向其中再加入2.25mol N2和0.5mol NH3,则平衡_______(填“正向”“逆向”或“不”)移动。
【答案】 (1). > (2). ad (3). b (4). 0.05mol/(Lmin) (5). 25% (6). 0.03 (7). 不
【解析】
【分析】
(1)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)结合勒夏特烈原理进行分析;
(4)根据反应过程中的三段式求解。
【详解】(1)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数K1>K2,故答案为:>;
(2)a.随反应进行,混合气体物质的量变化,容器内压强发生变化,压强保持不变说明到达平衡,故a正确;
b.平衡时不同物质表示的正逆速率之比等于化学计量数之比,应是3v(N2)正=v(H2)逆时反应到达平衡状态,故b错误;
c.容器内N2、H2、NH3浓度比与起始浓度及转化率有关,平衡时不一定等于化学计量数之比,故c错误;
d.混合气体总质量不变,随反应进行,混合气体物质的量变化,则平均摩尔质量变化,若混合气体平均摩尔质量保持不变,说明到达平衡,故d正确;
e.混合气体总质量不变,容器容积不变,混合气体密度始终保持不变,故e错误;
故答案为:ad;
(3) a.升高温度反应速率加快,平衡逆向移动, H2转化率降低,a错误;
b.减小容器体积反应速率加快,平衡正向移动, H2转化率升高,b正确;
c.使用催化剂反应速率加快, H2转化率不变,c错误;
d.不断增加 H2的浓度反应速率加快, H2转化率降低,d错误;
e.移走NH3反应速率减慢, H2转化率升高,e错误;
综上,答案为:b;
(4) 在1L恒温恒容容器中充入1mol N2和3mol H2,10min达平衡,
N2(g)+3H2(g)═2NH3(g)
起始量(mol):1 3 0
转化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
压强之比等于物质的量之比,则
=,计算得出x=0.25,
①v(NH3)= =0.05mol•L-1•min-1;
②氮气转化率= ×100%=25%;
③此温度下的平衡常 == 0.03;
④此时若保持容器温度和体积不变,并再向其中再加入2.25mol N2和0.5mol NH3,则容器中各物质浓度为3mol/L N2、2.25 mol/L H2、1 mol/L NH3,此时的平衡常数 ==0.03,加入气体前后平衡常数不变,即平衡不移动;
综上,答案为:0.05mol/(L.min)、 25% 、0.03 、 不
20.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)以难溶物CrOH(H2O)5SO4的形式回收,处理工艺流程如下:
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子
Fe3+
Mg2+
Al3+
Cr3+
Ca2+
沉淀完全时的pH
3.7
11.1
5.4(>8溶解)
9(>9)溶解
13.9
(1)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式: _______________________。
(2)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。但溶液的pH不能超过8,其理由是_______________
(3)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________。
(4)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐
AgCl
AgI
AgCN
Ag2CrO4
AgSCN
颜色
白
黄
白
砖红
白
Ksp
1.8×10-10
8.3×10-17
1.2×10-16
3.5×10-11
1.0×10-12
滴定时可选为滴定指示剂的是________(填字母),滴定终点的现象是_________________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
【答案】 (1). 2Cr3++3H2O2+H2O=Cr2O72-+8H+ (2). pH超过8会使部分Al(OH)3
溶解生成AlO2-,最终影响Cr(III)的回收与再利用 (3). Mg2+、Ca2+ (4). B (5). 当滴入最后一滴标准液时,出现砖红色沉淀,且半分钟内沉淀颜色不改变
【解析】
分析】
(1)三步法配平离子方程式①化合价升降相等配平化合价变化的元素②根据左右两边电荷守恒确定氢离子系数③根据左右两边原子守恒确定水的系数;
(2) pH>8会使部分Al(OH)3溶解;
(3)学会知识迁移,联想硬水的软化就可确定Ca2+和Mg2+,或者根据阳离子互换原则确定;
(4)指示剂选择原则①颜色变化明显②Ksp略微大于AgSCN。
【详解】(1)三步法配平离子方程式①化合价升降相等配平化合价变化的元素②根据左右两边电荷守恒确定氢离子系数③根据左右两边原子守恒确定水的系数,离子方程式为2Cr3++3H2O2+H2O=Cr2O72-+8H+;故答案为:2Cr3++3H2O2+H2O=Cr2O72-+8H+;
(2)由表格可知,pH>8时会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)的回收与再利用,故答案为:pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)的回收与再利用;
(3)根据框图转化关系可知,滤液Ⅱ中主要阳离子为Na+、Mg2+ 、Ca2+,钠离子交换树脂就是对滤液Ⅱ进行离子交换,交换的离子是Mg2+ 、和Ca2+,增加的是Na+,故答案为:Mg2+、Ca2+;
(4)指示剂选择原则①颜色变化明显②Ksp略微大于AgSCN,确定K2CrO4作为指示剂,滴定终点现象是当滴入最后一滴标准液时,沉淀由白色变为砖红色,且半分钟内沉淀颜色不再改变。故答案为:B、当滴入最后一滴标准液时,出现砖红色沉淀,且半分钟内沉淀颜色不改变
【点睛】解决工艺流程这类问题时要知晓该流程的目的,看懂生产流程图;了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;解析流程图并思考从原料到产品依次进行了什么反应,利用了什么原理。每一步操作进行到什么程度最佳,每一步除目标物质外还产生了什么杂质或副产物,杂质或副产物是怎样除去的等等。其次本题(4)中考察:沉淀滴定法中指示剂选择原则除了一定要现象明显,还要注意指示剂离子沉淀浓度略大于测定离子所需沉淀浓度。