- 2021-07-03 发布 |
- 37.5 KB |
- 19页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学反应的速率、方向和限度课件(19张)(全国通用)
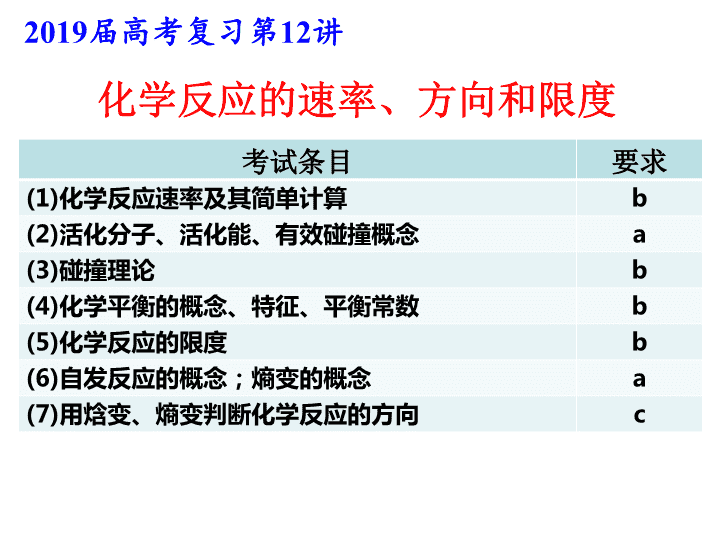
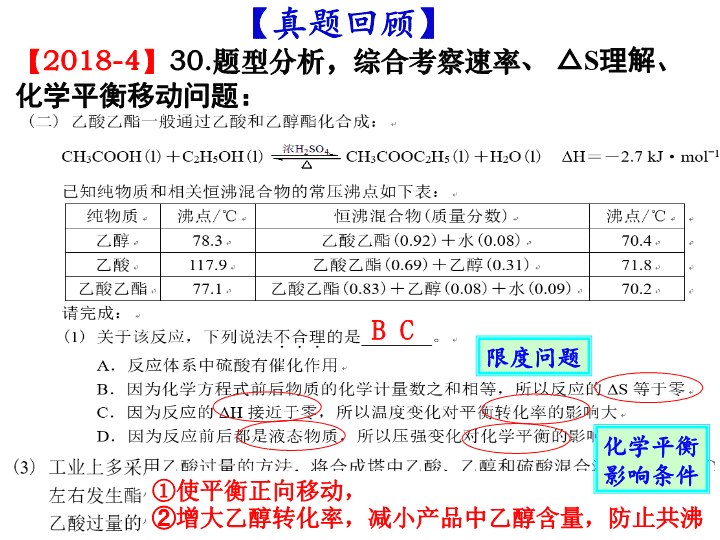
化学反应的速率、方向和限度 2019 届高考复习第 12 讲 考试条目 要求 (1) 化学反应速率及其简单计算 b (2) 活化分子、活化能、有效碰撞概念 a (3) 碰撞理论 b (4) 化学平衡的概念、特征、平衡常数 b (5) 化学反应的限度 b (6) 自发反应的概念;熵变的概念 a (7) 用焓变、熵变判断化学反应的方向 c 判据:反应焓变(△ H ) 反应熵变(△ S ) 认识化学反应 方向 限度 定量 描述: 化学平衡常数 平衡转化率 影响因素: T 、 c 、 P 化学反应速率有差别: 定量 描述: 化学反应速率 影响因素: c 、 P 、 T 、催化剂 速率 【2018-4】 30. 题型分析,综合考察速率、 △ S 理解、化学平衡移动问题: ① 使平衡正向移动, ② 增大乙醇转化率,减小产品中乙醇含量 ,防止共沸 B C 【 真题回顾 】 限度问题 化学平衡影响条件 【2017-11】 30. 综合考察 速率理论、 转化率 、化学平衡移动、平衡常数计算问题: B C 反应放热,温度升主,平衡向正向移动。 同时,温度升高导致十氢萘气化,浓度增大,平衡正向移动,生成氢气量显著增加。 平衡移动问题 1.951 关于 K 的计算 速率理论 【2017-4】 30. 综合考察自发性判断 、平衡( vs . 相同时间 ) 转化率 、化学平衡移动、平衡常数计算问题: CO 2 转 化 率 选择性 解题关键 — 图像识别: 经过相同时间的 CO 2 转化率 ①下列说法不正确的是 ________ A .△ H 4 小于零 B .温度可影响产物的选择性 C . CO 2 平衡转化率随温度升高先增大后减少 D .其他条件不变,将 CO 2 和 H 2 的初始体积比改变为 1 ∶ 3 ,可提高 CO 2 平衡转化率 CD ② 350 ℃时,反应Ⅰ在 t 1 时刻达到平衡,平衡时容器体积为 V L 该温度下反应Ⅰ的平衡常数为 ________( 用 a 、 V 表示 ) 625V 2 /a 2 1 、 K 的计算注意: ①物质的状态 ②容器的体积 2 、 影响 K 的外界因素及 K 的意义: ①只与 T 有关②只衡量反应程度 ③ 350℃ 下 CH 4 物质的量随时间的变化曲线如图 3 所示。 画出 400℃ 下 0~ t 1 时刻 CH 4 物质的量随时间的变化曲线。 升温, 反应放热逆向移动 反应速率加快 温度对 平衡 的影响 温度对 速率 的影响 对比分析两个反应,哪个是自发反应? 1 、 自发反应 :在 一定条件 下,无需 外界帮助 就能自动进行的反应。 ⑴一定条件指的是一定温度和一定压强, 外界帮助 可以是 通电、光照等。 ⑵自发反应在 恰当条件 下才能实现。 【 概念辨析 】 化学反应进行的方向 一、化学反应自发进行的方向 2 、物质的混乱度趋于增加 1 、物质具有的能量趋于降低 H ( 焓变 ) S ( 熵变 )>0 焓 ( H ) 判据 熵 ( S ) 判据 放热 反应 焓变 熵变 化学反应能否自发进行 自发进行 不自发进行 低温 有利于自发 高温 有利于自发 H <0 H <0 H >0 H >0 S >0 S >0 S <0 S <0 熵增 原理 <0 △H >0 , △ S> 0 : 较高温度下自发进行 判断下列反应能否自发进行,什么条件下自发进行? 1. Mg(s)+2HCl(aq) = MgCl 2 (aq) + H 2 (g) △H <0 , △ S> 0 : 一定能自发进行 2 . CO 2 (g)+H 2 O(l)+CaCl 2 (aq)=CaCO 3 (s)+2HCl(l) △H >0 , △ S< 0 : 一定非自发进行 3. NH 3 (g)+HCl(g)=NH 4 Cl(s) △H <0 , △ S< 0 : 较低温度下自发进行 4. NH 4 Cl(s) =NH 3 (g)+HCl(g) 3 、复合判据: 反应物本身的性质 内因 影响化学反应速率的条件及原因 外因 浓度 压强 温度 催化剂 固体接触面、 光、电、射线等 浓度越大,反应速率越快 温度每升高 10℃ 反应速率加快 2-4 倍 有催化剂反应速率加快 固体接触面大,反应速率大 只适用于 气体 参加的反应 增加一种反应物,反应速率一定增大吗? 增加反应物浓度,正逆反应速率都是立即增大吗? 改变压强,反应速率一定改变吗? 对于有气体参加的反应,压强不变速率一定不变吗? 温度升高,放热、吸热反应的速率都增大吗? 二、化学反应速率 用单位时间内反应物的 物质的量浓度 的减少或生成物的物质的量浓度的增加来表示。 单位体积内活化分子多,在单位时间内发生 有效碰撞 的次数就多,化学反应速率就大 有效碰撞理论: 活化分子 取向合适 有效碰撞 ( 能量足够 ) 强调:活化分子的碰撞不一定都是有效碰撞。 【 问题 】 ① 什么是活化分子? ② 什么是有效碰撞? ③ 发生有效碰撞的条件是什么? 【 问题 】 怎样改变外界条件,可以使 单位体积内 活化分子增多? 活化分子浓度 13 13 理论解释 ( 有 气体 参加的化学反应 ) 单位体积内 项目 条件改变 活化 能 分子 总数 活化 分子 数 活化分 子 百分 数 有效 碰撞 次数 化学 反应 速率 增大浓度 增大压强 升高温度 加催化剂 不变 不变 不变 减小 增加 增加 不变 不变 增加 增加 增加 增加 不变 不变 增加 增加 增加 增加 增加 增加 增大 增大 增大 增大 哪些条件改变能够增大活化分子百分数? (16.10)30 ⑶ ③ 有研究表明, Cl 2 与 NaOH 溶液 生成 NaClO 3 的反应分两步进行: Ⅰ 2ClO - =ClO 2 - +Cl - Ⅱ ClO 2 - +ClO - =ClO 3 - +Cl - 常温下,反应 Ⅱ 能快速进行,但氯气与 NaOH 溶液反应很难得到 NaClO 3 ,试用 碰撞理论 解释其原因。 反应 Ⅰ 活化能高,活化分子百分数低,不利于 ClO - 向 ClO 3 - 转化 ②反应 2 的活化能比反应 1 小,相同温度下反应 2 更快,所以相同时间内,生成的四氢化萘大部分都转化为萘,故 x 1 显著低于 x 2 。 (18.4)30 ( 3 ) (16.04)18 . X(g)+3Y(g) ⇌ 2Z(g) Δ H= - a kJ·mol ˉ 1 , 一定条件下,将 1 mol X 和 3 mol Y 通入 2L 的恒容密闭容器中,反应 10min ,测得 Y 的物质的量为 2.4 mol 。下列说法正确的是 A . 10min 内, Y 的平均反应速率为 0.03 mol·L ˉ1 ·s ˉ1 B .第 10min 时, X 的反应速率为 0.01 mol·L ˉ1 ·min ˉ1 C . 10min 内,消耗 0.2 mol X ,生成 0.4 mol Z D . 10min 内, X 和 Y 反应放出的热量为 a kJ 平均反应速率、瞬时反应速率 可逆反应的热量变化 C [ 练习 ] 一定温度下,向体积为 2L 的密闭容器中冲入 3mol A 和 2mol B ,发生反应 3A(g) + 2B(s) ⇌ 2C(g)+ D(g) Δ H= - 50 kJ·mol -1 , 5min 达到平衡测得 C 为 1mol ,下列说法正确的是 ( ) A 、 1~5min 内, v(B)=0.1mol/(L.min) B 、 5min 时, v(C)=0.1mol/(L.min) C 、达到平衡时, 3v 正 (A)=2v 逆 (C) D 、温度升高,逆反应速率增大,正反应速率减少 E 、 5min 内, A 和 B 反应放出的热量为 25 kJ E 三、化学反应限度 1. 概念:当可逆反应的 正向反应速率与逆向反应速率相等 时,反应物与生成物的 浓度 就不再改变,我们就说这一反应达到了“限度”。 这种化学反应状态常被称为 化学平衡状态 ,简称“化学平衡”。 判断:是否为可逆反应? 3H 2 +N 2 2NH 3 高温高压 催化剂 NiO 2 +Cd+2H 2 O Ni(OH) 2 + Cd(OH) 2 放 电 充电 能够说明 N 2 + 3H 2 2NH 3 反应在密闭容器中已达到平衡状态的是 : ①容器内 N 2 、 H 2 、 NH 3 三者共存 ②容器内 N 2 、 H 2 、 NH 3 三者浓度相等 ③容器内 N 2 、 H 2 、 NH 3 的浓度比恰为 1:3:2 ④t min 内,生成 1molNH 3 同时消耗 0.5molN 2 ⑤t min 内,生成 1molN 2 同时消耗 3molH 2 ⑥ v 正 (N 2 )=3v 逆 (H 2 ) ⑦ 容器内质量不随时间的变化而变化 ⑧容器内压强不随时间的变化而变化 ⑨容器内气体密度不再发生变化 ⑩容器内的平均摩尔质量不再发生变化 ⑾ 某时间内断裂 3molH-H 键的同时,断裂 6molN-H 键 容器内的平均摩尔质量不变,作为已达平衡的判据,对所有反应都适用吗? 密度不变作为达平衡的判据,适用于怎样的情况? 变化着的量不变了 2 、化学平衡状态判断 √ √ 指“总质量”,若换成某物质质量不变,可作平衡的判据吗 ? √ √ √ 【 练习 】 可逆反应: 2NO 2 (g) 2NO(g) + O 2 (g) , 在体积固定的密闭容器中,达到平衡状态的标志是( ) ①单位时间内生成 n molO 2 的同时生成 2n molNO 2 ② 单位时间内生成 n molO 2 的同时生成 2n molNO ③ 用 NO 2 、 NO 、 O 2 表示的反应速率之比为 2:2:1 的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态 A A 、 ①④⑥⑦ B 、 ②③⑤⑦ C 、 ①③④⑤ D 、全部 √ × √ √ √ × ×查看更多