- 2021-07-03 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高三化学下学期第二次调研测试3月试题
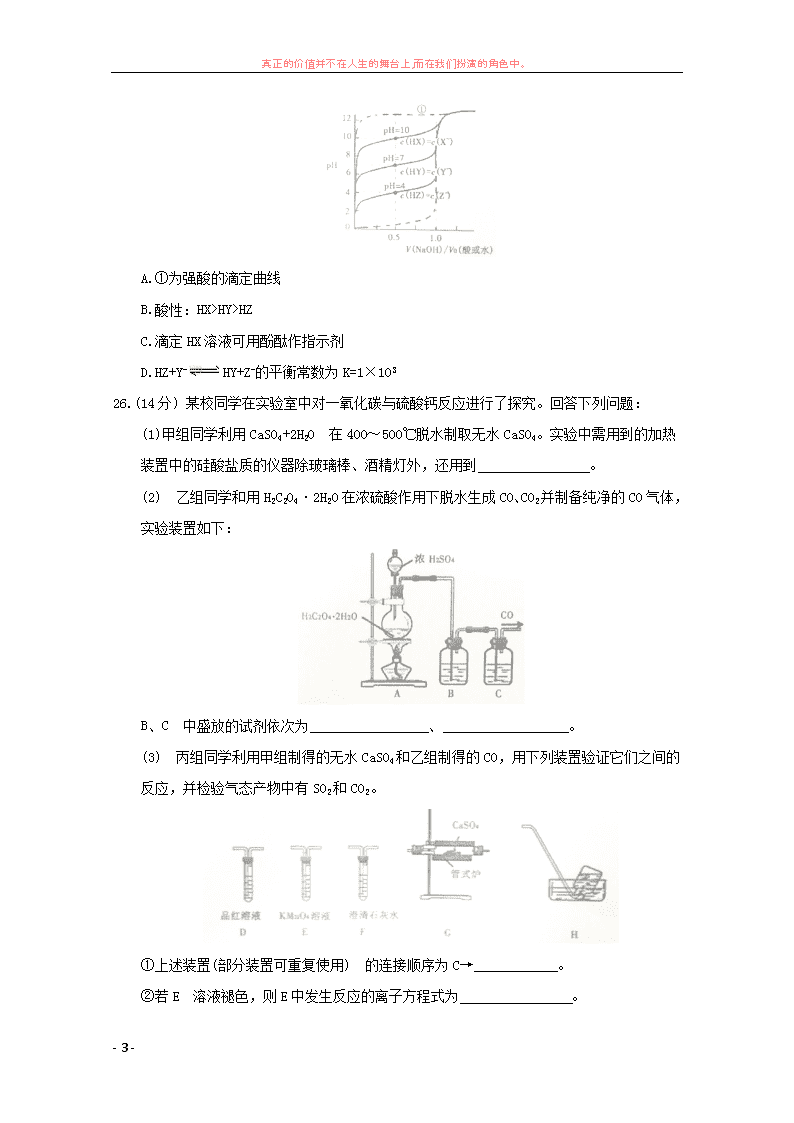
真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 1 - 漳州市 2018 届高中毕业班第二次调研测试 理科综合试题化学部分 7.中华民族有 5000 多年的文明史,我国历史上出现许多记载文明的书写材料。下列材料主要 成分为蛋白质的是 A.竹简 B.青铜 C.丝帛 D.纸张 8.NA 为阿伏加德罗常数的值,下列说法正确的是 A.标准状况下,2.24 L 乙烷与 2.24L 苯含 C-H 键数均为 0.6NA B.16.8 Fe 与足量的水蒸气加热充分反应,转移电子数为 0.8 NA C.25℃时,1LpH=7 的 CH3COONH4 溶液中含 NH4 +数一定为 1.0×10-7 NA D.0.2 mol CO2 与 0.1molC 在密闭容器中充分反应生成 CO 分子数为 0.2 NA 9.化合物 W、X 、Y、Z 的分子式均为 C7H8,Z 的空间结构类似于篮子。下列说法正确的是 A.化合物 W 的同分异构体只有 X、Y、Z B.X、Y 、均可与酸性 KMnO4 溶液反应 C.1mol X、1mol Y 与足量 Br2/CCl4 溶液反应最多消耗 Br2 均为 2mol D.Z 的一氧代物只有 3 种 10.最近报道的一种处理垃圾渗滤液并用其发电的示意图如下。装置工作时,下列说法错误的 是 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 2 - A.盐桥中 Cl-向 Y 极移动 B.化学能转变为电能 C.电子由 X 极沿导线流向 Y 极 D.Y 极发生的反应为 2NO3 -+10e-+12H+=N2+6H2O,周围 pH 增大 11.W、X、Y、Z 是原子序数依次增大的短周期主族元素,W、Z 同主族,W 的氢化物水溶液可用 于蚀刻玻璃,Y 的最外层电子数是 X 的 3 倍,Y 的最高正价与最低负价代数和为 4。下列 说法错误的是 A.原子半径:X>Y>Z>W B.简单氢化物的稳定性:W>Z>Y C.Z 的氧化物的水化物的酸性一定比 Y 的强 D.一定条件下,X 的单质可与 W、Y、Z 的单质分别发生化合反应 12.由下列实验及现象得出的结论正确的是 实验 现象 结论 A SO2 与 H2S 气体混合 产生淡黄色固体 氧化性:SO2>S B 向盛有 FeSO4 溶液的试管中滴入氯水, 然后滴入 KSCN 溶液 滴入 KSCN 后溶 液变为红色 原 FeSO4 溶液已被空气中 O2 氧化变质 C 试管中盛有 Cu(NO3)2 溶液,底部有铜 可与稀硫酸反应 铜粉逐渐溶解 铜可与稀硫酸反应 D 向 2 支盛有 2mL 相同浓度的 NaOH 溶液 的试管中分别滴入 2 滴相同浓度的 AlCl3 和 MgCl2 溶液,振荡并静置 前者无沉淀,后者 有白色沉淀 Ksp[Al(OH)3]> Ksp[Mg(OH)2] 13.物质的量浓度相同的三种一元弱酸 HX、HY、HZ 及一种一元强酸还有纯水,分别用相同浓 度 NaOH 溶液进行滴定,V(NaOH)/V0 与 PH 的关系如下图所示:下列说法正确的是 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 3 - A.①为强酸的滴定曲线 B.酸性:HX>HY>HZ C.滴定 HX 溶液可用酚酞作指示剂 D.HZ+Y- HY+Z-的平衡常数为 K=1×103 26.(14 分) 某校同学在实验室中对一氧化碳与硫酸钙反应进行了探究。回答下列问题: (1)甲组同学利用 CaSO4+2H2O 在 400~500℃脱水制取无水 CaSO4。实验中需用到的加热 装置中的硅酸盐质的仪器除玻璃棒、酒精灯外,还用到 。 (2) 乙组同学和用 H2C2O4·2H2O 在浓硫酸作用下脱水生成 CO、CO2 并制备纯净的 CO 气体, 实验装置如下: B、C 中盛放的试剂依次为 、 。 (3) 丙组同学利用甲组制得的无水 CaSO4 和乙组制得的 CO,用下列装置验证它们之间的 反应,并检验气态产物中有 SO2 和 CO2。 ①上述装置(部分装置可重复使用) 的连接顺序为 C→ 。 ②若 E 溶液褪色,则 E 中发生反应的离子方程式为 。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 4 - ③能证明有 CO2 生成的实验依据是 。 ④若 G 中产物为 CaO,则 G 中发生反应的化学方程式为 。 (4)丁组的同学取丙组实验后 G 装置中的固体产物加入试管中,然后加入足量稀盐酸,固 体完全溶解且产生少量气体,通入 CuSO4 溶液有黑色沉淀产生。可验证 CO 与 CaSO4 在高 温下还发生了一个副反应,该反应为 。(用方程式表示)。 27.(15 分) 一种利用电解锰阳极泥( 主要成分 MnO2、MnO) 制备 MnO2 的工艺流程如下: (1)“煅烧氧化”时,1mol MnO 煅烧完全转化为 Na2MnO4 失去电子的物质的量 为 ;MnO2 煅烧反应的化学方程式为 。 (2)“浸取”时,为提高 Na2MnO4 的浸取率,可采取的措施有 、 (列 举 2 点) (3)“调 pH”是将溶液 pH 调至约为 10,防止 pH 较低时 Na2MnO4 自身发生氧化还原反应, 生成 MnO2 和 ;写出用 pH 试纸测定溶液 pH 的操作 。 (4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为 。 (5) 测定产品中 MnO2 质量分数的步骤如下: 步骤 1. 准确称取 mg 产品,加入 c1mol·L-1Na2C2O4 溶液 V1mL (过量) 及适量的稀硫酸, 水浴加热煮沸一段时间。 (已知:Na2C2O4+2H2SO4+ MnO2= MnSO4+2CO2↑+2H2O+ Na2SO4) 步骤 2. 然后用 c2mol·L-1KMnO4 标准溶液滴定剩余的 Na2C2O4 滴定至终点时消耗 KMnO4 标准 溶液 V2mL。 (已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O) 步骤 2 达滴定终点时判断依据是 ;产品中 MnO2 的质量分数 为ω(MnO2)= (列出计算的表达式即可)。 28.(14 分) 石油产品中除含有 H2S 外还含有各种形态的有机硫,如 COS、CH3SH。回答下列问 题: (1) CH3SH(甲硫醇) 的电子式为 。 (2)一种脱硫工艺为:真空 K2CO3-克劳斯法。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 5 - ①K2CO3 溶液吸收 H2S 的反应为 K2CO3+H2S KHS+KHCO3,该反应的平衡常数的对数值 lgK= 。 (已知:H2CO3lgK1= -6.4,lgK2= -10.3;H2S lgK1=-7,lgK2=-19) ②已知下列热化学方程式: a. 2H2S(g)+3O2=2SO3(g)+2H2O(1) △H1=-1172kJ·mol-1 b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2=-632 kJ·mol-1 克劳斯法收硫的反应为 SO2 和 H2S 气体反应生成 S(s),则该反应的热化学方程式 为 。 (3) Dalleska 等人研究发现在强酸溶液中可用 H2O2 氧化 COS 脱除硫。该脱除反应的化 学方程式为 。 (4)COS 水解反应为 COS(g)+H2O(g) CO2(g)+H2S(g) △H=-35.5 kJ·mol-1。 用活性ɑ- Al2O3 催化,在其它条件相同时,改变反应温度,测得 COS 水解转化率如图 1 所示;某温度时,在恒容密闭容器中投入 0.3 mol H2O(g)和 0.1mol COS,COS 的平衡 转化率如图 2 所示。 ①图 1 活性ɑ- Al2O3 催化水解,随温度升高 COS 转化率先增大后又减小的可能原因 是 。 ②由图 2 可知,P 点时平衡常数 K= (填计算结果)。 ③活性ɑ-Al2O3 催化水解,为提高 COS 的转化率可采取的措施是 。 35.[物质结构与性质] (15 分) 硫、钴及其化合物用途非常广泛。回答下列问题: (1) 基态 Co 原子价电子轨道排布式为 ,第四电离能 I4(Co)查看更多
相关文章
- 当前文档收益归属上传用户