- 2021-07-03 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习元素周期表元素周期律学案
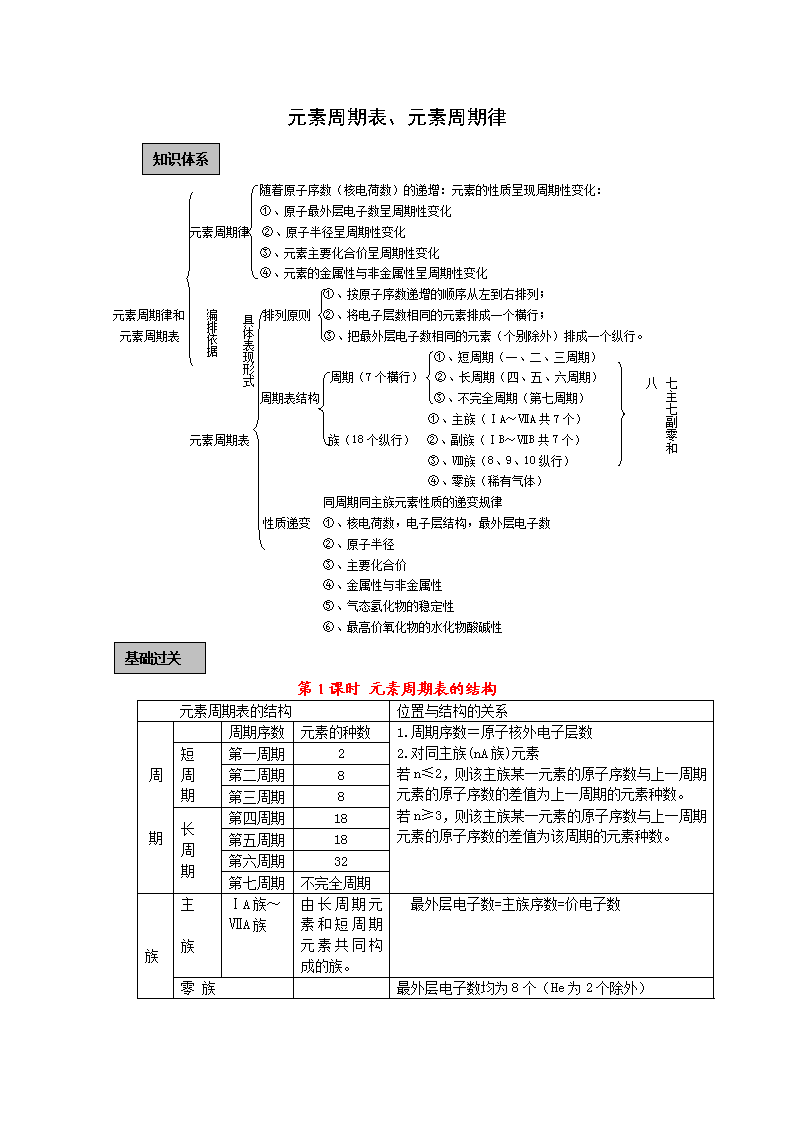
元素周期表、元素周期律 知识体系 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化: ①、原子最外层电子数呈周期性变化 元素周期律 ②、原子半径呈周期性变化 ③、元素主要化合价呈周期性变化 ④、元素的金属性与非金属性呈周期性变化 ①、按原子序数递增的顺序从左到右排列; 具体表现形式 编排依据 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 七主七副零和八 三长三短一不全 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA~ⅦA共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB~ⅦB共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 性质递变 ①、核电荷数,电子层结构,最外层电子数 ②、原子半径 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 基础过关 第1课时 元素周期表的结构 元素周期表的结构 位置与结构的关系 周 期 周期序数 元素的种数 1.周期序数=原子核外电子层数 2.对同主族(nA族)元素 若n≤2,则该主族某一元素的原子序数与上一周期元素的原子序数的差值为上一周期的元素种数。 若n≥3,则该主族某一元素的原子序数与上一周期元素的原子序数的差值为该周期的元素种数。 短 周 期 第一周期 2 第二周期 8 第三周期 8 长 周 期 第四周期 18 第五周期 18 第六周期 32 第七周期 不完全周期 族 主 族 ⅠA族~ ⅦA族 由长周期元素和短周期元素共同构成的族。 最外层电子数=主族序数=价电子数 零 族 最外层电子数均为8个(He为2个除外) 副 族 ⅠB族~ ⅦB族 只由长周期元素构成的族 最外层电子数一般不等于族序数(第ⅠB族、ⅡB族除外) 最外层电子数只有1~7个。 第Ⅷ族 有三列元素 ★★掌握元素周期表的结构中各族的排列顺序,结合惰性气体的原子序数,我们可以推断任意一种元素在周期表中的位置。记住各周期元素数目,我们可以快速确定惰性气体的原子序数。各周期元素数目依次为2、8、8、18、18、32、32(如果第七周期排满),则惰性气体原子序数依次为2、2+8=10、10+8=18、18+18=36、36+18=54、54+32=86、86+32=108。 典型例题 【例1】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是 A.原子半径: 丙<丁<戊 B.金属性:甲>丙 C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙 解析:同周期元素原子半径是减小的,故A错;同主族元素金属性自上而下是增强的,故B错;同周期的元素的金属性越来越弱,故对应碱的碱性也是减弱的,C正确;同周期的最外层电子数越来越多,故D错。 答案:C 【例2】(武汉一模) X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( ) A.元素非金属性由弱到强的顺序为Z<Y<X B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 C.3种元素的气态氢化物中,Z的气态氢化物最稳定 D.原子半径由大到小的顺序为Z>Y>X [解析]在解有关周期表的题目时,首先要确定元素在周期表中的位置,实在推不出具体的位置,推出相对位置也可以。因X原子的最外层电子数是其电子层数的3倍,所以在本题中的突破口就能推出X元素即为O,而在短周期中能与O同主族的就只有S元素,即为Y,而Z原子的核外电子数比Y原子少1,也就不难得出Z元素即为P元素,A选项中三元素非金属性由弱到强的顺序为P<S<O,S的最高价氧化物对应水化物的分子式为H2YO4,三种元素的气态氢化物中,最稳定的是H2O,而不是磷化氢;D选项中半径大小比较是正确的,最后本题的答案为AD。 [答案]AD 【例3】 X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表: 元素 相关信息 X X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 Y 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 Z Z和Y同周期,Z的电负性大于Y W W的一种核素的质量数为63,中子数为34 (1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。 (2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。 (3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。 (4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。 已知: XO(g)+O2(g)=XO2(g) H=-283.0 kJ·mol-2 Y(g)+ O2(g)=YO2(g) H=-296.0 kJ·mol-1 此反应的热化学方程式是 。 答案:(1)3 VIA HClO4 (2)2 H-Z H-Y (3)[Ar]3d104s1 2Cu2S+3O2=2Cu2O+2SO2 (4)2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ/mol 解析:由表中可知,X为C Y为 S Z为 Cl W为Cu 基础过关 第2课时 元素周期律 涵 义 元素性质随着元素原子序数的递增而呈周期性变化。 实 质 元素性质的周期性递变是核外电子排布周期性变化的必然结果。 核外电 子排布 最外层电子数由1递增至8(若K层为最外层则由1递增至2)而呈现周期性变 化。 原子半径 原子半径由大到小(稀有气体元素除外)呈周期性变化。原子半径由电子层数和核电荷数多少决定,它是反映结构的一个参考数据。 主要化合价 最高正价由+1递变到+7,从中部开始有负价,从-4递变至-1。(稀有气体元素化合价为零), 呈周期性变化。元素主要化合价由元素原子的最外层电子数决定,一般存在下列关系:最高正价数=最外层电子数 元素及化合物的性质 金属性渐弱,非金属性渐强,最高氧化物的水化 物的碱性渐弱,酸性 渐强,呈周期性变化。这是由于在一个周期内的元素,电子层数相同,最外层电子数逐渐增多,核对外层电子引力渐强,使元素原子失电子渐难,得电子渐易,故有此变化规律。 典型例题 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。 (1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。 (2)J和氢组成的化合物分子有6个原子,其结构简式为______。 (3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。 (4)L的最简单气态氢化物甲的水溶液显碱性。 ①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。 ②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。 选项 a b c d x 温度 温度 加入H2的物质的量 加入甲的物质的量 y 甲的物质的量 平衡常数K 甲的转化率 生成物物质的量总和 (5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。 解析: (1) J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元素,则T为氯元素,处于第三周期第七主族 (2)J和氢组成含有6个原子的分子为乙烯,其结构简式为 (3)M和T形成的化合物为,与水反应,其中氯化氢气体呈雾状 (4)①氨水与双氧水发生氧化还原反应: 生成无污染的氮气; ②甲在固体体积的密闭容器中发生分解反应,表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小 (5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式 答案:(1) ; ⅦA (2) (3), (4)① ②a和c;a或c (5) 基础过关 第3课时 同周期、同主族元素性质的递变规律 同周期(左→右) 同主族(上→下) 原子结构 核电荷数 逐渐增大 增大 电子层数 相同 增多 原子半径 逐渐减小 逐渐增大 化合价 最高正价由+1→+7负价数=8-族序数 最高正价和负价数均相同,最高正价数=族序数 元素的金属性和非金属性 金属性逐渐减弱,非金属性逐渐增强。 金属性逐渐增强,非金属性逐渐减弱。 单质的氧化性和还原性 氧化性逐渐增强,还原性逐渐减弱。 氧化性逐渐减弱,还原性逐渐增强。 最高价氧化物的水化物的酸碱性 酸性逐渐增强,碱性逐渐减弱。 酸性逐渐减弱,碱性逐渐增强。 气态氢化物的稳定性、还原性,水溶液的酸性。 稳定性逐渐增强,还原性逐渐减弱,酸性逐渐增强。 稳定性逐渐减弱,还原性逐渐增强,酸性逐渐减弱。 简单微粒半径的比较方法 原 1.电子层数相同时,随原子序数递增,原子半径减小 子 半 径 例:rNa>rMg>rAl>rSi>rp>rs>rCl 2.最外层电子数相同时,随电子层数递增原子半径增大。 例:rLi<rNa<rk<rRb<rCs 离 子 半 径 1.同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子.例:rCl->rCl,rFe>rFe2+>rFe3+ 1. 电子层结构相同的离子,核电荷数越大,半径越小. 例:rO2->rF->rNa+>rMg2+>rAl3+ 2. 带相同电荷的离子,电子层越多,半径越大. 例:rLi+<rNa+<rK+<rRb+<rcs+;rO2-<rs2-<rse2-<rTe2- 3. 带电荷、电子层均不同的离子可选一种离子参照比较。 例:比较rk+与rMg2+可选rNa+为参照可知rk+>rNa+>rMg2+ 元素金属性和非金属性强弱的判断方法 金 属 性 比 较 本质 原子越易失电子,金属性越强。 判 断 依 据 1.在金属活动顺序表中越靠前,金属性越强。 2.单质与水或非氧化性酸反应越剧烈,金属性越强。 3.单质还原性越强或离子氧化性越弱,金属性越强。 4.最高价氧化物对应水化物的碱性越强,金属性越强。 5.若xn++y=x+ym+ 则y比x金属性强。 非 金 属 性 比 较 本质 原子越易得电子,非金属性越强。 判 断 方 法 1.与H2化合越易,气态氢化物越稳定,非金属性越强。 2.单质氧化性越强,阴离子还原性越弱,非金属性越强。 3.最高价氧化物的水化物酸性越强,非金属性越强。 4.An-+B=Bm-+A 则B比A非金属性强。 典型例题 【例1】下列有关化学研究的正确说法是 A.同时改变两个变量来研究反映速率的变化,能更快得出有关规律 B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 C.依据丁达尔现象可将分散系分为溶液、胶体与浊液 D.从HF、HCl、、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 【解析】答案:B 本题侧重考查反应速率、盖斯定律、分散系、元素周期律重要的基本概念,规律 A. 同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律 B. 这是盖斯定律的表述 C. 分散系的划分是以分散质颗粒大小来区分的 D. 在以酸性强弱作为判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据的。 【例2】几种短周期元素的原子半径及主要化合价如下表: 元素代号 X Y Z W 原子半径/pm 160 143 70 66 主要化合价 +2 +3 +5、+3、-3 -2 下列叙述正确的是 A.X、Y元素的金属性 X查看更多