- 2021-07-03 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广东省湛江市第一中学高二上学期第一次大考化学试题 解析版
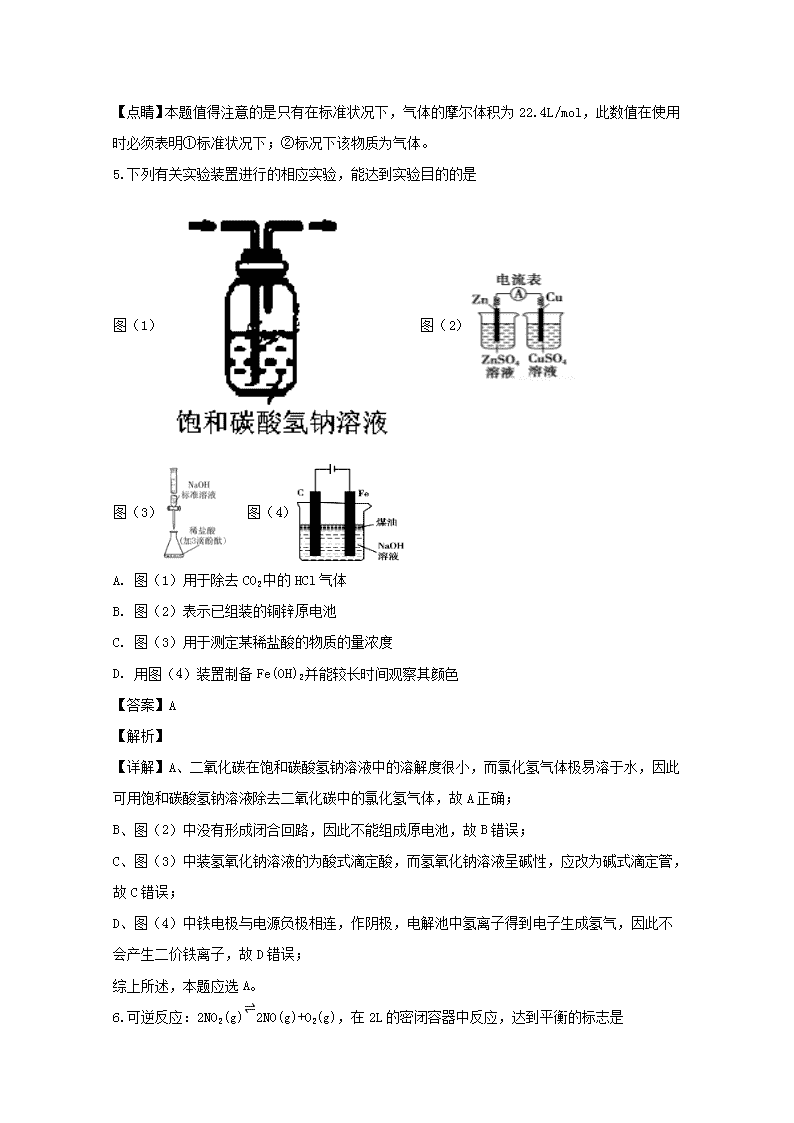
广东省湛江第一中学2018-2019学年高二上学期第一次大考化学试题 1.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( ) A. 萃取 B. 渗析 C. 蒸馏 D. 干馏 【答案】C 【解析】 乙醇和水的沸点相差较大,因此涉及的操作方法是蒸馏,答案选C。 点睛:掌握常见物质分离与提纯的方法是解答的关键,易错选项是A,注意萃取与蒸馏的区别,蒸馏是依据混合物中各组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,二者的原理是不同的。 2.以下关于甲烷的说法中错误的是 A. 甲烷分子是由极性键构成的分子 B. 甲烷分子具有正四面体结构 C. 甲烷分子中四个C-H键是完全等价的键 D. 甲烷分子中具有非极性键 【答案】D 【解析】 【详解】A、甲烷分子中含有碳氢极性键,故A不符合题意; B、甲烷分子是正四面体结构,碳原子位于正四面体中心,四个氢原子位于正四面体四个角,故B不符合题意; C、甲烷分子是正四面体结构,甲烷分子中四个C-H键是完全等价的键,故C不符合题意; D、甲烷分子中只含有碳氢极性键,故D符合题意. 综上所述,本题应选D。 3.类推是学习和研究的重要思维方法。下列类推结论正确的是 化学事实 类推结论 A Al在O2中燃烧生成Al2O3 Fe在O2中燃烧也生成Fe2O3 B pH=3的盐酸稀释1000倍后pH=6 pH=6的盐酸稀释1000倍后pH=9 C 用电解熔融MgCl2的方法冶炼金属镁 用电解熔融NaCl的方法制取金属钠 D 将CO2和Na2O2反应生成Na2CO3与O2 将SO2与Na2O2反应生成Na2SO3与O2 A. A B. B C. C D. D 【答案】C 【解析】 【详解】A、Fe在氧气中燃烧生成Fe3O4,故A错误; B、无论盐酸稀释多少倍,溶液始终不会显碱性,故B错误; C、钠和镁都是活泼金属,工业中采用电解熔融氯化镁制备镁单质,采用电解熔融氯化钠制备金属钠,故C正确; D、二氧化硫具有还原性,过氧化钠具有强氧化性,两者发生氧化还原反应生成硫酸钠,故D错误; 综上所述,本题应选C。 4.NA为阿伏加德罗常数的值.下列叙述正确的是 A. 在1.0mol·L-1 的NaHCO3溶液中,含有的Na+ 数为1NA B. 标准状况下,2.24 LCCl4中含有的分子总数为0.1NA C. 金属钠与水反应,生成22.4L氢气时,转移的电子数为2NA D. 1 mol氢氧根离子与1 mol铵根离子所含电子数均为10 NA 【答案】D 【解析】 【详解】A、在1.0mol·L-1 的NaHCO3溶液中则溶液中钠离子的浓度为1mol/L,因为没有给定溶液的体积,所以不能确定钠离子的个数,故A错误; B、标准状况下,CCl4 为液态,故B错误; C、题干中没有给出是否在标准状况下,因此22.4L氢气的物质的量不能确定,故转移电子数不能确定,故C错误; D、1个氢氧根离子含有10个电子,1铵根离子含有10个电子,因此1 mol氢氧根离子与1 mol铵根离子所含电子数均为10 NA,故D正确; 综上所述,本题应选D。 【点睛】本题值得注意的是只有在标准状况下,气体的摩尔体积为22.4L/mol,此数值在使用时必须表明①标准状况下;②标况下该物质为气体。 5.下列有关实验装置进行的相应实验,能达到实验目的的是 图(1) 图(2) 图(3) 图(4) A. 图(1)用于除去CO2中的HCl气体 B. 图(2)表示已组装的铜锌原电池 C. 图(3)用于测定某稀盐酸的物质的量浓度 D. 用图(4)装置制备Fe(OH)2并能较长时间观察其颜色 【答案】A 【解析】 【详解】A、二氧化碳在饱和碳酸氢钠溶液中的溶解度很小,而氯化氢气体极易溶于水,因此可用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体,故A正确; B、图(2)中没有形成闭合回路,因此不能组成原电池,故B错误; C、图(3)中装氢氧化钠溶液的为酸式滴定酸,而氢氧化钠溶液呈碱性,应改为碱式滴定管,故C错误; D、图(4)中铁电极与电源负极相连,作阴极,电解池中氢离子得到电子生成氢气,因此不会产生二价铁离子,故D错误; 综上所述,本题应选A。 6.可逆反应:2NO2(g)⇌2NO(g)+O2(g),在2L的密闭容器中反应,达到平衡的标志是 A. 单位时间内生成n mol O2的同时生成2n mol NO B. 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 C. 混合气体的颜色不再改变的状态 D. 混合气体的密度不再改变的状态 【答案】C 【解析】 【详解】A、单位时间内生成n mol O2的同时生成2n mol NO,描述的均为正反应,没有提到逆反应,不能说明v(正)=v(逆),因此不能判断反应达到平衡状态,故A不符合题意; B、对于正反应(或逆反应)说在任何时刻NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1,不能说明v(正)=v(逆),故B不符合题意; C、二氧化氮是红棕色气体,颜色不变时说明二氧化氮浓度保持不变,因此可以证明反应达到平衡状态,故C符合题意; D、恒容条件下,该反应气体的质量不变,体积也不变,所以反应过程中气体密度一直不变,因此密度不变不能证明反应达到平衡状态,故D不符合题意; 综上所述,本题应选C。 【点睛】本题考查化学平衡状态的判断,注意分析时应从平衡状态的两个重要特征上判断(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变.考查学生的知识运用能力、灵活分析处理实际问题的能力. 7.下列离子方程式正确的是( ) A. Cl2通入水中: Cl2+H2O=2H++Cl -+C1O- B. 双氧水中加入稀硫酸和KI 溶液: H2O2+2H++2I-=I2+2H2O C. 用铜作电极电解CuSO4 溶液: 2Cu2++ 2H2O 2Cu+ O2↑+ 4H+ D. Na2S2O3溶液中加入稀硫酸: 2S2O32-+4H+=SO42- + 3S↓+ 2H2O 【答案】B 【解析】 试题分析:A、Cl2通入水中的离子反应为Cl2+H2O⇌H++Cl-+HClO,故A错误;B、双氧水中加入稀硫酸和KI溶液的离子反应为H2O2+2H++2I-═I2+2H2O,故B正确;C、用铜作电极电解CuSO4溶液,实质为电镀,阳极Cu失去电子,阴极铜离子得电子,故C错误;D、Na2S2O3溶液中加入稀硫酸的离子反应为S2O32-+2H+═SO2↑+S↓+H2O,故D错误;故选B。 考点:考查了离子方程式的书写的相关知识。 视频 8.下列说法正确的是 A. 无论是纯水,还是酸性、碱性或中性稀溶液,其c(H+)·c(OH-)=1×10-14 B. c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液 C. 常温下,Ksp[Mg(OH)2]=5.6×10−12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10−4 mol·L−1 D. 加热蒸干AlCl3溶液然后灼烧得到Al(OH)3固体 【答案】C 【解析】 【详解】A、可逆反应的化学平衡常数受温度的影响,水的离子积受温度影响,没有指明温度,故A错误; B、水的离子积受温度影响,温度升高,水的离子积增大,所以c(H+)=1×10-7 mol·L-1的溶液不一定是中性溶液,故B错误; C、常温下pH=10的溶液中氢氧根离子浓度为10-4 mol·L-1,故溶液中含Mg2+浓度最大值为Ksp /c2(OH-)=5.6×10−12/(1×10-4)2=5.6×10−4 mol·L−1,故C正确; D、铝离子水解生成氢氧化铝和氯化氢,加热蒸发,氯化氢挥发促进水解进行彻底,生成氢氧化铝沉淀,氢氧化铝受热易分解,灼烧,最后得到固体氧化铝,故D错误; 综上所述,本题应选C。 【点睛】可逆反应(电离平衡、水解平衡、沉淀溶解平衡等)的化学平衡常数受温度的影响。在使用水的离子积常数时必须要注明温度。 9.下列说法正确的是( ) A. 升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C. 增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多 D. 催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率 【答案】A 【解析】 【详解】A.升高温度,可增加反应物分子中活化分子的百分数,使反应速率增大,故A正确; B.增大压强,可增大单位体积的活化分子数目,但百分数不变,故B错误; C.增大反应物浓度,可增大单位体积内活化分子的数目,但百分数不变,故C错误; D.加入催化剂,降低反应物的活化能,增大活化分子的百分数,反应速率增大,故D错误;正确选项A。 【点睛】增大浓度,增大单位体积内活化分子的数目,但百分数不变,增大压强,缩小体积,相当于增大浓度,所以和增大浓度结论一样;升高温度、加入催化剂,可增加反应物分子中活化分子数,也增大活化分子的百分数。 10.依据如图判断,下列说法正确的是( ) A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1 B. 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低 C. 液态水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1 D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 【答案】C 【解析】 【详解】A.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量,故氢气的燃烧热为(483.6+88)/2=285.8 kJ·mol-1, A错误; B. 2 mol H2(g)与1 mol O2(g)反应生成2 mol H2O(g),放出热量483.6 kJ,所以2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量高,B错误; C.液态水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g),ΔH=+(483.6+88)=+571.6 kJ·mol-1,C正确; D.H2O(g)生成H2O(l)时,为物理变化,不存在化学键的断裂和生成,D错误; 正确选项C。 【点睛】明确反应热与物质总能量大小的关系是解题关键,根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题。 11.X、Y、Z、W均为短周期元素,且Y、Z、W在周期表的位置关系如下。已知X与W能形成最简单的有机物,则下列有关说法正确的是 W Y Z A. X能分别与Y、W形成化合物,且其所含化学键类型完全相同 B. W有多种同素异形体,且均具有高熔点、高沸点的性质 C. X的离子半径一定小于与Y同族的短周期元素的离子半径 D. Y、Z分别与X的常见稳定液态氧化物反应的剧烈程度:Y比Z更剧烈 【答案】D 【解析】 【分析】 最简单的有机物为CH4,则X为H,W为C,根据元素周期表元素位置关系可知Y为Na,Z为Mg。 【详解】A、H与Na形成的化合物为NaH,化学键为离子键,与C形成的化合物为有机物,含有的化合键为共价键,类型不同,故A错误; B、C的同素异形体有金刚石、C60等,其中金刚石为原子晶体,熔沸点较高,而C60的熔沸点比较低,故B错误; C、H的离子可能为H-,与Na同主族的元素可能为Li,H-和Li+的核外电子结构相同,由于H的核电荷数小于Li,因此H-的半径大于Li+,故C错误; D、H的稳定液态氧化物为H2O, Na与H2O反应的剧烈程度大于Mg,故D正确; 综上所述,本题应选D。 12.常温下,将一定浓度的某一元酸HA和0.1 mol·L-1 NaOH溶液等体积混合后,下列说法正确的是 A. 若pH=7,HA的浓度一定为0.1 mol·L-1 B. 若pH=7,A-的浓度大于Na+的浓度 C. 若pH<7,溶液中的微粒浓度关系为: c(Na+)=c(HA)+c(A-) D. 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol·L-1 【答案】D 【解析】 【详解】A.若pH=7,溶液呈中性,如果酸是强酸,酸碱的体积相等,要使溶液呈中性,则酸碱的浓度相等,如果酸是弱酸,要使溶液呈中性,则酸碱的浓度不相等,故A错误; B.若pH=7,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+ c(Na+)=c(OH-)+ c(A-),所以c(Na+)= c(A-),故B错误; C.若pH<7,溶液呈酸性,如果酸为强酸,由电荷守恒可知c(Na+)< c(A-);如果酸为弱酸,则弱酸过量,根据物料守恒得c(Na+)<c(HA)+c(A-),故C错误; D.若pH=12,且HA为强酸时,设HA的浓度为c, c(OH-)=10-2 mol·L-1=(0.1mol·L-1×VL-c mol·L-1×VL)/2VL,解得c=0.08 mol·L-1,故D正确; 综上所述,本题应选D。 13.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。 下列叙述正确的是 A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大 B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C. 负极反应为2H2O − 4e– = O2+4H+,负极区溶液pH降低 D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 【答案】B 【解析】 【分析】 与电源负极相连的为电解池阴极,得到电子,发生还原反应,电极反应为:H++2e-=H2 , 氢离子在阴极得电子生成氢气,考虑电荷守恒,两膜中间的钠离子会进入负极区,生成氢氧化钠;与电源正极相连的为电解池阳极,失去电子,发生氧化反应,电极反应为:4OH--4 e-=H2O+O2,两膜中间的硫酸根离子会进入正极区,生成硫酸。 【详解】A、阴离子向阳极(即正极区)移动,氢氧根离子放电PH减小,故A错误; B、直流电场的作用下,两膜中间的Na+和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室,通电时,氢氧根离子在阳极区放电生成水和氧气,两膜中间的硫酸根离子会进入正极区,生成硫酸;氢离子在阴极得电子生成氢气,两膜中间的钠离子会进入负极区,生成氢氧化钠,故可以得到NaOH和H2SO4产品,故B正确; C、与电源负极相连的为电解池阴极,得到电子,发生还原反应,电极反应为:H++2e-=H2,溶液pH增大,故C错误; D、根据电极反应4OH--4 e-=H2O+O2可知,每生成1mol氧气转移4mol电子,当电路中通过1mol电子的电量时,会有0.25mol O2生成,故D错误。 综上所述,本题应选B。 【点睛】本题重点考查电解池的原理。在电解池中,与电源负极相连的为电解池阴极,电解质溶液中阳离子得到电子,发生还原反应;与电源正极相连的为电解池阳极,若为活泼电解则电极失去电子(若为惰性电极,则电解质溶液中阴离子失电子),发生氧化反应。 14. 25℃时,下列有关溶液中各微粒的物质的量浓度关系正确的是 A. 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) B. 0.1mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) C. pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) D. pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) 【答案】B 【解析】 试题分析:A.0.1mol/L的NH4Cl溶液:NH4+会发生水解反应而消耗,所以c(Cl-)>c(NH4+);NH4+水解消耗水电离产生的OH-,使溶液中c(H+)>c(OH-),但是盐水解程度是微弱是,水解产生的离子浓度小于盐电离产生的离子浓度,所以c(NH4+)> c(H+),故溶液中离子浓度关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-),错误;B.醋酸是一元弱酸,其电离程度是微弱的,主要以酸分子形式存在,而且在溶液中还存在水电离产生的H+,所以c(H+)>c(CH3COO-),醋酸的电离作用大于水的电离作用,因此c(CH3COO-)>c(OH-),故在0.1mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-),正确;C. pH=4的FeCl3 溶液中,根据盐的化学式可知c(Cl-)>c(Fe3+);Fe3+发生水解反应,消耗水电离产生的OH-,当最终达到平衡时,c(H+)> c(OH-);但是盐水解的程度是微弱的,盐电离产生的离子浓度大于水解产生的离子浓度,故溶液中离子浓度关系是:c(Cl-)>c(Fe3+)>c(H+)>c(OH-),错误;D. pH=11的CH3COONa溶液,根据电荷守恒可得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),错误。 考点:考查有关溶液中各微粒的物质的量浓度关系正误判断的知识。 15.用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。 起始温度t1/℃ 终止温度 t2/℃ 温度差 (t2-t1) /℃ HCl NaOH 平均值 1 25.5 25.0 25.25 28.5 3.25 2 24.5 24.5 24.50 27.5 3.00 3 25.0 24.5 24.75 26.5 1.75 (1)从实验装置上看,图中尚缺少的一种玻璃仪器是 _________。 (2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。 (3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________温度。 (4)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。 (5)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ) (保留两位小数)。 (6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,则△H会_________(填“偏大”、“偏小”、“无影响”),其原因是_________。 【答案】 (1). 环形玻璃搅拌棒 (2). 减少实验过程中的热量损失 (3). 完全反应后混合溶液的最高温度 (4). 偏小 (5). 1.31 kJ (6). 偏大 (7). NH3.H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等) 【解析】 【详解】(1)在该实验中,为使盐酸与NaOH溶液充分混合,需要搅拌, 故图中缺少的玻璃仪器是环形玻璃搅拌棒; (2)中和热测定实验中,关键是减少热量损失,所以装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失; (3)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度, (4) 大烧杯上如不盖硬纸板,则会造成热量损失,导致测定温度差偏小,最终求得的中和热数值偏小; (5)第三次得到温度差误差较大,应该舍弃,所以平均温度差为(3.25+3.0)℃/2=3.125℃,溶液的质量为100mL×1g/Ml=100g,所以反应中放出的热量是4.18J/(g·℃ ) ×100g ×3.125℃=1306.25J=1.31 kJ; (6)一水合氨为弱碱,电离过程为吸热过程,放出的热量偏少,但酸碱中和为放热反应,所以用50 mL0.55mol/L的氨水代替NaOH溶液进行上述实验,测得的中和热△H会偏大; 16.某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。 (1)配制氯化铁溶液时,需先把氯化铁晶体溶解在盐酸中,再加水稀释,这样操作的目的是___。 (2)通入足量SO2时,装置C中观察到的现象为_______________。 (3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。 ①写出SO2与FeCl3溶液反应的离子方程式____________; ②检验有Fe2+生成的方法是____________; ③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法不合理,理由是____________。 (4)D装置中倒置漏斗的作用是____________。 (5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。 a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液 【答案】 (1). 抑制氯化铁水解 (2). 溶液由棕黄色变为浅绿色 (3). 2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+ (4). 取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有亚铁离子,不褪色说明没有亚铁离子 (5). 硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验 (6). 使气体充分吸收、防止溶液倒吸 (7). b、c 【解析】 【详解】(1)氯化铁溶于水后,三价铁离子易水解,为抑制氯化铁水解, 需先把氯化铁晶体溶解在盐酸中,再加水稀释; (2)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色; (3)①二氧化硫与氯化铁的氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+; ②二价铁离子具有还原性,可被高锰酸钾氧化,因此检验二价铁离子的方法为:取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有亚铁离子,不褪色说明没有亚铁离子; ③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理, (4)二氧化硫为污染性气体,不能直接排放到空气中,需要进行尾气处理,因二氧化硫易溶于NaOH溶液,所以NaOH溶液吸收尾气,用倒置漏斗的作用为防止NaOH溶液倒吸; (5)验证SO2具有还原性,可用高锰酸钾或碘水发生氧化还原反应,S元素的化合价升高,而SO2不能被浓硫酸、NaCl氧化, 因此,本题应选b、c. 17.活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下: 已知各相关氢氧化物沉淀pH范围如下表所示: Zn(OH)2 Fe(OH)2 Fe(OH)3 Cu(OH)2 开始沉淀pH 5.4 7.0 2.3 4.7 完全沉淀pH 8.0 9.0 4.1 6.7 完成下列填空: (1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要______(选填编号) A.天平 B.滴定管 C.容量瓶 D.胶头滴管 (2)步骤II中加入H2O2溶液的作用是____________(用离子方程式表示); (3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。 (4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。 (5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为____________。 (6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应): ①取1.000g活性氧化锌,用15.00mL 1.000mol·L-1硫酸溶液完全溶解,滴入几滴甲基橙。②用浓度为0.5000mol·L-1的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的依据是_________;所得活性氧化锌的纯度为_________。 【答案】 (1). D (2). H2O2+2Fe2+ +2H+=2Fe3+ +2H2O (3). 4.1~4.7 (4). 除去溶液中的Cu2+ (5). Zn2(OH)2CO32ZnO+ CO2↑+H2O (6). 当滴入最后一滴0.5000 mol·L-1的氢氧化钠溶液时,溶液由橙色变为黄色且半分钟内不变色 (7). 97.2% 【解析】 【分析】 粗氧化锌(含铁、铜的氧化物)加入稀硫酸溶解过滤得到溶液中含有硫酸亚铁、硫酸铜、硫酸锌,加入双氧水氧化亚铁离子为铁离子,加入氧化锌调节溶液pH沉淀铁离子,加入锌还原铜离子为铜单质并调节溶液pH值,过滤得到硫酸锌,碳化是加入碳酸氢铵沉淀锌离子生成碱式碳酸锌,加热分解生成活性氧化锌。 【详解】(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,是粗略配制在烧杯内稀释配制,所需的仪器除玻璃棒、烧杯外、量筒,还需要仪器有胶头滴管等,故答案为D; (2) 加入双氧水氧化亚铁离子为铁离子,离子反应方程式为:H2O2+2Fe2+ +2H+=2Fe3+ +2H2O; (3)依据沉淀pH范围表格可知,调节溶液pH使铁离子沉淀,调节溶液pH为4.1~4.7; (4)步骤III中加入Zn粉与铜离子发生置换反应,除去铜离子,进一步调节溶液pH除净铜离子; (5) 碱式碳酸锌[Zn2(OH)2 CO3]受热分解为氧化锌、二氧化碳和水,反应方程式为:Zn2(OH)2CO32ZnO+ CO2↑+H2O; (6) 甲基橙的变色范围是pH<3.1的变红,3.1~4.4的呈橙色,pH>4.4的变黄,所以滴定终点的依据为:当滴入最后一滴0.5000 mol·L-1的氢氧化钠溶液时,溶液由橙色变为黄色且半分钟内不变色;滴定所需氢氧化钠溶液物质的量为0.5000mol·L-1×0.012 L,根据方程式2NaOH+ H2SO4= Na2SO4+2H2O可知,则剩余硫酸物质的量为0.5000mol·L-1×0.012L/2=0.003mol,因此与氧化锌反应为硫酸的物质的量为0.015L× 1.000mol·L-1-0.003mol=0.012mol,根据方程式ZnO+H2SO4=ZnSO4+H2O可知氧化锌物质的量0.012mol,所以氧化锌的质量为0.012mol×81g/mol=0.972g,因此活性氧化锌的纯度为0.972g÷1g×100%=97.2%。 18.除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。 (1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。 ① 此反应的化学平衡常数表达式为________; ② 下列能增大碳的转化率的措施是________ 。 A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强 (2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g) CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同) ①X在750℃时催化效率最高,能使正反应速率加快约3×105倍; ②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍; ③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍; 根据上述信息,你认为在生产中应该选择的适宜催化剂是_______(填“X”或“Y”或“Z”),选择的理由是_______。 (3)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下: 物质 H2 CO CH3OH 浓度/(mol·L-1) 0.2 0.1 0.4 ① 该时间段内反应速率v(H2)=______ mol·L-1·min-1。 ② 此时,正、逆反应速率的大小:v正______v逆(填“>”、“<”或“=”) (4)生产过程中,合成气要进行循环,其目的是____________。 (5)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2 + 4KOH=2K2CO3+6H2O该电池负极的电极反应式为______。 【答案】 (1). K=c(CO)×c(H2)/c(H2O) (2). BC (3). Z (4). 催化效率高且活性温度低(或催化活性高、速度快,反应温度低) (5). 0.08 (6). > (7). 提高原料利用率(或提高产量、产率也可) (8). CH3OH﹣6e- +8OH﹣=CO32- +6H2O 【解析】 【详解】(1)C(s)+H2O(g)CO(g)+H2(g)的平衡常数表达式为K=c(CO)c(H2)/c(H2O)。增大C的转化率,需要使平衡向正反应方向移动。 A、C为固体,增加C的量对平衡移动无影响,故A不选; B、加入H2O(g)平衡向正反应方向移动,C的转化率增大,故B选; C、正反应为吸热反应,升高温度,平衡向正反应方向移动,故C选; D、增大压强,平衡向逆反应方向移动,故D不选。 综上所述,本题应选BC; (2)催化剂对正逆反应速率的改变程度是相同的,Z对反应速率的影响最大,催化效率高,且活性温度最低,有利于提高经济效益。 (3) ①由表中数据可以知道, 10min内甲醇的浓度变化量为0.4mol·L-1 ,根据方程式2H2(g)+CO(g) CH3OH(g)可知氢气的浓度变化量为0.4mol·L-1×2=0.8mol·L-1,所以v(H2)= 0.8mol·L-1÷10min=0.08 mol·L-1·min-1; ②由表中数据可以知道,此时的浓度商Qc=0.4/(0.22×0.1)=100,小于平衡常数160,故反应向正反应方向进行,所以v正>v逆; (4)该反应为可逆反应,氢气和一氧化碳都不能完全反应,为提高原料利用率,把甲醇分离出后,把原料气再循环利用; (5)在甲醇燃料电池中,电池正极通入氧气,氧元素化合价降低,得到电子,电极反应为:2H2O+O2+4e-=4OH-;电池负极通入甲醇,失去电子,电极反应可根据总反应2CH3OH+3O2 + 4KOH=2K2CO3+6H2O与正极反应相减得负极反应为CH3OH﹣6e- +8OH﹣=CO32- +6H2O。 【点睛】本题为化学反应原理的综合考查。 (1)化学平衡移动原理:如果改变影响平衡的一个条件,平衡就会向着减弱这种改变的方向移动。具体地说就是:增大浓度(固体、纯液体除外),平衡就会向着浓度减小的方向移动;减小浓度,平衡就会向着浓度增大的方向移动。增大压强,平衡就会向着压强减小的方向移动;减小压强,平衡就会向着压强增大的方向移动。升高温度,平衡就会向着吸热反应的方向移动;降低温度,平衡就会向着放热反应的方向移动。平衡移动原理对所有的动态平衡都适用,如电离平衡,水解平衡也适用。 (2)燃料电池的电极反应书写方法:先根据燃料种类写出总反应。再写正极反应:正极发生还原反应,通入的气体一般是氧气,氧气得到电子首先变为氧离子,根据电解质的不同,其负极电极反应式书写分以下几种情况:①在酸性溶液中生成的氧离子与氢离子结合生成水,其电极反应式为: O2 + 4e- + H+= 4H2O②在碱性溶液中,氧离子与氢氧根离子不能结合,只能与水结合生成氢氧根离子,其电极反应式为: O2+ 4e- + 2H2O= 4OH-③在熔融碳酸盐中,氧离子与碳酸根离子不能结合,只能与二氧化碳结合生成碳酸根离子,其电极反应式为:O2+2CO2+4e-=2CO32-④在熔融氧化物介质中,氧气得到电子转化为氧离子,其电极反应式为:O2+ 4e-= 2O2- ;最后用总反应与正极反应相减得到负极反应。 查看更多