- 2021-07-03 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届江苏省仪征中学高二4月月考(2017
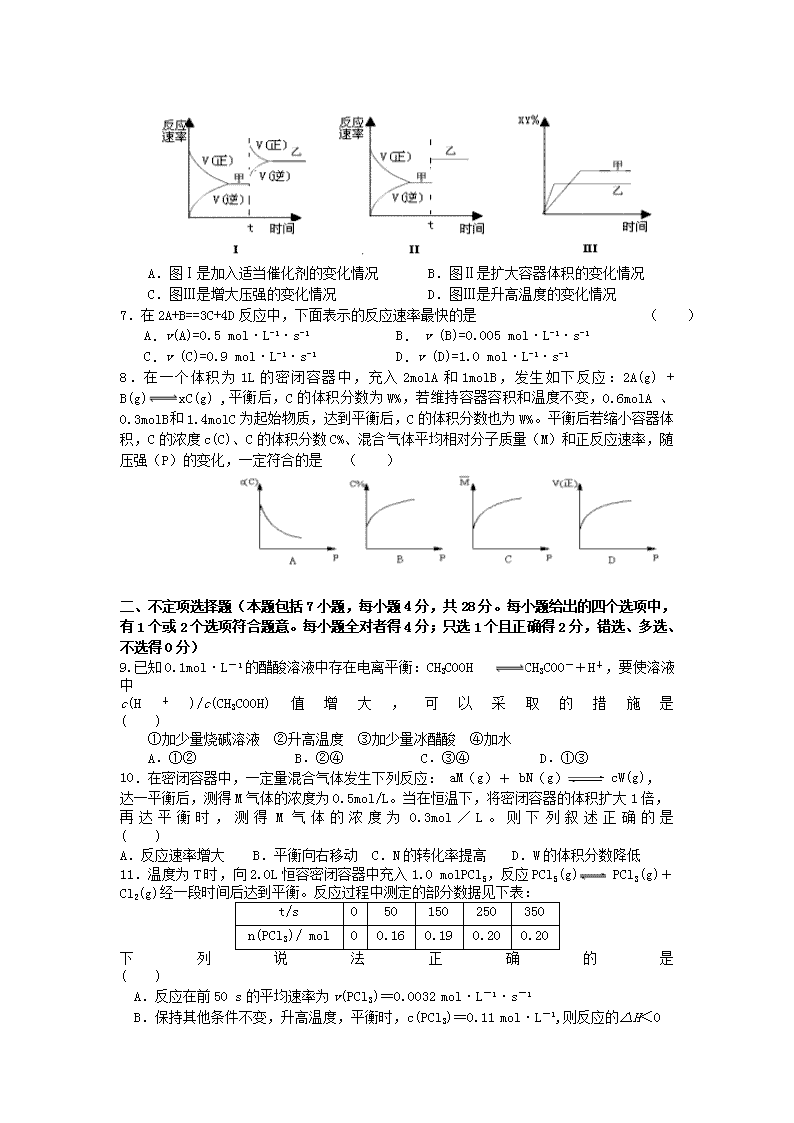
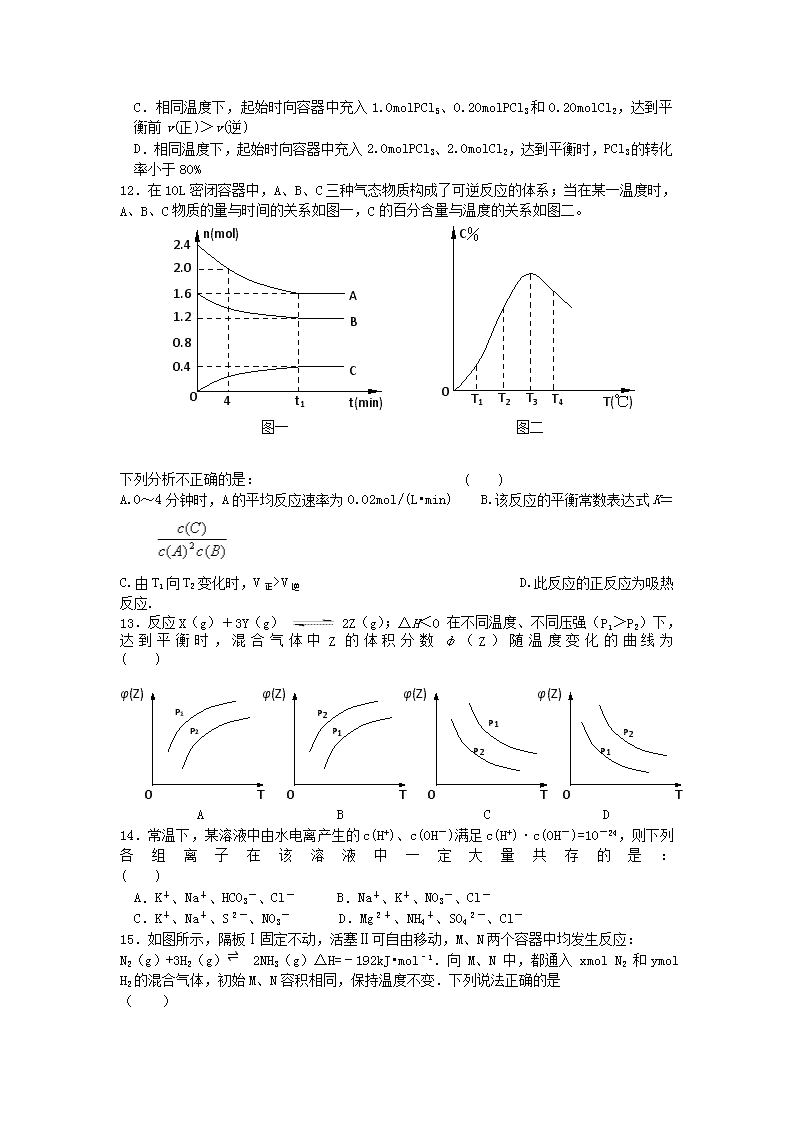
江苏省仪征中学2016—2017学年度第二学期月考 高二化学试卷 本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共120分,考试时间100分钟。 可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cu:64 Zn:65 第Ⅰ卷(共44分) 一、单项选择题(本题包括8小题,每小题2分,共16分。每小题给出的四个选项中只有1个选项最符合题目要求。多选、错选均不得分) 1.下列说法正确的是 ( ) A、活化分子之间的碰撞一定是有效碰撞 B、能够发生化学反应的碰撞是有效碰撞 C、反应物分子的每次碰撞都能发生化学反应 D、增大反应物浓度时,单位体积内活化分子百分数增大 2.下列事实,不能用勒夏特列原理解释的是 ( ) A.溴水中有平衡:Br2+ H2O HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅 B.对CO(g) + NO2 (g) CO2 (g)+ NO(g),平衡体系增大压强可使颜色变深 C.新制的氯水在光照下颜色变浅 D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 3.当化学反应的△H<0,△S>0时,反应一定能自发进行。下列反应属于该情况的是( ) A. Zn(s)+2HCl(aq) = ZnCl2(aq)+H2(g) B.2H2(g)+O2(g) = 2H2O(l) C. CaCO3(s)=CaO(s)+CO2 (g) D. 2NH4Cl(s) + Ca(OH)2(s) = 2NH3(g) + CaCl2 (s) + 2H2O(l) 4.下列有关说法正确的是 ( ) A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 B.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 C.N2(g)+3H2(g)2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 D.升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数 5.下列事实能说明醋酸属于弱电解质的是 ( ) ①中和10mL1mol/LCH3COOH溶液需要10mL 1mol/LNaOH溶液 ②物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快 ③醋酸溶液的c(H+)小于1×10-2mol/L A.①②③ B.②③ C.①③ D.① 6.在密闭容器中,反应X2(g)+Y2(g) 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( ) A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况 C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况 7.在2A+B==3C+4D反应中,下面表示的反应速率最快的是 ( ) A.v(A)=0.5 mol·L-1·s-1 B. v (B)=0.005 mol·L-1·s-1 C.v (C)=0.9 mol·L-1·s-1 D.v (D)=1.0 mol·L-1·s-1 8.在一个体积为1L的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g)xC(g) ,平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率,随压强(P)的变化,一定符合的是 ( ) 二、不定项选择题(本题包括7小题,每小题4分,共28分。每小题给出的四个选项中,有1个或2个选项符合题意。每小题全对者得4分;只选1个且正确得2分,错选、多选、不选得0分) 9.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中 c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( ) ①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水 A.①② B.②④ C.③④ D.①③ 10.在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g) cW(g), 达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍, 再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是 ( ) A.反应速率增大 B.平衡向右移动 C.N的转化率提高 D.W的体积分数降低 11.温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表: t/s 0 50 150 250 350 n(PCl3)/ mol 0 0.16 0.19 0.20 0.20 下列说法正确的是 ( ) A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1 B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0 C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80% T4 T3 T2 T1 T(℃) C% 0 图二 t1 4 2.4 2.0 1.6 1.2 0.8 0.4 t(min) n(mol) C B A 0 图一 12.在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。 下列分析不正确的是: ( ) A.0~4分钟时,A的平均反应速率为0.02mol/(L•min) B.该反应的平衡常数表达式K= C. 由T1向T2变化时,V正> V逆 D.此反应的正反应为吸热反应. φ(Z) 0 T P11 P2 φ(Z) 0 T P1 P2 φ(Z) 0 T P1 P2 φ(Z) 0 T P1 P2 13.反应X(g)+3Y(g)2Z(g);ΔH<0 在不同温度、不同压强(P1>P2)下,达到平衡时,混合气体中Z的体积分数φ(Z)随温度变化的曲线为 ( ) A B C D 14.常温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中一定大量共存的是: ( ) A.K+、Na+、HCO3-、Cl- B.Na+、K+、NO3-、Cl- C.K+、Na+、S2-、NO3- D.Mg2+、NH4+、SO42-、Cl- 15.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应: N2(g)+3H2(g)⇌ 2NH3(g)△H=﹣192kJ•mol﹣1.向 M、N 中,都通入 xmol N2 和ymol H2的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是 ( ) A.若x:y=1;2,则平衡时,M中的转化率:N2>H2 B.若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90% C.若x=1,y=3,则达到平衡时反应物的转化率N>M D.平衡时N2气体在两容器中体积分数可能相等 第Ⅱ卷(共76分) 16.(12分)某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: 根据上述数据,完成下列填空: (1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。 (2)在实验2,A的初始浓度C2= mol/L。 (3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且 C3 1.0mol/L(填>、=、<) (4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 . 17.(10分)向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。 (1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率v(C)为= 。 (2)若t2—t3阶段,C的体积分数变小,此阶段v(正) v(逆)(填“>”“<”“=”) (3)t4—t5阶段改变的条件为 ,B的起始物质量为 。 (4)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。 18.(8分)工业上有一种方法是用CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。 测得CO2和CH3OH(g)的浓度随时间变化如图所示。 (1)从反应开始到平衡,氢气的平均反应速率v( H2 )= ,CO2的转化率= 。 (2)该反应的平衡常数表达式k= 。 (3)下列措施中能使n(CH3OH)/n(CO2)增大的是 (填编号)。 A.将H2O(g)从体系中分离 B.充入He(g),使体系压强增大 C.升高温度 D.再充入lmolCO2和3molH2 19.(10分)文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图. 请回答下列问题: (1)可以判断该反应已经达到化学平衡的是 . (填字母). A.密闭容器中总压强不变 B.密闭容器中混合气体的密度不变 C.v(HCl)=2v(Cl2) D.密闭容器中氯气的体积分数不变 (2)d曲线对应的投料比是 (填比值,从题干中选择,下同).有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl):n(O2)= 制备. (3)该反应的平衡常数表达式为 . (4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为 . 20.(8分)(1)SO2的催化氧化是硫酸工业的主要反应之一。现有标准状态下22.4LSO2气体,在500℃、V2O5催化下转化为SO3,若SO2的转化率为50%,放出热量为QKJ,则该反应的热化学方程式为____________. (2)已知在SO2催化氧化前后混合气体中各成分的体积分数如图,则SO2的转化率为_______________。 (3)恒温、恒压下,在一个容积可变的密闭容器中发生:A(g)+ 2B(g)C(g);开始加入3molA和5molB,体系体积为V升,平衡时可生成amolC,同样条件下,要使平衡时生成C为3.5amol,则开始时除加入5.5molB还需加入 molA和 molC。 21.(14分)(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题: (1)可根据 现象来判断甲、乙都已达到平衡。 (2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。 (3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为 mol, 乙中C的转化率 50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧 刻度 处(填下列序号:① <6 ② >6 ③ =6) (Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时: (1)测得甲中A的转化率为b,则乙中C的转化率为 ; (2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。 22.(14分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。 ① CH4(g)+H2O(g) CO(g)+3H2(g) △H1 ② CO(g)+2H2(g) CH3OH(g) △H2 将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。 (1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。 (2)反应①的△H1 0,图中的P1______P2(填“<”、“=”或“>”)。 (3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2 0,△S 0(填“<”、“=”或“>”)。 (4) 根据题中给出的数据,计算反应①在100℃时的平衡常数值(写出计算过程及结果) 江苏省仪征中学2016—2017学年度第二学期月考 高二化学答案 一、 单项选择题(1~8小题,每小题2分,共16分。每小题给出的四个选项中只有1个选项最符合题目要求。多选、错选均不得分) 二、不定项选择题(本题包括9~15小题,每小题4分,共28分。每小题给出的四个选项中,有1个或2个选项符合题意。每小题全对者得4分;只选1个且正确得2分,错选、多选、不选得0分) 题号 1 2 3 4 5 6 7 8 答案 B B A D B D C D 题号 9 10 11 12 13 14 15 16 答案 B D C AD C B CD 第Ⅱ卷(共76分) 16.(12分)(1)0.013mol/(L·min) (2)1.0mol/L (3)> > (4)吸热 达到平衡时CA<0.5 mol/L 17.(10分) (1)0.004mol/(L·S) (2)< (3)减压 0.04 mol (4)3A(g) 2C(g)+B(g) △H=100a kJ·mol-1 18.(8分)(1) 0.225mol/(L·min) 75% (2) (3)AD。 19.(10分)(1)BD(2)6:1 8:1(3);(4)30.8%; 20.(8分)(1)500 ℃ :2SO2(g)+O2(g)2SO3(g) △H=-4Q kJ·mol-1 (2)95.3% (3)4.5 6 21.(14分)(Ⅰ)(1)K、F不再移动(2)0~2 (3)1 > ② (Ⅱ)(1)1-b (2)4/3~ 3/2 22.(14分)(1)0.002mol/(L·min) (2) > < (3)< < (4)(4分)(过程略) 1.35×10-3(mol/L)2 注:除最后一空外,其余每空2分查看更多