- 2021-07-03 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】北京市延庆区2019-2020学年高一下学期期末考试试题
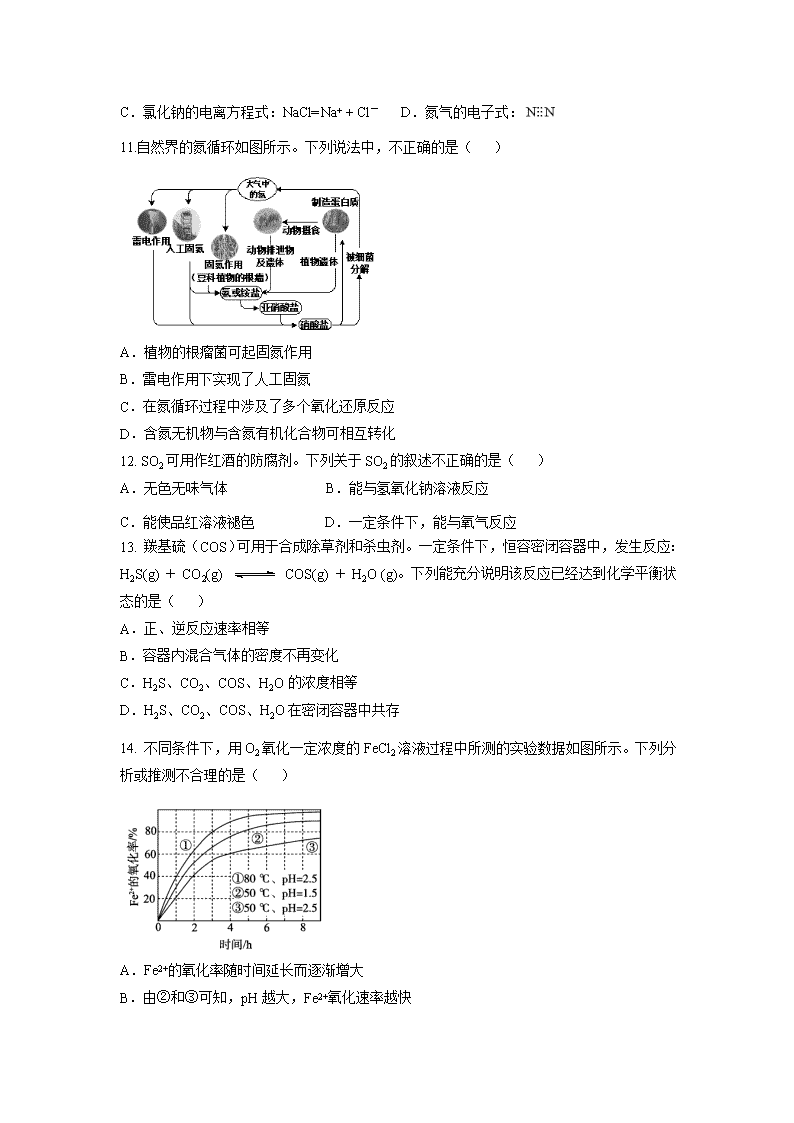
北京市延庆区2019-2020学年高一下学期期末考试试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Cl 35.5 第一部分 选择题(共50分) 在下列各题的4个选项中,只有1个选项符合题意。(每小题2分,共50分) 1.十八大以来,我国科学技术迅猛发展。下列设备工作时,将化学能转化为电能的是( ) A.太阳能集热器 B.风力发电机 C.偏二甲肼燃烧 D.锂离子电池 2.下列物质中,不属于电解质的是( ) A.H2SO4 B.KOH C.Fe D.NaNO3 3.工业上常用电解法冶炼的金属是( ) A.Fe B.Al C.Cu D.Ag 4.当光束通过下列分散系时,能观察到丁达尔效应的是( ) A.NaOH溶液 B.KCl溶液 C.Fe(OH)3胶体 D.K2SO4溶液 5.下列分子中,一定含有羧基的是( ) A. CH3COOH B.C2H5OH C.C2H6 D.C2H4 6.下列元素的原子半径最大的是( ) A. H B.Li C.Na D.K 7. 下列物质属于共价化合物的是 ( ) A.NaCl B.CO2 C.CaCl2 D.NH4C1 8.下列关于物质分类的叙述中,不正确的是( ) A.NO2属于氧化物 B.H2SO4属于酸 C.KOH属于碱 D.氨水属于纯净物 9.下列反应中,属于吸热反应的是( ) A.Zn与硫酸的反应 B.生石灰与水的反应 C.Ba(OH)2·8H2O与NH4Cl的反应 D.NaOH与盐酸的反应 10.下列化学用语的表述不正确的是( ) A.甲烷的球棍模型 B.Mg2+的结构示意图: C.氯化钠的电离方程式:NaCl=Na+ + Cl- D.氮气的电子式: 11.自然界的氮循环如图所示。下列说法中,不正确的是( ) A.植物的根瘤菌可起固氮作用 B.雷电作用下实现了人工固氮 C.在氮循环过程中涉及了多个氧化还原反应 D.含氮无机物与含氮有机化合物可相互转化 12. SO2可用作红酒的防腐剂。下列关于SO2的叙述不正确的是( ) A.无色无味气体 B.能与氢氧化钠溶液反应 C.能使品红溶液褪色 D.一定条件下,能与氧气反应 13. 羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应: H2S(g) + CO2(g) COS(g) + H2O (g)。下列能充分说明该反应已经达到化学平衡状态的是( ) A.正、逆反应速率相等 B.容器内混合气体的密度不再变化 C.H2S、CO2、COS、H2O的浓度相等 D.H2S、CO2、COS、H2O在密闭容器中共存 14. 不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( ) A.Fe2+的氧化率随时间延长而逐渐增大 B.由②和③可知,pH越大,Fe2+氧化速率越快 C.由①和③可知,温度越高,Fe2+氧化速率越快 D.氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 15.考古学上常用来测定文物的历史年代,下列对其描述不正确的是( ) A.质子数是6 B.中子数是8 C.质量数是20 D.核外电子数是6 16.下列方法中,不能用于区分乙酸溶液与乙醇溶液的是( ) A.扇闻气味 B.观察颜色 C.滴加NaHCO3溶液 D.滴加紫色石蕊溶液 17.下列反应属于取代反应的是( ) A.甲烷燃烧生成二氧化碳和水 B.乙醇与氧气反应生成乙醛 C.乙烯与溴反应生成1,2-二溴乙烷 D.甲烷与氯气反应生成一氯甲烷 18.下列物质的电子式书写不正确的是( ) A. B. C. D. 19.某元素原子的结构示意图为,由此得到的结论不正确的是( ) A.该元素属于非金属元素 B.该原子核内有16个质子 C.该原子在化学反应中易失去2个电子 D.该元素在周期表中的位置是第3周期、第ⅥA族 20.实验室中,下列行为不符合安全要求的是( ) A.熄灭酒精灯时,用灯帽盖灭 B.金属钠着火时,立即用沙土覆盖 C.实验结束后将废液倒入指定容器中 D.稀释浓硫酸时,将水注入浓硫酸中并不断搅拌 21.下列传统酿醋工艺的主要步骤中,包含溶解和过滤操作的是( ) A.蒸拌原料 B.淀粉发酵 C.清水浸淋 D.放置陈酿 22.下列说法中,正确的是( ) A.16 g O2物质的量为1 mol B.Mg的摩尔质量是24 g/mol C.常温常压下,1 mol N2的体积是22.4 L D.0.1 mol/L Ba(OH)2溶液中含有0.2 mol OH- 23.下列反应的离子方程式书写不正确的是( ) A.硝酸银溶液与盐酸反应:Ag+ + HCl- ==== AgCl↓+H+ B.钠与水反应:2Na + 2H2O ==== 2Na+ + 2OH- + H2↑ C.氯气与氢氧化钠溶液反应:Cl2 + 2OH- ==== Cl- + ClO- + H2O D.铜与浓硝酸反应:Cu + 4H+ + 2NO3— ==== Cu2+ + 2NO2↑+ 2H2O 24.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,不正确的是( ) A.过程①中,没有化合价的变化 B.过程②中,发生反应为S2- + Fe3+==== S + Fe2+ C.过程③中,Fe2+作还原剂 D.整个转化过程中Fe3+可以循环使用 25.下列“实验结论”与“实验操作及现象”不相符的一组是( ) 选项 试管实验操作及现象 实验结论 A 向KI-淀粉溶液中滴加氯水,溶液变成蓝色 氧化性:I2>Cl2 B 向蔗糖中滴加浓硫酸,蔗糖变黑 浓硫酸有脱水性 C 向某溶液中加入盐酸无现象,再加入BaCl2溶液,有白色沉淀生成 溶液中含有SO42- D 向某盐溶液中加入浓氢氧化钠并加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝。 溶液中含有NH4+ 第二部分 非选择题(共50分) 本部分共8道小题,共50分。 26.(3分)补齐下列物质间的反应与对应反应类型的连线。 A. 乙醇与酸性重铬酸钾溶液反应 a. 取代反应 B. 从乙烯得到聚乙烯的反应 b. 氧化反应 C. 乙烯与溴的四氯化碳溶液反应 D. 乙酸和乙醇在浓硫酸作用下的反应 c. 加聚反应 d. 加成反应 27. (4分)铜与浓硝酸混合发生如下反应。 Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2NO2 ↑+ 2H2O (1)作还原剂的物质是 ,氮元素的化合价 (填“升高”或“降低”)。 (2)若反应中每生成1 mol NO2 ,则消耗HNO3的物质的量至少为 mol,转移电子的物质的量为 mol。 28.(4分)现有下列几组物质: ① ② ③ ④ 12C 14C CH3CH3 CH3CH2CH3 CH3CH2CH3 (1)互为同系物的是________(填序号,下同)。 (2)互为同分异构体的是______。 (3)互为同位素的是_______。 (4)属于同一种物质的是________。 29. (6分)化学电池的发明,是贮能和供能技术的巨大进步。 (1)如图所示装置中,Zn片是 (填“正极”或“负极”),Cu片上发生的电极反应为 。 (2)如图是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是 。 (3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。 下列说法不正确的是 (填序号)。 ① A为电池的正极 ② 该装置实现了电能转化为化学能 ③ 电池工作时,电池内部的锂离子定向移动 30.(6分)海洋是一座巨大的化学资源宝库,从中可以提取多种化学物质。从淡化海水中提取溴是海水综合利用的重要途径,其流程如下: 完成下列填空 (1)写出一种工业上海水淡化的方法_____。 (2)过程II中物质X可以选SO2吸收溴,写出该反应的化学方程式_____。 (3)过程I、II要达到的目的是_____。 (4)写出过程III反应的离子方程式_____。 31.(13分)有A、B、C、D四种有机物,A、B属于烃类物质,C、D都是烃的衍生物。A是含氢质量分数最大的有机物,分子结构为正四面体;B的球棍模型为;C的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应; D的比例模型为,该物质的水溶液中滴加石蕊变红色。 请回答下列问题: (1)A的电子式是 ,C中官能团的名称是 。 (2)B的结构简式是 ,该物质发生加聚反应的化学方程式为 。 (3)已知B可以发生如下转化过程: i.上述转化过程中属于加成反应的是 (填序号)。 ii.完成转化①、②反应的化学方程式: ① ;② 。 iii.下列关于的说法正确的是 (填字母序号)。 a.该物质属于烃类化合物 b.该物质可以发生酯化反应 c.1 mol该物质与足量金属钠反应,可生成1 mol氢气 d.该物质既能使酸性高锰酸钾溶液褪色,也能使紫色石蕊褪色 32.(7分)有四种短周期元素,相关信息如下表。 元素 相关信息 A 气态氢化物极易溶于水,可用作制冷剂 B 单质的焰色反应为黄色 C –2价阴离子的电子层结构与Ar原子相同 D 单质是黄绿色气体,可用于自来水消毒 请根据表中信息回答: (1)A在周期表中位于第 周期 族。 (2)B的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式 为 。 (3)研究物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种的是 (填化学式)。 (4)能说明元素D的非金属性强于元素C的非金属性的实验事实是 (填字母)。 a.常温下,两种单质的熔点不同 b.两种元素的气态氢化物的稳定性不同 c.两种元素的最高价氧化物对应的水化物酸性不同 33.(7分)加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。 (1)上述流程中,为加快化学反应速率而采取的措施是 。 (2)过程Ⅰ中,过氧化氢在酸性条件下将Cu溶解,该反应的离子方程式是 。 (3)过程Ⅱ中加入过量铁粉的目的是 ,该过程中用到的分离操作是 。 (4)过程Ⅲ中,发生反应的离子方程式为 。 【参考答案】 第一部分 选择题(共50分) 每小题只有一个选项符合题意(共25小题,每小题2分) 1- 5: D C B C A 6-10: D B D C D 11-15:B A A B C 16-20:B D C C D 21-25:C B A B A 第二部分 非选择题(共50分) 26.(3分)(每个答案1分) A. 乙醇与酸性重铬酸钾溶液反应 a. 取代反应 B. 从乙烯得到聚乙烯的反应 b. 氧化反应 C. 乙烯与溴的四氯化碳溶液反应 D. 乙酸和乙醇在浓硫酸作用下的反应 c. 加聚反应 d. 加成反应 27.(4分)(每个答案1分) (1) Cu , 降低 。(2) 2 , 1 。 28.(4分)(每个答案1分) (1)__②__ (2)___④__。(3)___①___。(4)___③___。 29.(6分) (1)负极 (1分) 2H+ +2e-=H2↑(2分) (2)电流表指针发生偏转(1分) (3)①② (2分) 30.(6分) (1)蒸馏法、电渗析法、离子交换法(答任意一种即可) (1分) (2)SO2+Br2+2H2O=H2SO4+2HBr (2分) (3)富集溴元素(1分) (4)Cl2+2Br=Br2+2Cl- (2分) 31.(13分) (1)(1分) 羟基(1分) (2)CH2=CH2(1分) (2分) (3)i. ① ③ (2分) ii. ① CH2=CH2+H2O CH3CH2OH;(2分) ② 2CH3CH2OH+O22CH3CHO+2H2O 。(2分) iii. b c (2分) 32.(7分) (1) 2(或二) , VA(各1分) (2)H+ +OH- = H2O(2分) (3)NaOH(1分) (4) b c (2分) 33.(7分) (1) 粉碎(1分) (2)Cu + H2O2 + 2H+ = Cu2+ + 2H2O (2分) (3)将溶液中的Cu2+全部置换出来(1分),过滤 (1分) (4)Fe + 2H+ = Fe2+ + H2↑ (2分) 查看更多