2018届一轮复习人教版巧解化学反应速率和化学平衡的图象题学案
专题讲座(七) 巧解化学反应速率和化学平衡的图象题
化学反应速率和化学平衡的图象类试题是一种特殊题型,其特点是:图象是题目的主要组成部分,把所要考查的化学知识寓于图中曲线上,具有简明、直观、形象的特点。该类试题以选择题为主要题型,偶尔也会在非选择题中出现。因为图象是用二维坐标表示的,所以该类试题包含的信息量比较大,随着高考的不断改革以及对学科能力要求的不断提高,这种数形结合的试题将频频出现。常见的命题角度有:
(1)以反应速率随温度、压强等的变化图象为载体,考查化学平衡移动的规律及化学反应进行的方向的判断;
(2)以物质的含量随时间的变化图象为载体,考查外界条件对化学平衡的影响以及平衡移动过程中相关量的变化分析;
(3)以物质的量(或浓度)随时间的变化图象为载体,考查化学反应速率的表示方法及其相关计算;
(4)以反应过程中的速率随时间的变化图象为载体,考查反应速率的影响因素及相关分析。
一、传统图象的分类突破
[答题必备]
1.化学反应速率
(1)掌握1条规律:对于可逆反应mA(g)+nB(g) pC(g),v(A)∶v(B)∶v(C)=Δn(A)∶Δn(B)∶Δn(C)=Δc(A)∶Δc(B)∶Δc(C)=m∶n∶p。
(2)理解5个因素:增大反应物浓度、增大气体反应物压强、升高温度、使用催化剂、增大反应物表面积,化学反应速率均增大,反应时间将缩短,达到平衡的时间也缩短。反之,反应速率将减小,反应时间将变长,达到平衡的时间将延长。
(3)了解1个图象。
其中:
E1——正反应活化能 E2——逆反应活化能ΔH=E1-E2=E3-E4。
2.化学平衡的移动
(1)掌握平衡特征
①v(正)=v(逆)>0。
例如
只有在t2时刻反应才达到平衡。
②反应体系中各物质的质量或浓度保持不变。
例如
只有在t3时刻反应才达到平衡状态。
③反应物的转化率不变。
(2)理解1个原理
勒夏特列原理(化学平衡移动原理):如果改变影响化学平衡的条件(浓度、压强、温度等)之一,平衡将向着能够减弱这种改变的方向移动。
[典题示例]
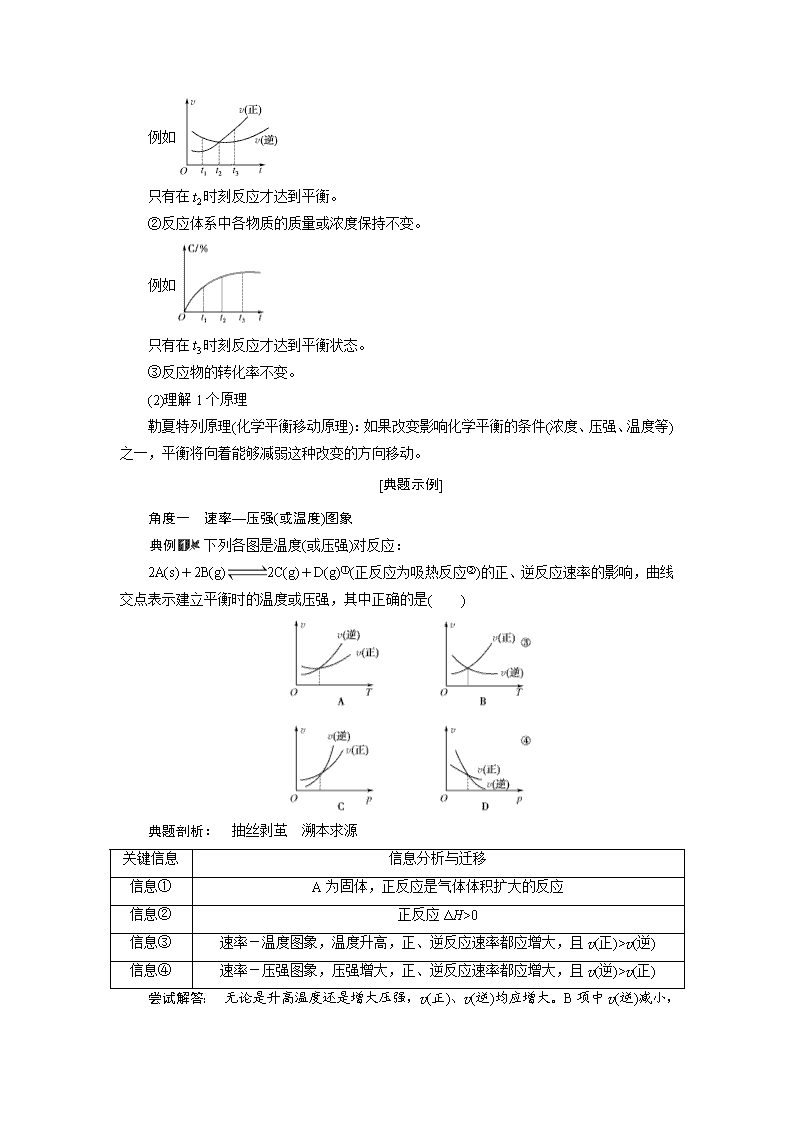
角度一 速率—压强(或温度)图象
下列各图是温度(或压强)对反应:
2A(s)+2B(g) 2C(g)+D(g)①(正反应为吸热反应②)的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是( )
典题剖析: 抽丝剥茧 溯本求源
关键信息
信息分析与迁移
信息①
A为固体,正反应是气体体积扩大的反应
信息②
正反应ΔH>0
信息③
速率-温度图象,温度升高,正、逆反应速率都应增大,且v(正)>v(逆)
信息④
速率-压强图象,压强增大,正、逆反应速率都应增大,且v(逆)>v(正)
尝试解答: 无论是升高温度还是增大压强,v(正)、v(逆)均应增大。B项中v(逆)减小,D项中v(正)和v(逆)
均减小,故B、D项均错误;该反应的正反应是一个气体分子数增大的吸热反应,升高温度,平衡向正反应方向移动,则v(正)>v(逆),A项错误;增大压强,平衡向逆反应方向移动,则v(逆)>v(正),C项正确。
答案: C
角度二 含量(或转化率)-时间图象
T0 ℃时,在2 L的密闭容器中发生反应:X(g)+Y(g) Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1 ℃、T2 ℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
A.该反应的正反应是吸热反应
B.T0 ℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
C.图a中反应达到平衡时,Y的转化率③为37.5%
D.T1 ℃时,若该反应的平衡常数K=50,则T1
T2,温度越高,X的物质的量越大,则平衡向左移动,正反应放热,A不正确;v(X)=(0.3 mol-0.05 mol)/(2 L×3 min)=0.041 7 mol·L-1·min-1,B不正确;Y的转化率为(0.4-0.15)÷0.4×100%=62.5%,C不正确;由图a可知X、Y、Z物质的量变化之比为1∶1∶2,则K0为33.3<50,平衡常数越小,温度越高,D正确。
答案: D
角度三 恒温线(或恒压线)图象
在恒容密闭①容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)②,测得CH4的平衡转化率与温度及压强的关系如图所示。下列有关说法一定正确的是( )
A.上述反应的ΔH③>0
B.压强p1>p2>p3>p
C.1 100 ℃该反应的平衡常数为64
D.压强为p4时,在Y点⑤:v(正)v(逆),D错误。
答案: D
[类题通法]
1.思维建模
2.解题技巧
(1)先拐先平
在含量(转化率)—时间曲线中,先出现拐点的先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。
(2)定一议二
当图象中有三个量时,先确定一个量不变,再讨论另外两个量的关系,
有时还需要作辅助线。
二、新型图象题的探究与应用
新型图象往往根据实际工业生产,结合图象,分析投料比、转化率、产率的变化。此类题目信息量较大,能充分考查学生读图、提取信息、解决问题的能力,在新课标高考中受到命题者的青睐。
角度一 转化率—投料比—温度图象
将燃煤废气中的CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图:
此反应为________(填“放热”或“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”“减小”或“不变”)。
答案: 放热 不变
角度二 根据图象判断投料比
采用一种新型的催化剂(主要成分是Cu—Mn合金),利用CO和H2制备二甲醚(DME)。
主反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
副反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO(g)+2H2(g) CH3OH(g)
测得反应体系中各物质的产率或转化率与催化剂的关系如图所示。
则催化剂中n(Mn)/n(Cu)约为________时最有利于二甲醚的合成。
解析: 由图可知当催化剂中n(Mn)/n(Cu)约2.0时,CO的转化率最大,生成的二甲醚最多。
答案: 2.0
[即时巩固]
(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g)2CO2(g)+S(l)
ΔH=-270 kJ·mol-1
①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②某科研小组用Fe2O3作催化剂。在380 ℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为 ________。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
①写出该脱硝原理总反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
②为达到最佳脱硝效果,应采取的条件是
________________________________________________________________________。
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。
若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因是
________________________________________________________________________
________________________________________________________________________;
在n(NO)/n(CO)=1的条件下,应控制的最佳温度在________左右。
答案: (1)①Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源 ②a
(2)①6NO+3O2+2C2H43N2+4CO2+4H2O
②350 ℃、负载率3%
(3)NO分解反应是放热反应,升高温度不利于反应进行 870 K