- 2021-07-03 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山东省济南市历城区第二中学高二上学期10月月考化学试题
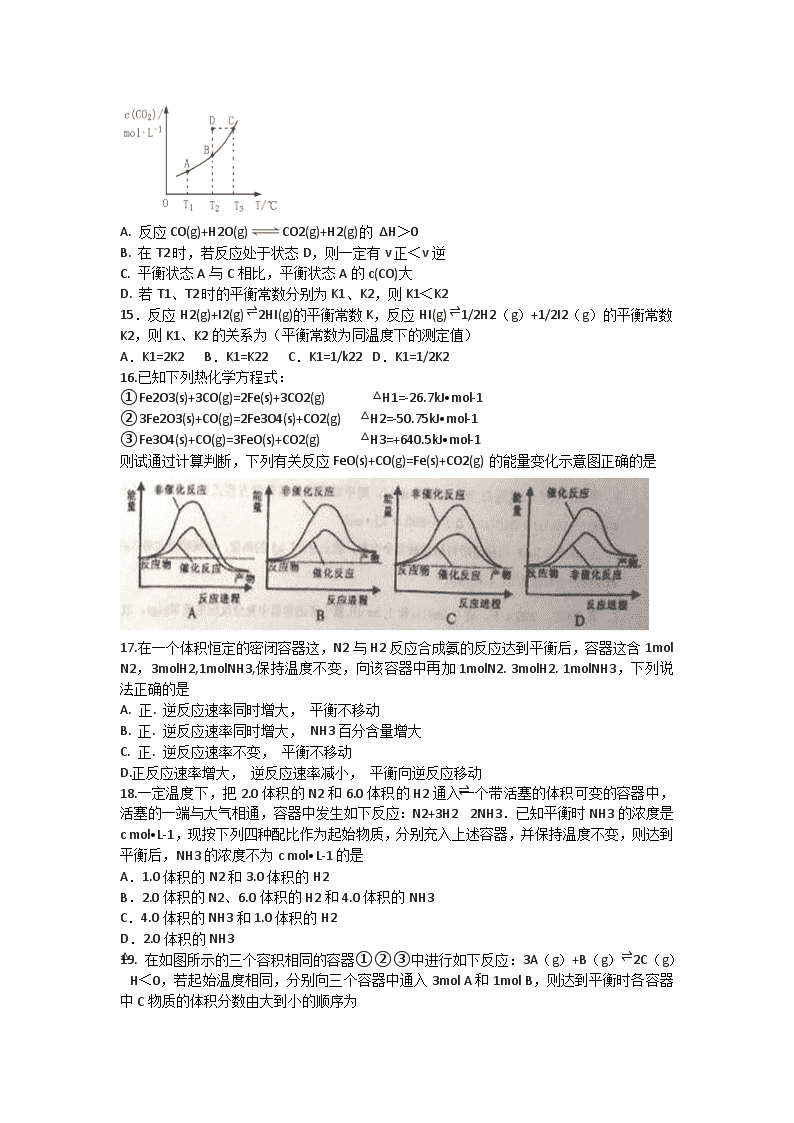
2017-2018学年山东省济南市历城区第二中学高二上学期10月月考化学试题 一、选择题(苯题包括26小题,每小题只有1个选项符合题意,每题2分,共52分) 1.未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生下列属最有希望的新能源的是 ①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外 2.下列说法正确的是 A.增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 B.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0 D.在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 3.下列说法正确的是 A.甲烷燃烧的数值为890.3KJ/mol,则甲烷燃烧的化学方程式可表示为: CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 B.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的中和热为57.4kJ/mol C.在500℃、20MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+2H2(g) 2NH3(g) △H=-38.6kJ·mol-1 D.已知:2CO(g)+O2(g) =2CO2(g) ΔH1,2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1<ΔH2 4.下表中是各组反应的反应物和反应温度,反应刚开始时放出H2速率最快的是 编号 金属(粉末状) 酸的浓度及体积 反应温度 A Mg,0.1mol 6 mol·L-1 硝酸10mL 60℃ B Mg,0.1 mol 3 mol·L-1 盐酸10mL 60℃ C Fe,0.1 mol 3 mol·L-1 盐酸10mL 60℃ D Mg,0.1 mol 3 mol·L-1 硫酸10mL 60℃ 5.将4molA气体和2molB气体在2L 的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法: ①用物质A表示的反应的平均速率为0.3 mol/L·s ②用物质B表示的反应的平均速率为0.6 mol/L·s ③2s时物质A的转化率为30% ④2s时B物质的浓度为1.4mol/L 其中正确的是 A. ①③ B. ①④ C. ②③ D. ③④ 6.一定温度下,浓度均为1mol/L的A2和B2两种气体,在密闭容器内反应生成气体C,达平衡后,测得:c(A2)=0.58mol/L,c(B2)=0.16mol/L,c(C)=0.84mol/L,则该反应的正确表达式为 A.2A2+B22A2B B.A2+B22AB C.A2+B2A2B2 D.A2+2B22AB2 7.对已知化学平衡的反应3H2(g)+N2(g) 2NH3(g) △H<0。降低温度对化学平衡的影响是 A.正、逆反应速率都减小,平衡向正反应方向移动 B.正、逆反应速率都增啊,平衡向正反应方向移动 C.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 D.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 8.下列事实不能用勒夏特列原理来解释的是 A.用排饱和食盐水的方法收集氯气 B.合成氨工业选择高温(合成氨反应为放热反应) C.增大压强,有利于SO2和O2反应生成SO3 D.在Fe3++3SCNFe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 9.一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g) H2(g)+I(g),则下列有关说法正确的是 A.如改变体系温度,体系颜色一定发生变化 B.如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移 C.继续充入HI气体,则HI的转化率将减小 D.温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小 10.在温度和容积不变的条件下,发生反应:3Fe(s)+4H2OFe3O4(s)+4H2(g) , 能表明反应达到平衡状态的叙述是 A.容器内压强不再改变 B. Fe3O4的物质的量不变 C.v(H2O)=v(H2) D.断裂4molH-O键的同时,断裂4molH-H键 11.在一定条件下,反应2HI(g) H2(g)+I2(g) △H>0,达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强. A.①③⑥ B.③⑤⑥ C.①③⑤ D.②④⑤ 12.由反应物X转化为Y或Z的能量变化如图所示。下列说法正确的是 A.由X→Y反应的ΔH=E5-E2 B.由X→Z反应的ΔH >0 C.降低压强有利于提高Y的产率 D.升高温度有利于提高Z的产率 13.在3个体积相同的密闭容器中均发生下列反应:CO2(g)+H2(g) H2O(g)+CO(g),反应所处的温度相同,但起始浓度不同,其中甲:n(CO2)=amol,n(H2)=2amol;乙:n(CO2)=n(H2)=amol;丙:n(CO2)=n(H2)=n(CO) =amol.达到平衡时H2O(g)的物质的量由大到小的顺序是 A. 甲>乙>丙 B.甲>丙>乙 C. 乙>甲>丙 D. 乙>丙>甲 14.在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) ⇌CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。下列说法错误的是 A. 反应CO(g)+H2O(g)CO2(g)+H2(g)的 ΔH>0 B. 在T2时,若反应处于状态D,则一定有ν正<ν逆 C. 平衡状态A与C相比,平衡状态A的c(CO)大 D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 15.反应H2(g)+I2(g) ⇌2HI(g)的平衡常数K,反应HI(g) ⇌1/2H2(g)+1/2I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值) A.K1=2K2 B.K1=K22 C.K1=1/k22 D.K1=1/2K2 16.已知下列热化学方程式: ①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-26.7kJ•mol-1 ②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-50.75kJ•mol-1 ③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640.5kJ•mol-1 则试通过计算判断,下列有关反应FeO(s)+CO(g)=Fe(s)+CO2(g)的能量变化示意图正确的是 17.在一个体积恒定的密闭容器这,N2与H2反应合成氨的反应达到平衡后,容器这含1mol N2,3molH2,1molNH3,保持温度不变,向该容器中再加1molN2. 3molH2. 1molNH3,下列说法正确的是 A. 正. 逆反应速率同时增大, 平衡不移动 B. 正. 逆反应速率同时增大, NH3百分含量增大 C. 正. 逆反应速率不变, 平衡不移动 D.正反应速率增大, 逆反应速率减小, 平衡向逆反应移动 18.一定温度下,把2.0体积的N2和6.0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2⇌2NH3.已知平衡时NH3的浓度是c mol•L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol•L-1的是 A.1.0体积的N2和3.0体积的H2 B.2.0体积的N2、6.0体积的H2和4.0体积的NH3 C.4.0体积的NH3和1.0体积的H2 D.2.0体积的NH3 19. 在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)⇌2C(g)△H<0,若起始温度相同,分别向三个容器中通入3mol A和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 A.③②① B.③①② C.①②③ D.②①③ 20.对与可逆反应2AB3(g) ⇌A2(g)+3B2(g) △H>0,下列图像正确的是 21.将3molO2加入到VL的反应器中,在高温下放电,经t1s建立了平衡体系:3O22O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是 22.在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g) ⇌2Z(g),并达到平衡,已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是 A.若X的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1 B.若向容器中充入氦气,压强增大,Y的转化率提高 C.升高温度,正反应速率减小,平衡向逆反应方向移动 D.开始充入容器中的X、Y物质的量之比为2∶1 23.反应:L(s)+aG(g) ⇌bB(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,X轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断 A.升高温度,平衡常数减小 B.a>b C.上述反应是吸热反应 D.无法确定a、b的大小 24.在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g) 2c(g) △H1<0; x(g)+3y(g) 2z (g) △H2>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是 A.等压时,通入z气体,反应器中温度升高 B.等容时,通入z气体,y的物质的量浓度增大 C.等容时,通入惰性气体,各反应速率不变 D.等压时,通入惰性气体,c的物质的量不变 25.a1和a2,c1和c2分别为两个恒容容器这平衡体系N2O4(g)2NO2(g) 和3O2(g)2O3(g)的反应物的转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是 A.a1、a2均减小,c1、c2均增大 B.a1、a2均增大,c1、c2均减小 C.a1减小,a2增大,c1、c2均增大 D.a1减小,a2增大,c1增大c2减小 26.一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),部分数据见下表(表中t2>t1) 反应时间/min n(CO)/mol n(H2O)/mol n(CO2)/mol n(H2)/mol 0 1.20 0.60 0 0 t1 0.80 t2 0.20 下列说法正确的是 A.反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1 B.平衡时CO的转化率为66.67% C.该温度下反应的平衡常数为1 D.其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol 二、非选择题(本题包括4小题,共48分) 27.(12分)氨在工农业生产中应用广泛。 (1)根据下图写出合成氨的热化学方程式是 。 (2)将1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 (填“大于”、“等于”或“小于”)92.9KJ,原因是 ;若加入催化剂,△H (填“变大”、“不变”或“变小”)。 (3)已知分别破坏1molN≡N键、1molH-H键时需要吸收的能量为946KJ、436KJ。则破坏1molN-H键需要吸收的能量为 KJ。 (4)发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g). 已知N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ/mol; N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol; 写出1mol N2H4与 NO2反应的热化学方程式为 . 28.(12分)工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。 (1)在一定温度下,CO(g)+2H2(g) CH3OH(g) △H=-128.8kJ/mol.若将10amolCO和20amolH2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为不 (用含a的代数式表示)。若此时在向该容器中投入10amolCO、20amolH2和10amolCH3OH(g),判断平衡移动的方向是 (填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量的浓度 (填“增大”、“不变”或“减小”)。 (2)判断该反应达到平衡状态的依据是 (填字母序号)。 A.混合气体的密度不变 B.混合气体的平均相对分子质量不变 C.2V逆(H2)=V正(CO) D.容器内CO、H2、CH3OH的浓度之比为1:2:1 E.CH3OH、CO、H2的浓度都不再发生变化 (3)一定条件下,在容积相同的三个密闭容器中,按不同的方式投入反应物,保持恒温、恒容。测得反应达到平衡时的有关数据如下: 容器 甲 乙 丙 反应物投入量 1molCO、2molH2 1molCH3OH 2molCH3OH 平衡时数据 反应能量变化的绝对值(KJ) a b c 反应物转化率 a1 a2 a3 则a+b= ;a1+a2 1(填“>”、“<”或“=”)。 29.(12分)某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJ·mol-1.在T1℃时,反应进行到不同时间测得各物质的物质的量如下表: 时间(min) 物质的量(mol) 0 10 20 30 40 50 B 2.00 1.36 1.00 1.00 1.20 1.20 D 0 0.32 0.50 0.50 0.60 0.60 E 0 0.32 0.50 0.50 0.60 0.60 (1)T1℃时,该反应的平衡常数K= ; (2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是 (填字母编号). a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE (3)维持容器的体积和温度T1不变,当向该容器中加入1.60molB、0.20molD、0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围 . (4)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= . (5)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q 0(填“大于”或“小于”),c点v正 v逆(填“大于”、“小于”或“等于”.) 30.(12分)已知2A2(g)+B2(g) 2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ (1)达到平衡时,A2的转化率为 。 (2)达到平衡后,若向容器中通入少量的氯气,A2的转化率将 (填增大、减小或不变)) (3)若在原来的容器中只加入2mol C3,500℃时充分反应达平衡后,吸收热量QkJ,C3浓度 (填>、=、<)wmol/L。 (4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ; a.反应速率c>b>a b.达到平衡时A2的转化率大小为b>a>c c.T2>T1 d.b点A2和B2的物质的量之比为2:1 (5)若将上述容器改为恒压容器,起始时加入2mol A2和1mol B2,500℃时充分反应达平衡后,放出热量Q1kJ,则Q2 Q1(填>、=、<)。 (6)下列措施可以同时提高反应速率和B2的转化率是 (填选项序号)。 a.选择适当的催化剂 b.增大压强 c.及时分离生成的C2 d.升高温度 2017-2018学年山东省济南市历城区第二中学高二上学期10月月考化学试题 1-5BCDDA 6-10DABAB 11-15DCABC 16-20BBCAB 21-25CDCDC 26C 27.(1)N2(g)+3H2(g) 2NH3(g) ΔH=-92.9KJ/mol (2)小于;该反应是可逆反应,反应物无法全部转化为生成物;不变 (3)391 (4)N3H4(g)+NO2(g)=3/2N2(g)+2H2O(g) ΔH=-567.85KJ/mol 28.(1)3/32a2 正向移动 增大 (2)BE (3)128.8 < 29. (1)0.25;(2)ae;(3)大于0.3;(4)1.5;(5)小于;等于 30.(1)Q2/Q1 (2)不变 (3)= (4)ad (5)< (6)b 查看更多