- 2021-07-03 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省宜宾市第四中学校2019-2020学年高二下学期第四学月考试化学试题
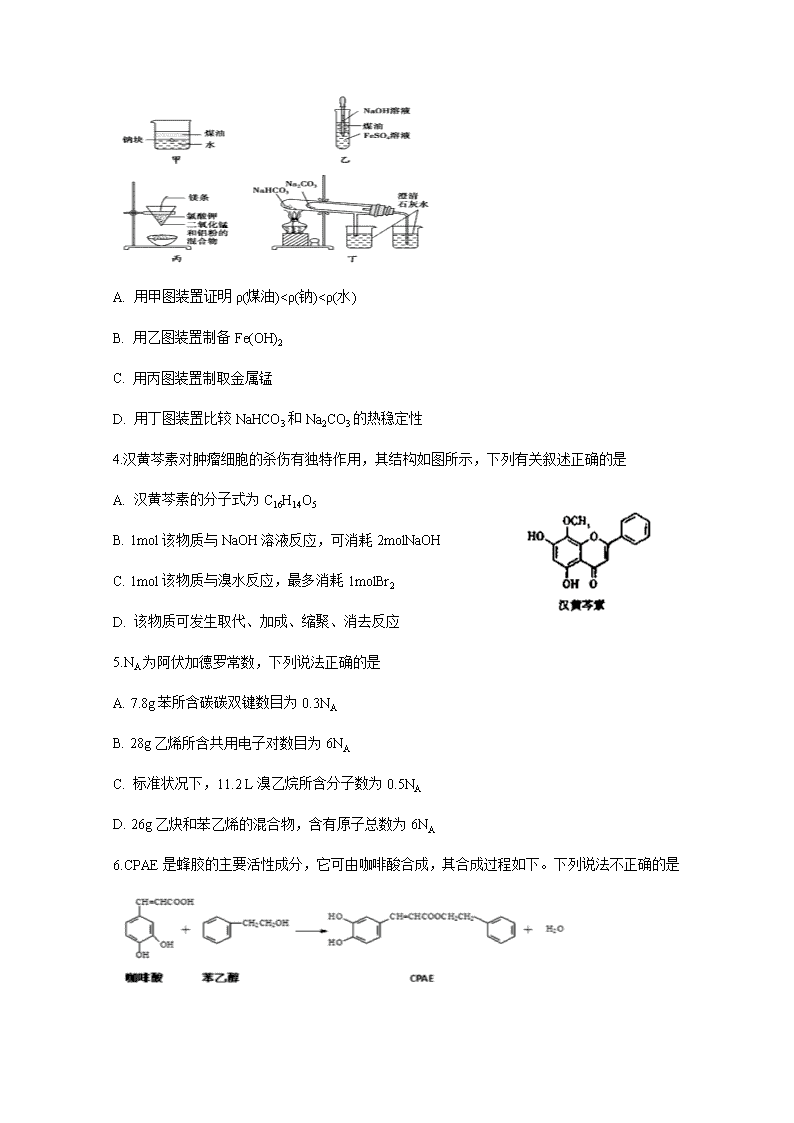
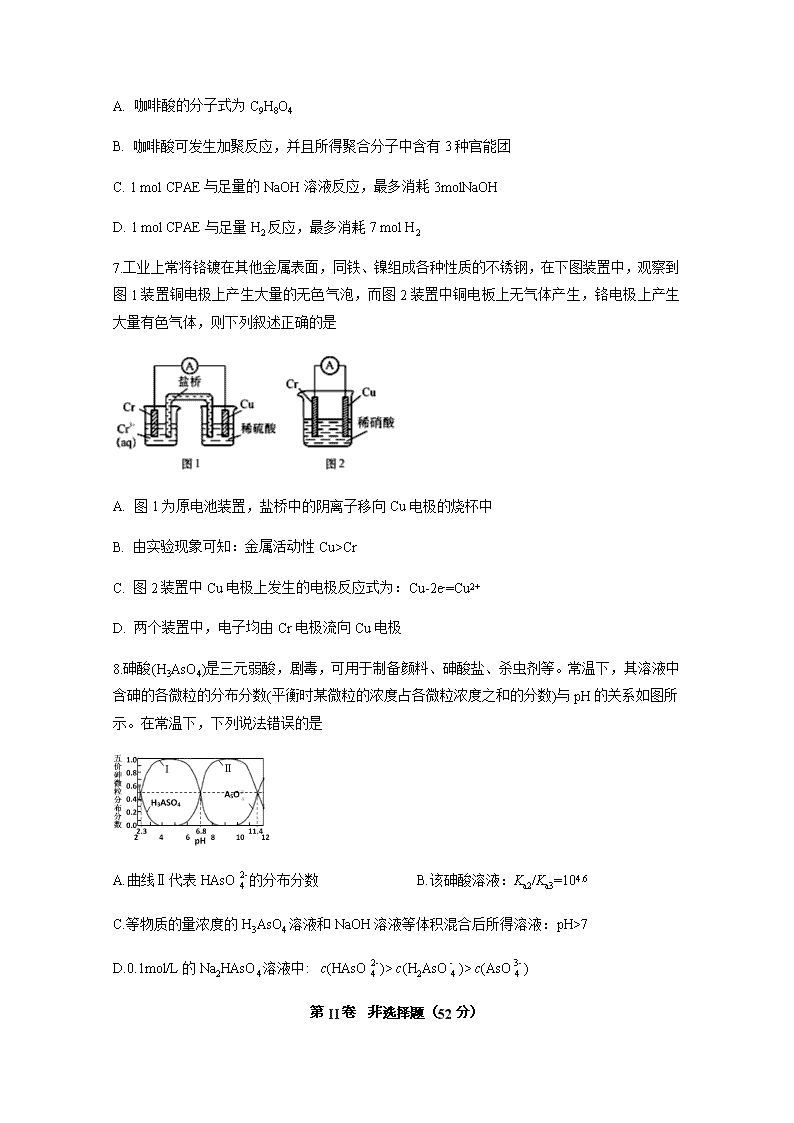
2020年春四川省宜宾市第四中学高二第四学月考试 化学试题 注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。2.答题时请按要求用笔。 3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 6.考试时间:150分钟;物理化学生物同堂分卷考试,物理110分,化学100分,生物90分,共300分 7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64 第I卷 选择题(48分) 一、单选题(每小题6分,共80个小题,共48分) 1.糖尿病患者的尿样中含有葡萄糖,在与新制的氢氧化铜悬浊液共热时,能产生红色沉淀。说明葡萄糖分子中含有 A.苯基 B.甲基 C.羟基 D.醛基 2.下列说法正确的是 A. 油脂的水解反应称为皂化反应 B. 淀粉、蛋白质均含有C、H、O、N、P等元素 C. 酶是一种常见的催化剂,温度越高,催化活性越强 D. 向鸡蛋清溶液中加入饱和硫酸钠溶液会析出白色沉淀,加水沉淀会重新溶解 3.用下列装置不能达到有关实验目的的是 A. 用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水) B. 用乙图装置制备Fe(OH)2 C. 用丙图装置制取金属锰 D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性 4.汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是 A. 汉黄芩素的分子式为C16H14O5 B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH C. 1mol该物质与溴水反应,最多消耗1molBr2 D. 该物质可发生取代、加成、缩聚、消去反应 5.NA为阿伏加德罗常数,下列说法正确的是 A. 7.8g苯所含碳碳双键数目为0.3NA B. 28g乙烯所含共用电子对数目为6NA C. 标准状况下,11.2 L溴乙烷所含分子数为0.5NA D. 26g乙炔和苯乙烯的混合物,含有原子总数为6NA 6.CPAE是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程如下。下列说法不正确的是 A. 咖啡酸的分子式为C9H8O4 B. 咖啡酸可发生加聚反应,并且所得聚合分子中含有3种官能团 C. 1 mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH D. 1 mol CPAE与足量H2反应,最多消耗7 mol H2 7.工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电板上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是 A. 图1为原电池装置,盐桥中的阴离子移向Cu电极的烧杯中 B. 由实验现象可知:金属活动性Cu>Cr C. 图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+ D. 两个装置中,电子均由Cr电极流向Cu电极 8.砷酸(H3AsO4)是三元弱酸,剧毒,可用于制备颜料、砷酸盐、杀虫剂等。常温下,其溶液中含砷的各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。在常温下,下列说法错误的是 A.曲线Ⅱ代表HAsO的分布分数 B.该砷酸溶液:Ka2/Ka3=104.6 C.等物质的量浓度的H3AsO4溶液和NaOH溶液等体积混合后所得溶液:pH>7 D.0.1mol/L的Na2HAsO4溶液中: c(HAsO)> c(H2AsO)> c(AsO) 第II卷 非选择题(52分) 9.(10分)溴乙烷是有机合成中的重要原料。实验室制备溴乙烷(C2H5Br,沸点38.4℃)的装置如图所示,其实验步骤为:①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②向仪器a中加入10mL 95%乙醇、28mL 92%浓硫酸,然后加入适量溴化钠和几粒碎瓷片;③在45~50℃加热2h,使其充分反应。回答下列问题: (1)仪器a的名称是________。 (2)在大烧杯中加入冰水的目的是________。 (3)加入碎瓷片的作用是________。 (4)为了更好的控制温度,选择常用的加热方式为________。 (5)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,生成的无色刺激性气味气体的分子式为________。 (6)U形管内可观察到的现象是_____________。 (7)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。 A.Na2SO3溶液 B.H2O C.NaOH溶液 D.苯 (8)检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,________。 10.(10分)铁及铁的氧化物广泛应于生产、生活、航天、科研领域。 (1)铁氧化合物循环分解水制H2 已知:H2O(l)===H2(g)+O2(g) ΔH1=+285.5 kJ/mol 6FeO(s)+O2(g) ===2Fe3O4(s) ΔH2=-313.2 kJ/mol 则:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH3=___________ (2)Fe2O3与CH4反应可制备“纳米级”金属铁,其反应为: 3CH4(g) + Fe2O3(s) 2Fe(s) + 6H2(g) +3CO(g) ΔH4 ①此反应的化学平衡常数表达式为_________________________________。 ②在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”金属铁,然后分别充入a molCO和2a mol H2,三个容器的反应温度分别保持T1、T2、T3,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是___________(选填“Ⅰ”“Ⅱ”或“Ⅲ”);制备“纳米级”金属铁的反应:ΔH4 _____ 0(填“>”或“<”)。 ③在T℃下,向某恒容密闭容器中加入3molCH4(g)和2mol Fe2O3(s)进行上述反应,反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。10 min内用Fe2O3(s)表示的平均反应速率为_______g·min-1; T℃下该反应的Kp = _____________________;T℃下若起始时向该容器中加入2molCH4(g)、4mol Fe2O3(s)、1molFe(s)、2mol H2(g)、2molCO(g),则起始时v (正)______v (逆) (填“>”、“<”或“=”)。 (3)纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O ①研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是_________________。 ②相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异,图2中所产生的差异的可能原因是__________________________________________________(答一条)。 11.(12分)氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的质量分数,设计如下两种实验方案。 (1)已知AlN与NaOH反应得到一种盐和一种碱性气体,化学反应方程式是____ (方案1)取一定量的样品,用图1装置测定样品中AlN的质量分数(夹持仪器已略去)。 (2)图1中仪器a的名称是___ (3)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。关闭K1,打开K2和分液漏斗活塞,加入NaOH浓溶液至不再产生气体,打开K1,通入氮气一段时间,测定C装置在反应前后的质量变化。通入氮气的目的是 。 (4)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 。 (方案2)用图2装置测定mg样品中AlN的质量分数(部分夹持装置己略去)。 (5)为测定生成气体的体积,量气装置中的X液体可以是 (填字母序号)。 a.CCl4 b.H2O c.饱和NH4Cl溶液 d.苯 (6)若mg样品完全反应,测得生成气体的体积为VmL(标准状况),则AlN的质量分数为 。若将b处胶管用弹簧夹夹住,其他操作均不变,则最终测定的结果 (填“偏大”“偏小”或“无影响”)。 12.(10分)2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题: (1)基态铁原子的价电子排布式为 。 (2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表的___区。 (3)实验室常用KSCN溶液、苯酚()检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为 (用元素符号表示),苯酚中碳原子的杂化轨道类型为 。 (4)铁元素能于CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含 molσ键,与CO互为等电子体的一种离子的化学式为 。 (5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的 空隙和 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(,0,),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为 。 (6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为___,晶胞参数为428pm,则晶体密度为___g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。 13.(10分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: 已知:RXROH;RCHO+CH3COOR’ RCH=CHCOOR’ 请回答: (1)E中官能团的名称是 。(2)B+D→F的化学方程式 。(3)X的结构简式 。 (4)对于化合物X,下列说法正确的是 。 A.能发生水解反应 B.不与浓硝酸发生取代反应 C.能使Br2/CCl4溶液褪色 D.能发生银镜反应 (5)下列化合物中属于F的同分异构体的是 。 2020年春四川省宜宾市第四中学高二第四学月考试 化学试题答案 1.D 2.D 3.D 4.B 5.B 6.B 7.C 8.C 9. 圆底烧瓶 使C2H5Br冷凝成液态 防止暴沸 水浴加热 Br2 SO2 有油状液体生成 A 加入稀HNO3酸化,再加入AgNO3溶液,观察是否生成黄色沉淀 10.+128.9 kJ/mol Ⅲ > 8 P06 > 纳米铁粉与H+反应生成H2 Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率) 11.AlN+NaOH+H2O=NaAlO2+NH3↑ 干燥管 将A中残留气体全部赶至C中 C装置后添加一个装有碱石灰的干燥管 a、d 4.1V22.4m% 偏大 12.3d64s2 s、ds N>O>S sp2杂化 10 CN- 正四面体 正八面体 8:3 13.(1)醛基 (2) (3) (4)AC (5)BC查看更多