- 2021-07-03 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国版2021高考化学一轮复习题型突破13物质结构与性质的综合应用课件
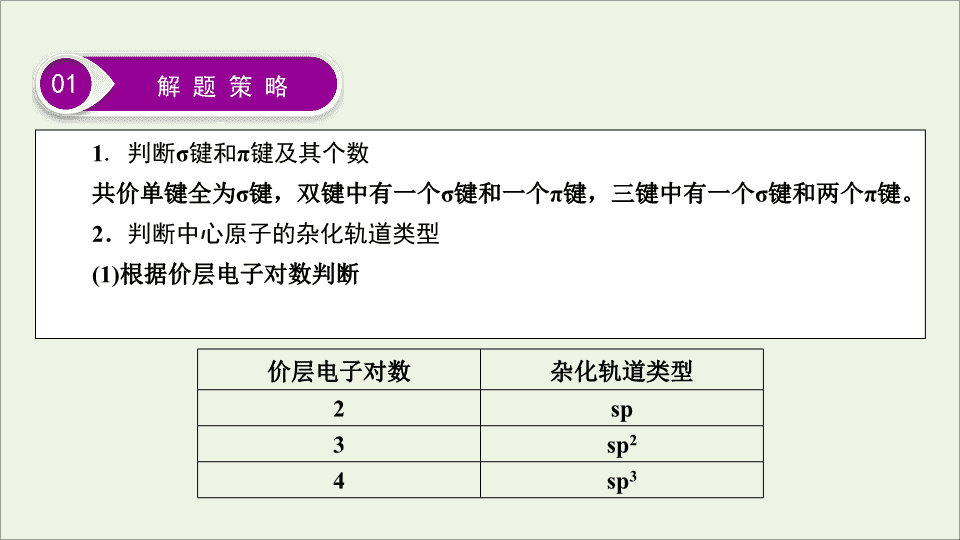
《 物质结构与性质 》 选修 3 第十一章 题型突破 13 物质结构与性质的综合应用 物质结构与性质的综合应用题是高考命题选考题中的经典题型,该题型命题形式和命题角度灵活,涵盖知识广,有关核外电子的排布规律、元素的电离能、电负性的变化规律及其应用、化学键类型的判断、价层电子对互斥模型、杂化轨道类型以及微粒的立体构型的判断、晶体的类型及性质、配位数、晶胞模型的分析及计算等都是物质结构选考模块的必考点,其中有关晶胞模型的分析及计算是该题型解题的难点,同时该题型还能够很好地考查学生分析问题和解决问题的能力,以及空间想象和逻辑思维能力,题目难度一般较大,复习备考时要引起特别关注。该题型解题的关键是深刻理解物质结构的相关理论,构建解决问题的思维模型,以结构决定性质为抓手,找准问题的切入点进行解题。 1 . 判断 σ 键和 π 键及其个数 共价单键全为 σ 键,双键中有一个 σ 键和一个 π 键,三键中有一个 σ 键和两个 π 键。 2 . 判断中心原子的杂化轨道类型 (1) 根据价层电子对数判断 01 解 题 策 略 价层电子对数 杂化轨道类型 2 sp 3 sp 2 4 sp 3 4 . 晶体结构中的有关计算 (1) 确定晶体的化学式:根据晶胞的结构特点利用均摊法确定。 ①图示: [ 示例 1] 某镍白铜合金的立方晶胞结构如图所示,该晶胞的质量为 ________g 。 [ 示例 2] (2016 · 全国卷 Ⅲ , 37) GaAs 晶体的密度为 ρ g · cm - 3 ,其晶胞结构如图所示。 Ga 和 As 的摩尔质量分别为 M Ga g · mol - 1 和 M As g · mol - 1 ,原子半径分别为 r Ga pm 和 r As pm ,阿伏加德罗常数值为 N A ,则 GaAs 晶胞中原子的体积占晶胞体积的百分率为 _____________________________ 。 [ 示例 3] (2018 · 全国卷 Ⅰ , 35(5)) Li 2 O 具有反萤石结构,晶胞如图所示。已知晶胞参数为 0.466 5 nm ,阿伏加德罗常数的值为 N A ,则 Li 2 O 的密度为 _______________________ g · cm ﹣3 ( 列出计算式 ) 。 [ 示例 4] Cu 与 F 形成的化合物的晶胞结构如图所示,若晶体密度为 a g · cm - 3 ,则 Cu 与 F 最近距离为 ______________________pm 。 ( 阿伏加德罗常数用 N A 表示,列出计算表达式,不用化简;图中○为 Cu ,●为 F) 02 真 题 示 例 1 . (2018 · 全国卷 Ⅲ , 35) 锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题: (1)Zn 原子核外电子排布式为 ________________________________________ 。 (2) 黄铜是人类最早使用的合金之一,主要由 Zn 和 Cu 组成。第一电离能 I 1 (Zn)_____ I 1 (Cu)( 填 “ 大于 ” 或 “ 小于 ” ) 。原因是 ___________________________ _______________ 。 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 或 [Ar]3d 10 4s 2 大于 Zn 核外电子排布为全满结构, 较难失电子 (3)ZnF 2 具有较高的熔点 (872 ℃) ,其化学键类型是 ________ ; ZnF 2 不溶于有机溶剂而 ZnCl 2 、 ZnBr 2 、 ZnI 2 能够溶于乙醇、乙醚等有机溶剂,原因是 ____________ ___________________________________________________________________ 。 (4)《 中华本草 》 等中医典籍中,记载了炉甘石 (ZnCO 3 ) 入药,可用于治疗皮肤炎症或表面创伤。 ZnCO 3 中,阴离子空间构型为 ________________ , C 原子的杂化形式为 ________ 。 离子键 ZnF 2 为离子化合物,极性大, ZnCl 2 、 ZnBr 2 、 ZnI 2 的化学键以共价键为主,极性较小 平面三角形 sp 2 (5) 金属 Zn 晶体中的原子堆积方式如图所示,这种堆积方式称为 _______________________ 。六棱柱底边边长为 a cm ,高为 c cm ,阿伏加德罗常数的值为 N A , Zn 的密度为 ____________________g · cm - 3 ( 列出计算式 ) 。 解析 (1) 锌的核外有 30 个电子,因此其核外电子排布式为 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ,也可写作 [Ar] 3d 10 4s 2 。 (2) 锌的价层电子排布式为 3d 10 4s 2 ,为全满稳定结构,较难失去电子,铜的价层电子排布式为 3d 10 4s 1 ,较易失去一个电子,因此锌的第一电离能大于铜的第一电离能。 六方最密堆积 (A 3 型 ) (3) 由 ZnF 2 的熔点为 872 ℃ 可知, ZnF 2 应为离子晶体,因此化学键类型为离子键。 ZnF 2 为离子化合物,极性较大,不溶于有机溶剂; ZnCl 2 、 ZnBr 2 、 ZnI 2 的化学键以共价键为主,极性较小,能够溶于有机溶剂。 (4)C 原子价层电子对数 n = (4 + 3 × 0 + 2)/2 = 3 ,因此 C 原子为 sp 2 杂化, CO 的空间构型为平面三角形。 2 . (2017 · 全国卷 Ⅲ , 35) 研究发现,在 CO 2 低压合成甲醇反应 (CO 2 + 3H 2 ===CH 3 OH + H 2 O) 中, Co 氧化物负载的 Mn 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题: (1)Co 基态原子核外电子排布式为 ____________ 。元素 Mn 与 O 中,第一电离能较大的是 ________ ,基态原子核外未成对电子数较多的是 ________ 。 (2)CO 2 和 CH 3 OH 分子中 C 原子的杂化形式分别为 ______ 和 ________ 。 (3) 在 CO 2 低压合成甲醇反应所涉及的 4 种物质中,沸点从高到低的顺序为 _________________________ ,原因是 _______________________________________ ______________________________________________________________________ 。 (4) 硝酸锰是制备上述反应催化剂的原料, Mn(NO 3 ) 2 中的化学键除了 σ 键处,还存在 ____________________ 。 [Ar]3d 7 4s 2 O Mn sp sp 3 H 2 O > CH 3 OH > CO 2 > H 2 H 2 O 与 CH 3 OH 均为极性分子, H 2 O 中氢键比甲醇多; CO 2 与 H 2 均为非极性分子, CO 2 相对分子质量较大,范德华力较大 解析 (1)Co 是 27 号元素,其基态原子核外电子排布式为 [Ar] 3d 7 4s 2 或 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2 。元素 Mn 与 O 中,由于 O 是非金属元素而 Mn 是金属元素,所以 O 的第一电离能大于 Mn 的。 O 基态原子核外电子排布式为 1s 2 2s 2 2p 4 ,其核外未成对电子数是 2 ,而 Mn 基态原子核外电子排布式为 [Ar] 3d 5 4s 2 ,其核外未成对电子数是 5 ,因此 Mn 的基态原子核外未成对电子数比 O 的多。 (2)CO 2 和 CH 3 OH 的中心原子 C 的价层电子对数分别为 2 和 4 ,所以 CO 2 和 CH 3 OH 分子中 C 原子的杂化形式分别为 sp 和 sp 3 。 (3) 由于水和甲醇均为极性分子,二氧化碳和氢气均为非极性分子,所以水和甲醇的沸点高于二氧化碳和氢气的沸点;由于水分子中两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇的沸点;由于二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。 (4) 硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中 N 原子与 3 个氧原子形成 3 个 σ 键,硝酸根中存在氮氧双键,所以还存在 π 键。 03 即 时 训 练 3d 2 4s 2 N > C > H N( 或氮 ) 19 N A ( 或 19×6.02×10 23 或 1.1438×10 24 ) sp 3 、 sp 2 乙酸钠 ( 或 CH 3 COONa) 乙酸钠固体是离子晶体,乙酰氯固体是分子晶体 > 6 解析 (1) 钛是 22 号元素,其基态原子电子排布式为 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 ,价电子排布式为 3d 2 4s 2 。 (2)① 构成 4 — 二甲氨基吡啶的原子有 C 、 N 、 H , C 、 N 同处于第二周期,随着原子序数增大,同周期从左到右电负性增大,而 H 位于第一周期,电负性较小,所以电负性 N>C>H 。同一周期,从左到右各元素的第一电离能总体呈增大的趋势,但是当原子的价电子层原子轨道为全满或者半满时状态稳定,所以它们的第一电离能比相邻的原子都要大,即 N 的第一电离能比相邻的 C 大,而 H 位于第一周期第一电离能较小,因此三种元素的第一电离能最大的是 N 元素。②根据 4 — 二甲氨基吡啶的结构,可知 1 mol 该分子中的 σ 键共有 19 mol 。分子中甲基上的 C 原子的杂化方为 sp 3 杂化,杂环上 C 原子的杂化方为 sp 2 杂化。 2 . (2019 · 安徽皖北联考 ) 有 A 、 B 、 C 、 D 、 E 五种原子序数依次增大的元素 ( 原子序数均小于 30) 。 A 的基态原子 2p 能级有 3 个单电子; C 的基态原子 2p 能级有 1 个单电子; E 原子最外层有 1 个单电子,其次外层有 3 个能级且均排满电子; D 与 E 同周期,价电子数为 2 。则: (1)B 元素的氢化物的沸点是同族元素氢化物中最高的,原因是 ______________________ 。 (2)A 、 B 、 C 三种元素的氢化物稳定性由强到弱的顺序为 __________________( 用化学式表示 ) 。 (3)A 的最简单氢化物分子的立体构型为 ___________ ,其中 A 原子的杂化类型是 ______ 杂化。 H 2 O 分子间存在氢键 HF > H 2 O > NH 3 三角锥形 sp 3 (4)A 的单质中 σ 键的个数为 ______ , π 键的个数为 ______ 。 (5) 写出基态 E 原子的价电子排布式: ________ 。 (6)C 和 D 形成的化合物的晶胞结构如图所示,已知晶体的密度为 ρ g · cm - 3 , N A 为 阿伏加德罗常数的值,则晶胞边长 a = ________cm( 用 ρ 、 N A 的计算式表示 ) 。 1 2 3d 10 4s 1查看更多