2018届一轮复习人教版化学平衡的移动(加试要求)教案
第三单元 化学平衡的移动(加试要求)
浙江考试标准
知识条目
必考要求
加试要求
(1)化学平衡移动的概念
a
(2)影响化学平衡移动的因素及平衡移动方向的判断
b
(3)用化学平衡移动原理选择和确定合适的生产条件
c
考点1| 化学平衡的移动
[基础知识自查]
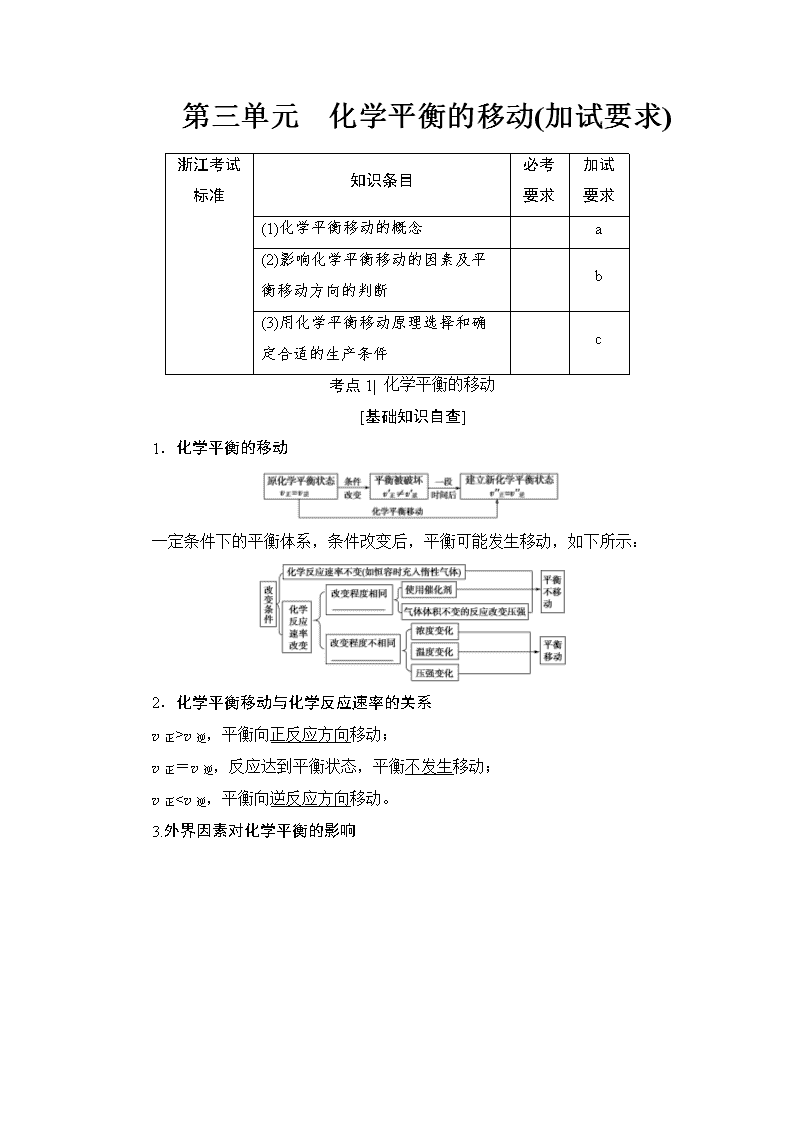
1.化学平衡的移动
一定条件下的平衡体系,条件改变后,平衡可能发生移动,如下所示:
2.化学平衡移动与化学反应速率的关系
v正>v逆,平衡向正反应方向移动;
v正=v逆,反应达到平衡状态,平衡不发生移动;
v正
v逆时,才使平衡向正反应方向移动。
(3)外界条件改变时,化学平衡发生移动,最终结果只能“减弱”条件的改变,但不能“消除”改变。
[典型例题讲解]
(2017·浙江嘉兴学科基础测试)某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率随时间的变化如图所示。下列说法中正确的是( )
【导学号:81640108】
A.30 min时降低温度,40 min时升高温度
B.30 min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8 min前,C的平均反应速率为0.08 mol·L-1·min-1
【解析】 根据图象,A、B的浓度随时间变化是一条曲线,说明反应方程式中A、B的化学计量数相等,反应方程式中的x=1,则该反应是一个反应前后气体物质的量不变的反应,改变压强平衡不移动。30 min时,A、B、C浓度都减小,正、逆反应速率相等,平衡不移动,应该是减压,故A错误;30 min时,向容器内再充入一定量的C,相当于加压,加压平衡不移动,A的体积分数不变,故B正确;反应方程式中的x=1,40 min时升高温度,平衡逆向移动,逆反应为吸热反应,故C错误;8 min前,C的平均反应速率为1.36 mol·L-1÷8 min=0.17 mol·L-1·min-1,故D错误。
【答案】 B
工业上采取下列方法消除NO2污染:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ/mol,下列说法正确的是( )
A.冷却使水液化可提高NO2的平衡转化率
B.提高反应温度,平衡常数增大
C.缩小容器的体积,逆反应速率增大的程度比正反应速率增大的程度小
D.加入合适的催化剂可提高NO2的平衡转化率
【解析】 选项A,减小生成物浓度,平衡向正反应方向移动,NO2的平衡转化率增大,正确;选项B,升温平衡向逆反应方向移动,平衡常数减小,错误;选项C,缩小容器体积相当于加压,平衡向逆反应方向移动,逆反应速率增大的程度更大,错误;选项D,使用催化剂对平衡的移动无影响,错误。
【答案】 A
平衡移动与转化率的关系
判断转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况而定。若有多种反应物,增大某一反应物的浓度,则另外的反应物的转化率增大而自身的减小。若只有一种反应物时(恒温恒容)
反应实例
反应物的浓度
平衡移动
转化率变化
2SO3(g)
2SO2(g)+O2(g)
增大
正向
减小
2NO2(g)
N2O4(g)
增大
正向
增大
2HI(g)I2(g)+
H2(g)
增大
正向
不变
[题组对点训练]
1.已知反应A2(g)+2B2(g)2AB2(g) ΔH<0。下列说法正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.升高温度有利于反应速率的增大,从而缩短达到平衡所需的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
B [A项,升温时,正、逆反应速率均增大;B项,升温时增大反应速率,能缩短达到平衡的时间;C项,该反应为放热反应,升温时平衡向逆反应方向移动;D项,降温或加压有利于平衡向正反应方向移动。]
2.放热反应2NO(g)+O2(g)2NO2(g)达平衡后,若分别采取下列措施:①增大压强 ②减小NO2的浓度 ③增大O2浓度 ④升高温度 ⑤加入催化剂。能使平衡向正反应方向移动的是( )
A.①②③ B.②③④
C.③④⑤ D.①②⑤
A [①增大压强,平衡向减小体积的方向即正向移动。②减小NO2的浓度,平衡向生成NO2的方向,即正向移动。③增大O2浓度,平衡向消耗O2的方向即正向移动。④升温,平衡向吸热的方向即逆向移动。⑤使用催化剂,平衡不移动。]
3.(2017·浙江金华模拟)低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH<0在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使反应物的转化率增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为6∶5时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
C [A项,该反应正向为放热反应,升温平衡左移,反应物的转化率减小。B项,增加NH3的浓度,平衡右移,废气中氮氧化物的转化率增大。C项,消耗NO,说明反应向右进行,消耗N2说明反应向左进行,且消耗物质的物质的量比为n(NO)∶n(N2)=6∶5时,说明反应速率相等,即正逆反应速率相等。D项,用催化剂平衡不移动,转化率不变。]
4.有可逆反应A(g)+3B(g)2C(g) ΔH<0。该反应的速率与时间的关系如图所示:
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是( )
A.使用了催化剂、增大压强、减小反应物浓度、降低温度
B.升高温度、减小压强、减小反应物浓度、使用了催化剂
C.增大反应物浓度、使用了催化剂、减小压强、升高温度
D.升高温度、减小压强、增大反应物浓度、使用了催化剂
D [t2时正逆反应速率均增大,且平衡逆向移动,排除A、C选项,t6正反应速率大于逆反应速率,平衡正向移动,所以只有增大反应物浓度,D选项符合。]
5.研究工作表明,乙苯脱氢生成苯乙烯与氢气的反应如下:
ΔH=+124.9 kJ/mol,反应达到平衡后,只改变横坐标表示的反应条件,下列示意图正确的是( )
D [选项A,升高温度,平衡正向移动,乙苯的转化率增大,A错误。选项B,增大压强,平衡逆向移动,苯乙烯的产率降低,B错误。选项C,升高温度,正逆反应速率均增大,C错误。选项D,增大乙苯的物质的量,乙苯的转化率降低,D正确。]
考点2| 化学反应速率 化学平衡的图象
[基础知识自查]
1.速率-压强(或温度)图象
特点:曲线表示的是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。图中交点是平衡状态,压强(或温度)增大后正反应速率增大得快,平衡正向移动。
2.转化率(或质量分数等)-压强-温度图象
特点:表示两个外界条件同时变化时,A的转化率的变化规律。解决这类图象题,采用“定一议二法”,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。
特点:如上图中曲线上的点表示平衡状态,而X、Y点则未达平衡状态,使反应由X点达到平衡状态,反应需向B的百分含量减小的方向进行;要使反应由Y点达到平衡状态,反应需向B的百分含量增大的方向进行。
3.质量分数-时间图象
特点:表示不同条件下反应速率的快慢以及平衡混合物中D的质量分数大小。解题方法是“先拐先平数值大”,即曲线先拐的首先达到平衡,反应速率快,以此判断温度或压强的高低,再依据外界条件对平衡的影响分析。
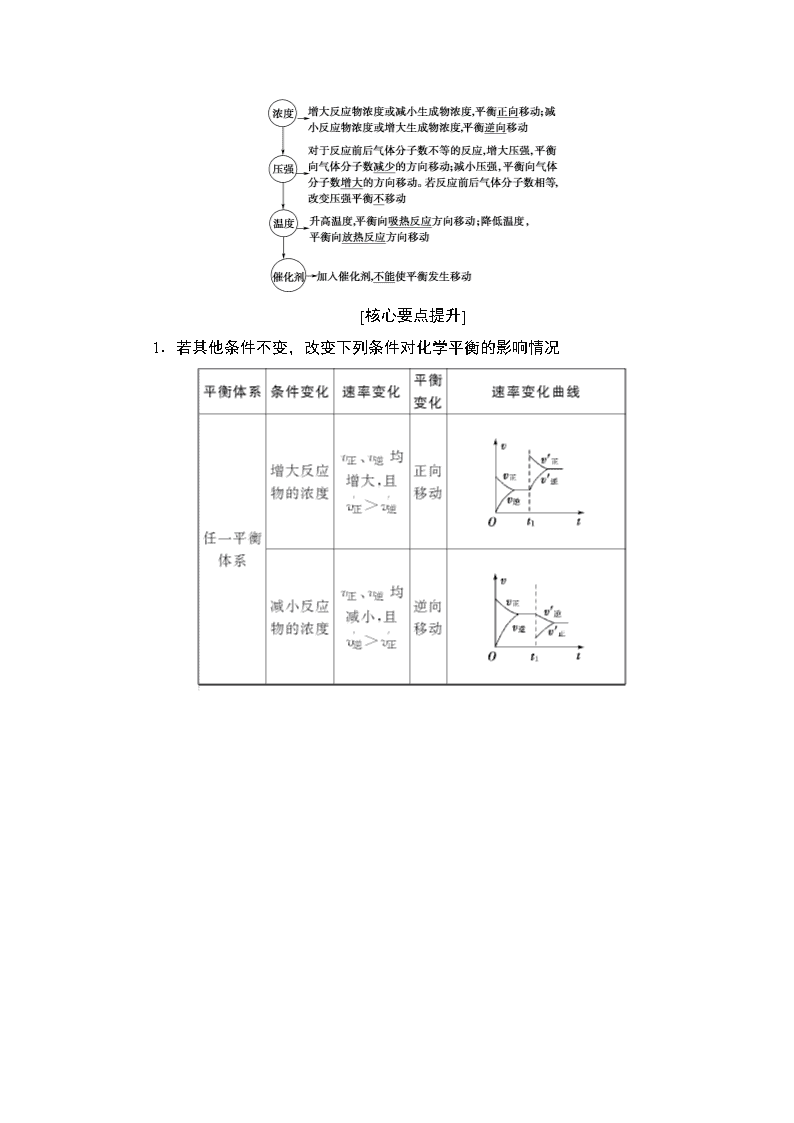
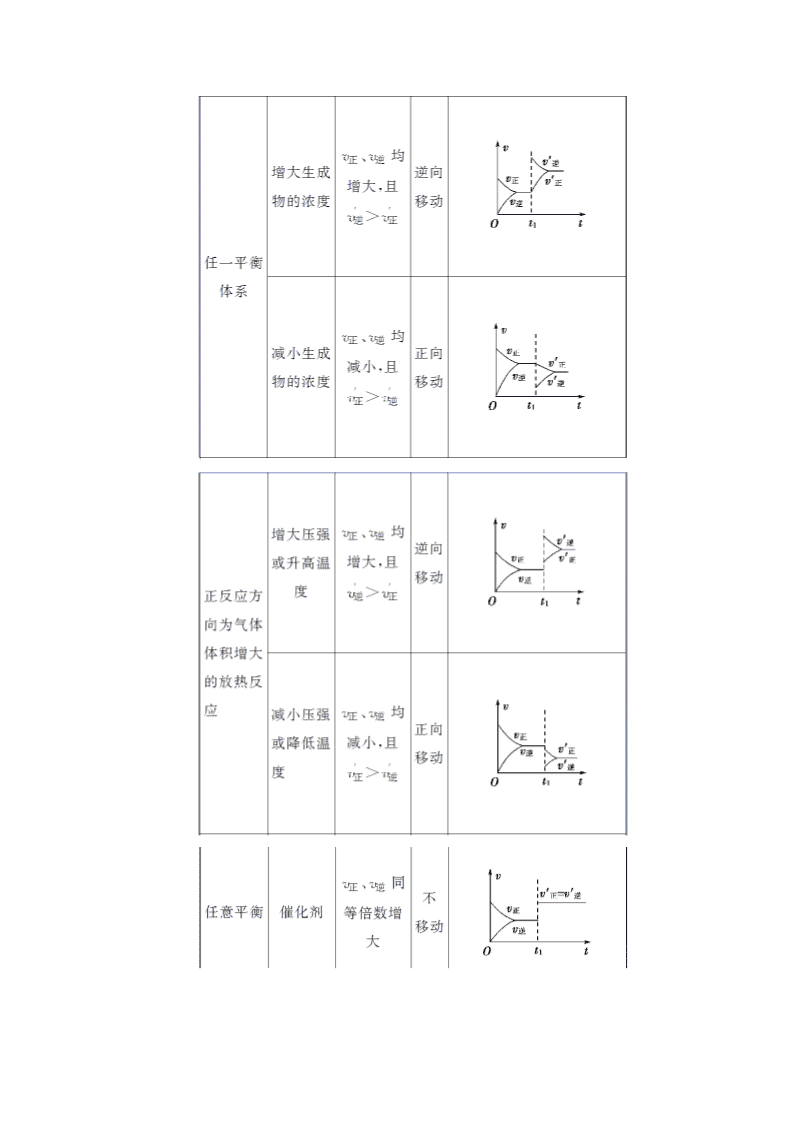
[核心要点提升]
1.解题思路和方法
2.解答原则
以可逆反应aA(g)+bB(g)cC(g)为例:
(1)“定一议二”原则。
在化学平衡图象中,包括纵坐标、横坐标和曲线所表示的意义三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系或确定纵坐标所表示的量,讨论横坐标与曲线的关系。如图:
这类图象的分析方法是“定一议二”,当有多条曲线及两个以上条件时,要固定其中一个条件,分析其他条件之间的关系,必要时,作一辅助线分析。
(2)“先拐先平,数值大”原则。
在化学平衡图象中,先出现拐点的反应先达到平衡,先出现拐点的曲线表示的温度较高(如图A)或表示的压强较大(如图B)。
图A 图B
图A表示T2>T1,正反应是放热反应。
图B表示p1c。
[典型例题讲解]
在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
【导学号:81640109】
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
【解析】 根据图象给出的在不同温度下达到平衡所需要的时间可得出:T1>T2,再根据不同温度下达到平衡时c(X)的大小可推出此反应为放热反应。M点X的转化率小于W点X的转化率,因此反应进行到M点放出的热量小于进行到W点放出的热量,选项A不正确。T2下,在0~t1时间内,v(X)= mol·L-1·min-1,v(Y)=v(X)= mol·L-1·min-1,选项B不正确。M点时在恒容条件下再加入一定量X,相当于增大压强,平衡正向移动,平衡后X的转化率增大,选项D不正确。在T1和T2温度时,当达到平衡状态时,M点v正(M)=v逆(M),W点v正(W)=v逆(W),温度高反应速率快,v逆(M)>v逆(W),又v逆(W)>v逆(N),则v逆(M)>v逆(N),则v正(M)>v逆(N),选项C正确。
【答案】 C
一定温度下的密闭容器中发生反应:X(g)+3Y(g)2Z(g)ΔH<0,反应达到平衡及改变条件平衡移动的图象如图所示。下列说法错误的是( )
A.c点和d点X的正逆反应速率相等
B.起始时,加入Y的物质的量为1.3 mol
C.平衡状态由A变到B时,平衡常数:K(A)0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1v(逆)
D.状态A与状态B相比,状态A的c(I2)大
C [由图可知,随温度升高,c(I)减小,平衡逆向移动,说明正反应为放热反应,即ΔH<0,A项错误。由图可知,正反应为放热反应,则升温,K值减小,即K1>K2,B项错误。D点没有达到平衡,c(I)偏小(要向A点移动),即反应要向右进行,所以此时v(正)>v(逆),C项正确。由图知,c(I):状态A>状态B,则c(I2)为:状态A<状态B,所以D项错误。]
3.(2017·浙江诸暨中学一模)在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列叙述不正确的是( )
A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.066 7 mol/(L·min)
B.该反应的化学方程式为2D(s)2A(g)+B(g),该反应的平衡常数表达式为K=c2(A)·c(B)
C.已知反应的ΔH>0,则第5分钟时图像呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
D [从反应开始到第一次达到平衡时,A物质增加了0.4 mol,则A的平均反应速率为≈0.066 7 mol/(L·min),A正确;平衡时D减少了0.4 mol,A增加了0.4 mol,B增加了0.2 mol,即D、A、B变化的物质的量之比是2∶2∶1,所以该反应的化学方程式为2D(s)2A(g)+B(g),该反应的平衡常数表达式为K=c2(A)·c(B),B正确;如果正反应是吸热反应,则升高温度平衡向正反应方向移动,因此符合图中曲线变化趋势,C正确;D是固体,改变固体的质量,平衡不移动,则表示A的物质的量变化正确的是b曲线,D不正确。]
4.某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象如图所示,其中图象和实验结论表达均正确的是( )
A.①是其他条件一定时,反应速率随温度变化的图象,正反应ΔH<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
C [根据图象①,升高温度,平衡正向移动,正反应ΔH>0,A错;②反应实质是Fe3++3SCN-Fe(SCN)3,K+和Cl-不参加化学反应,KCl浓度增大不影响化学平衡,B错;③使用催化剂,反应速率加快,先达到平衡,C正确;④此反应为反应前后气体物质的量不变的化学反应,改变压强不影响平衡状态,即不影响A的转化率,且由于不断加入B,A的转化率增大,D错。]
5.反应Ⅱ:2H2SO4(l)===2SO2(g)+O2(g)+2H2O(g)
ΔH=+550 kJ·mol-1
它由两步反应组成:
ⅰ.H2SO4(l)===SO3(g)+H2O(g)
ΔH=+177 kJ·mol-1;
ⅱ.SO3(g)分解。
L(L1,L2),X可分别代表压强或温度。如图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。
(1)X代表的物理量是________。
(2)判断L1、L2的大小关系________,并简述理由:__________。
【解析】 已知:2H2SO4(l)===2SO2(g)+O2(g)+2H2O(g) ΔH=+550 kJ·mol-1,H2SO4(l)===SO3(g)+H2O(g) ΔH=+177 kJ·mol-1。根据盖斯定律可得:2SO3(g)===2SO2(g)+O2(g) ΔH=+196 kJ·mol-1。图象中SO3的平衡转化率随X的增大而减小,则X应为压强,则L
代表温度;该反应为吸热反应,依据勒夏特列原理知当压强一定时,温度升高,平衡转化率增大,因此L1
查看更多