- 2021-07-02 发布 |
- 37.5 KB |
- 40页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习阿伏加德罗常数课件(40张)
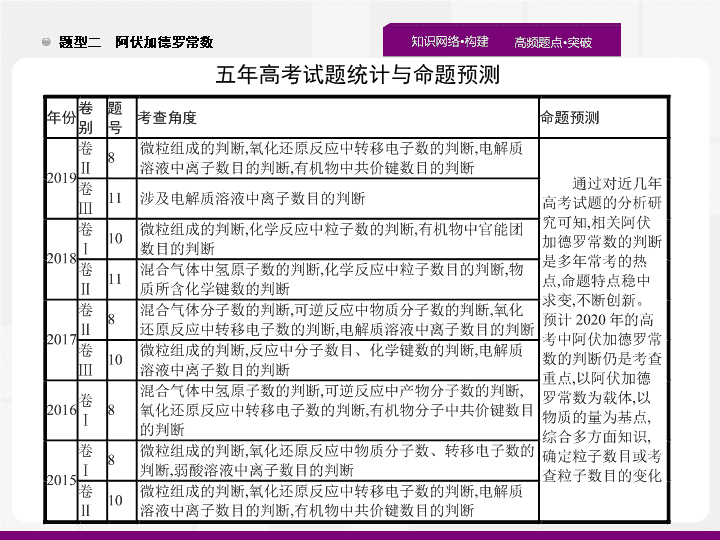
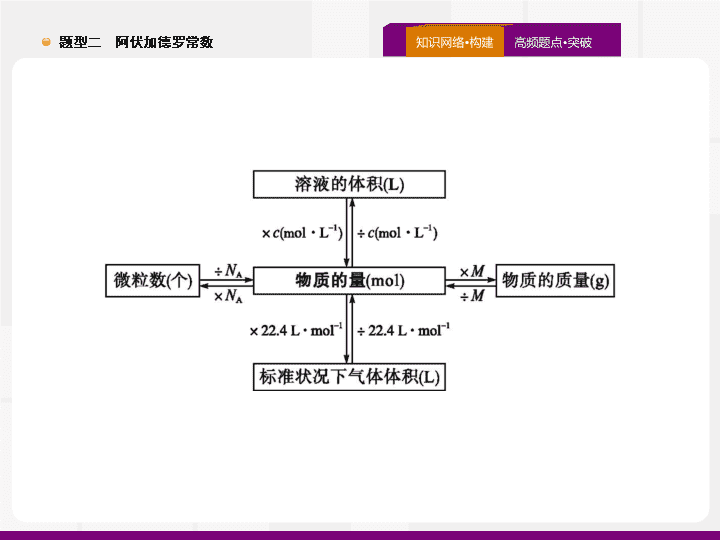
题型二 阿伏加德罗常数 五年高考试题统计与命题 预测 题点一 题点二 题点三 真题诊断 必备知识 对点演练 涉及微粒组成的 判断 1 .(2019· 全国 Ⅱ ,8) 已知 N A 是阿伏加德罗常数的值 , 下列说法错误的是 ( ) A.3 g 3 He 含有的中子数为 1 N A B.1 L 0.1 mol·L -1 磷酸钠溶液含有的 P 数目 为 0.1 N A C.1 mol K 2 Cr 2 O 7 被还原为 Cr 3+ 转移的电子数为 6 N A D.48 g 正丁烷和 10 g 异丁烷的混合物中共价键数目为 13 N A 答案 : B 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : 3 He 的质量数是 3, 每个 3 He 原子含有 1 个中子 , 所以 3 g 3 He 含有的中子数为 1 N A ,A 项正确 ; 磷酸钠溶液中部分磷酸根离子发生水解 , 导致溶液中磷酸根离子数目减小 ,1 L 0.1 mol·L -1 磷酸钠溶液中的磷酸根离子数目小于 0.1 N A ,B 项错误 ;K 2 Cr 2 O 7 中 Cr 的价态为 +6 价 , 变为 Cr 3+ 降了 3 价 , 故 1 mol K 2 Cr 2 O 7 被还原为 Cr 3+ 转移的电子数为 6 N A ,C 项正确 ; 正丁烷和异丁烷互为同分异构体 ,1 个正丁烷分子和 1 个异丁烷分子中所含共价键数相同 , 即 1 个正丁烷分子和 1 个异丁烷分子中均含有 13 个共价键 ,58 g 正丁烷和异丁烷的混合物的总物质的量为 1 mol, 所以含有的共价键数为 13 N A ,D 项正确。 易错警示 正丁烷和异丁烷只是碳链不同 , 分子中含有的共价键数相同。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2018· 全国 Ⅱ ,11) N A 代表阿伏加德罗常数的值 , 下列说法正确的是 ( ) A. 常温常压下 ,124 g P 4 中所含 P—P 键数目为 4 N A B.100 mL 1 mol·L -1 FeCl 3 溶液中所含 Fe 3+ 的数目为 0.1 N A C. 标准状况下 ,11.2 L 甲烷和乙烯混合物中含氢原子数目为 2 N A D. 密闭容器中 ,2 mol SO 2 和 1 mol O 2 催化反应后分子总数为 2 N A 答案 : C 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : 124 g P 4 的物质的量为 1 mol, 根据 P 4 的结构 ( ) 可知 , 1 个 P 4 分子中含有 6 个 P—P 键 ,1 mol P 4 中含有 6 N A 个 P—P 键 ,A 项错误 ; 因为 Fe 3+ 会发生水解生成 Fe(OH) 3 , 故 100 mL 1 mol·L -1 FeCl 3 溶液中 Fe 3+ 的数目小于 0.1 N A ,B 项错误 ; 根据化学式可知 ,1 mol CH 4 和 1 mol CH 2 =CH 2 中均含有 4 mol 氢原子 , 标准状况下 ,11.2 L 混合气体的物质的量为 0.5 mol, 所含氢原子的物质的量为 2 mol, 即所含氢原子数目为 2 N A ,C 项正确 ;SO 2 和 O 2 的反应为可逆反应 ,2 mol SO 2 和 1 mol O 2 不能全部转化成 2 mol SO 3 , 故分子总数大于 2 N A ,D 项错误。 反思总结 回答类似问题要注意可能发生的反应及反应进行的程度 ; 要熟悉常见物质的分子组成及结构。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2018· 全国 Ⅲ ,8) 下列叙述正确的是 ( ) A.24 g 镁与 27 g 铝中 , 含有相同的质子数 B. 同等质量的氧气和臭氧中 , 电子数相同 C.1 mol 重水与 1 mol 水中 , 中子数比为 2 ∶ 1 D.1 mol 乙烷和 1 mol 乙烯中 , 化学键数相同 答案 : B 解析 : 24 g 镁和 27 g 铝的物质的量都是 1 mol, 分别含有 12 N A 、 13 N A 个质子 ,A 项错误 ; 氧气和臭氧是同素异形体 , 两种分子均由氧原子构成 , 故同等质量的氧气和臭氧所含原子数相同 , 则电子数也相同 ,B 项正确 ; 重水和水分子中的中子数分别是 10 、 8, 相同物质的量的重水和水所含的中子数之比为 5 ∶ 4,C 项错误 ; 乙烷分子中有 7 个化学键 , 乙烯分子中有 6 个化学键 ,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 4 .(2017· 全国 Ⅲ ,10) N A 为阿伏加德罗常数的值。下列说法正确的是 ( ) A.0.1 mol 的 11 B 中 , 含有 0.6 N A 个中子 B.pH=1 的 H 3 PO 4 溶液中 , 含有 0.1 N A 个 H + C.2.24 L( 标准状况 ) 苯在 O 2 中完全燃烧 , 得到 0.6 N A 个 CO 2 分子 D. 密闭容器中 1 mol PCl 3 与 1 mol Cl 2 反应制备 PCl 5 (g), 增加 2 N A 个 P—Cl 键 答案 : A 解析 : A 项 ,1 个 11 B 中含有 6 个中子 ,0.1 mol 11 B 含有 0.6 N A 个中子 , 正确 ;B 项没有给出溶液的体积 , 不能计算 H + 数目 , 错误 ;C 项 , 标准状况下苯是液体 , 不能用气体摩尔体积计算其物质的量 , 错误 ;D 项 ,PCl 3 与 Cl 2 生成 PCl 5 的反应是可逆反应 , 所以 1 mol PCl 3 与 1 mol Cl 2 反应制备 PCl 5 , 增加的 P—Cl 键的数目小于 2 N A , 错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 特别提醒 利用 22.4 L·mol -1 进行气体体积的计算 , 一定注意所给条件是否标准状况 , 所给物质在该条件下是否为气体 , 同时看清待求量是物质的量还是分子个数。溶液中粒子数的判断要注意所给物质在溶液中的电离或反应是否完全 , 是否缺少计算所需必要条件。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 . 物质组成中分子数、原子数、离子数、中子数、质子数或电子数的准确判断 , 要根据分子、原子的实际组成及变化过程的实际进行分析。高考命题常涉及的物质或反应有 : (1) 稀有气体、臭氧 (O 3 ) 、白磷 (P 4 ) 分子中的原子数 ; (2)Na 2 O 2 、 KO 2 中的阴、阳离子个数比 ; (3) 混合气体中原子数的判断。如混合烯烃、环烷烃中碳原子数或氢原子数的判断。 (4) 弱电解质电离或盐的水解等可逆过程。 (5) 胶体溶液中粒子数的判定等。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 . 特殊物质的摩尔质量或分子中的微粒数 关注特殊物质的摩尔质量及分子中所含的中子数、质子数是破解这类问题的关键。如 D 2 O 、 T 2 O 的摩尔质量分别为 20 g·mol -1 、 22 g·mol -1 , 分子中所含中子数分别为 10 、 12 。 3 . 一些物质中化学键的数目 准确判断物质中化学键的数目是解题的关键。 1 mol CH 4 中含有 4 mol C—H 键 ;1 mol SiO 2 中含有 4 mol Si—O 键 ; 含 1 mol 硅原子的晶体硅中含 2 mol Si—Si 键 ;1 mol P 4 中含有 6 mol P—P 键 ; 苯分子中不含碳碳双键等。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 .(2019· 江西南昌十中二模 ) 设 N A 为阿伏加德罗常数的值。下列说法正确的是 ( ) A.0.1 mol 丙烯酸中含有的双键数目为 0.1 N A B. 标准状况下 ,2.24 L HF 中含有的共价键数目为 0.1 N A C.6.2 g 白磷分子中含 P—P 键的数目为 0.2 N A D.7.8 g Na 2 O 2 和 Na 2 S 的固体混合物中含有的离子总数为 0.3 N A 答案 : D 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : 丙烯酸分子中含有碳碳双键和碳氧双键 ,1 mol 丙烯酸中含 2 mol 双键 , 即 0.1 mol 丙烯酸中含有双键的数目为 0.2 N A ,A 错误 ; 标准状况下 HF 不是气体 , 不能根据气体摩尔体积来计算其物质的量 ,B 错误 ;6.2 g 白磷 (P 4 ) 物质的量为 0.05 mol, 白磷分子为正四面体结构 , 由 可知 0.05 mol 白磷含有的 P—P 键数为 0.3 N A ,C 错误 ;1 mol Na 2 O 2 和 Na 2 S 均由 2 mol 钠离子和 1 mol 阴离子 ( 或 S 2- ) 构成 , 摩尔质量均为 78 g·mol -1 ,7.8 g 混合物的物质的量为 0.1 mol, 则 0.1 mol 混合物中含有的离子总数为 0.3 N A ,D 正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2019· 四川绵阳第三次诊断 ) 按第 26 届国际计量大会重新定义 , 阿伏加德罗常数 ( N A ) 更精确的数值为 6.022 140 76×10 23 。下列说法正确的是 ( ) A.18 g T 2 O 中含有的中子数为 12 N A B. 用 23.5 g AgI 与水制成的胶体中 , 胶体粒子数目为 0.1 N A C. 标准状况下 ,2.24 L Cl 2 全部溶于水所得溶液中的 Cl - 数目为 0.1 N A D.1 mol 某烷烃 C n H 2 n +2 分子中含有的共价键数为 (3 n +1) N A 答案 : D 题点一 题点二 题点三 真题诊断 必备知识 对点演练 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2019· 山东临沂二模 ) 设 N A 表示阿伏加德罗常数的值。下列叙述正确的是 ( ) A.4.0 g 由 CO 2 和 SO 2 组成的混合物中含有的质子数为 2 N A B.2.24 L Cl 2 与 CH 4 在光照下反应生成的 HCl 分子数为 0.1 N A C. 常温下 ,0.1 mol 环氧乙烷 ( ) 中含有的共价键数为 0.3 N A D.0.1 mol H 2 和 0.1 mol I 2 (g) 于密闭容器中充分反应 , 其原子总数为 0.2 N A 答案 : A 题点一 题点二 题点三 真题诊断 必备知识 对点演练 题点一 题点二 题点三 真题诊断 必备知识 对点演练 化学反应中物质分子数及转移电子数的 判断 1 .(2018· 全国 Ⅰ ,10) N A 是阿伏加德罗常数的值。下列说法正确的是 ( ) A.16.25 g FeCl 3 水解形成的 Fe(OH) 3 胶体粒子数为 0.1 N A B.22.4 L( 标准状况 ) 氩气含有的质子数为 18 N A C.92.0 g 甘油 ( 丙三醇 ) 中含有羟基数为 1.0 N A D.1.0 mol CH 4 与 Cl 2 在光照下反应生成的 CH 3 Cl 分子数为 1.0 N A 答案 : B 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : FeCl 3 的摩尔质量为 162.5 g·mol -1 ,16.25 g FeCl 3 的物质的量为 0.1 mol,FeCl 3 的水解为可逆反应 , 且 Fe(OH) 3 胶粒是若干个 Fe(OH) 3 “ 分子 ” 的集合体 , 所以形成的 Fe(OH) 3 胶体粒子数远小于 0.1 N A ,A 项错误 ; 氩气为单原子分子 , 标准状况下 ,22.4 L 氩气含有 1 mol 氩原子 , 而 1 个氩原子中含有 18 个质子 ,B 项正确 ;92.0 g 甘油的物质的量为 1 mol, 而 1 个甘油分子中含有 3 个 —OH, 则 92.0 g 甘油中含有羟基数为 3.0 N A ,C 项错误 ; 甲烷与氯气反应时 , 会同时生成 CH 3 Cl 、 CH 2 Cl 2 、 CHCl 3 、 CCl 4 及 HCl, 所以 1 mol 甲烷反应生成的 CH 3 Cl 分子数一定小于 1.0 N A ,D 项错误。 审题关键 氢氧化铁胶粒是多个 Fe(OH) 3 “ 分子 ” 形成的聚合体 ;22.4 L·mol -1 的使用条件是标准状况下的气体物质 ; 甲烷与氯气在光照条件下的取代反应是连锁反应 , 生成的氯代烃是四种物质的混合物。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2017· 全国 Ⅱ ,8) 阿伏加德罗常数的值为 N A 。下列说法正确的是 ( ) A.1 L 0.1 mol·L -1 NH 4 Cl 溶液中 , N 的 数量为 0.1 N A B.2.4 g Mg 与 H 2 SO 4 完全反应 , 转移的电子数为 0.1 N A C. 标准状况下 ,2.24 L N 2 和 O 2 的混合气体中分子数为 0.2 N A D.0.1 mol H 2 和 0.1 mol I 2 于密闭容器中充分反应后 , 其分子总数为 0.2 N A 答案 : D 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2016· 全国 Ⅰ ,8) 设 N A 为阿伏加德罗常数值。下列有关叙述正确的是 ( ) A.14 g 乙烯和丙烯混合气体中的氢原子数为 2 N A B.1 mol N 2 与 4 mol H 2 反应生成的 NH 3 分子数为 2 N A C.1 mol Fe 溶于过量硝酸 , 电子转移数为 2 N A D. 标准状况下 ,2.24 L CCl 4 含有的共价键数为 0.4 N A 答案 : A 题点一 题点二 题点三 真题诊断 必备知识 对点演练 反思总结 熟悉常见的可逆反应 , 如合成氨的反应、 SO 2 和 O 2 的反应等 ; 应用 22.4 L·mol -1 进行计算的前提条件是标准状况下的气体 , 注意记忆命题中出现频率较高的标准状况下不是气体的物质 , 如 SO 3 、 HF 、 H 2 O 、 CCl 4 等。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 . 典型氧化还原反应中转移电子的数目 高考常涉及的氧化还原反应有 : (1)Na 2 O 2 与水 ( 或 CO 2 ) 的反应 , 转移电子的物质的量为参加反应的 Na 2 O 2 的物质的量 , 或生成的 O 2 物质的量的 2 倍。 (2)Cl 2 与水 ( 或碱 ) 的反应 , 转移电子的物质的量为参加反应的 Cl 2 的物质的量。 (3) 变价金属铁 ( 或铜 ) 与 Cl 2 、 S 的反应 ,Cl 2 与变价金属反应时均生成高价态金属的氯化物 , 而 S 与变价金属反应时生成的是低价态金属的硫化物。 (4)MnO 2 与浓盐酸反应、 Cu 与浓硫酸反应、 Cu 与浓硝酸反应 , 均需要考虑酸浓度的降低对反应的影响 , 从而正确判断转移电子的数目。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 . 阿伏加德罗常数正误判断的思维导 图 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 .(2019· 广东揭阳二模 ) 设 N A 为阿伏加德罗常数的值。下列说法正确的是 ( ) A.2.3 g 钠在足量的氧气中燃烧 , 转移的电子数为 0.1 N A B. 标准状况下 ,2.24 L Cl 2 溶于水或 NaOH 溶液中转移的电子数均为 0.1 N A C.1 mol 金刚石含有的碳原子数为 N A D.0.1 mol CH 3 OH 中所含 C—H 键的数目为 0.4 N A 答案 : A 题点一 题点二 题点三 真题诊断 必备知识 对点演练 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2019· 四川成都第七中学三模 ) 设 N A 代表阿伏加德罗常数的值。下列说法正确的是 ( ) A. 标准状况下 ,22.4 L 己烯中含有碳氢键的数目为 12 N A B.5.6 g Fe 与足量盐酸完全反应 , 失去电子数目为 0.2 N A C.0.1 mol N 2 与 0.3 mol H 2 充分反应 , 生成 NH 3 的分子数目为 0.2 N A D. 电解精炼铜时阳极减轻 32 g, 电路中转移电子数目一定为 N A 答案 : B 解析 : 标准状况下 , 己烯不是气体 , 不能根据气体摩尔体积计算其物质的量 ,A 错误 ;5.6 g Fe 为 0.1 mol, 与足量盐酸完全反应生成 Fe 2+ , 失去电子数目为 0.2 N A ,B 正确 ;N 2 与 H 2 的反应是一个可逆反应 ,0.1 mol N 2 与 0.3 mol H 2 充分反应 , 生成 NH 3 的分子数目小于 0.2 N A ,C 错误 ; 粗铜中含有杂质铁、锌等 , 铁、锌先于铜失去电子 , 故阳极减轻 32 g 时 , 电路中转移电子数目不一定为 N A ,D 错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2019· 山东聊城二模 ) 设 N A 为阿伏加德罗常数的值。下列叙述中正确的是 ( ) A. 等物质的量的 Na 2 O 和 Na 2 O 2 中所含阴离子数均为 N A B. 电解精炼铜时 , 若阳极质量减少 6.4 g, 则阴极一定增重 6.4 g C.4.6 g C 2 H 6 O 的分子中含有 C—H 键数目一定为 0.5 N A D.1 mol Mg 在空气中完全燃烧生成 MgO 和 Mg 3 N 2 , 转移电子数为 2 N A 答案 : D 解析 : 没有告诉 Na 2 O 和 Na 2 O 2 的物质的量 , 无法计算含有的阴离子数目 ,A 错误 ; 电解过程中 , 活泼性较强的杂质铁、锌等金属先于铜放电 , 则阳极减少 6.4 g 时 , 阴极不一定生成 6.4 g Cu,B 错误 ;4.6 g C 2 H 6 O 的物质的量为 0.1 mol, 若为乙醇则含 0.5 N A 个 C—H 键 , 若为二甲醚则含 0.6 N A 个 C—H 键 ,C 错误 ;1 mol Mg 在空气中完全燃烧生成 MgO 和 Mg 3 N 2 , 镁元素由 0 价升高到 +2 价 ,1 mol Mg 失 2 mol 电子 , 失电子数目为 2 N A ,D 正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 涉及反应进行程度的粒子数目的 判断 1 . N A 表示阿伏加德罗常数的值。下列说法正确的是 ( ) A. 密闭容器中 ,2 mol SO 2 和 1 mol O 2 催化反应后分子总数为 2 N A (2018· 全国 Ⅱ ,11D) B.1.0 mol CH 4 与 Cl 2 在光照下反应生成的 CH 3 Cl 分子数为 1.0 N A (2018· 全国 Ⅰ ,10D) C. 密闭容器中 2 mol NO 与 1 mol O 2 充分反应后 , 产物分子数为 2 N A (2015· 全国 Ⅰ ,8D) D.1 mol K 2 Cr 2 O 7 被还原为 Cr 3+ 转移的电子数为 6 N A (2019· 全国 Ⅱ ,8C) 答案 : D 题点一 题点二 题点三 真题诊断 必备知识 对点演练 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 . 设 N A 是阿伏加德罗常数的值。下列说法正确的是 ( ) A.16.25 g FeCl 3 水解形成的 Fe(OH) 3 胶体粒子数为 0.1 N A (2018· 全国 Ⅰ ,10A) B.100 mL 1 mol·L -1 FeCl 3 溶液中所含 Fe 3+ 的数目为 0.1 N A (2018· 全国 Ⅱ ,11B) C.pH=1 的 H 3 PO 4 溶液中 , 含有 0.1 N A 个 H + (2017· 全国 Ⅲ ,10B) D.0.1 mol H 2 和 0.1 mol I 2 于密闭容器中充分反应后 , 其分子总数为 0.2 N A (2017· 全国 Ⅱ ,8D) 答案 : D 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : 16.25 g FeCl 3 为 0.1 mol, 而 Fe(OH) 3 胶体粒子是若干 Fe(OH) 3 “ 分子 ” 的集合体 ,A 项错误 ,Fe 3+ 在水溶液中发生水解 ,100 mL 0.1 mol·L -1 FeCl 3 溶液中的 Fe 3+ 数目小于 0.1 N A ,B 项错误 ;pH=1 的 H 3 PO 4 溶液体积未知 , 无法计算 H + 的个数 ,C 项错误 ; H 2 +I 2 2HI 是分子数不变的反应 ,D 项正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 . 电离、水解对溶液中离子数目的影响 因 忽视溶液中某些离子的水解或弱电解质的电离而造成错误。如 1 L 1 mol·L -1 的 CH 3 COOH 溶液中 , 由于 CH 3 COOH 为弱酸 , 故溶液中 CH 3 COO - 的物质的量小于 1 mol;1 L 1 mol·L -1 的 Na 2 CO 3 2 . 隐含可逆反应和特殊的 化学反应 HCl+HClO, 合成氨反应等。 (2)MnO 2 与浓盐酸共热的反应 ,Al 、 Fe 常温下在浓硫酸、浓硝酸中钝化 , 浓硫酸与铜共热的反应等。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 . 解答有关阿伏加德罗常数类题目的三个步骤 (1) 看 : 看所给数据是体积、质量还是物质的量。如果所给数据是质量或物质的量 , 该类数据不受外界条件的影响。 (2) 定 : 确定对象是气体、固体还是液体。如果是气体 , 要注意外界条件是否为 “ 标准状况 ” 。 (3) 算 : 根据所求内容进行计算 , 在求算时要注意 : ① 不要直接利用溶液的浓度代替指定物质的物质的量进行计算。 ② 同种物质在不同氧化还原反应中的 “ 角色 ” 可能不同 , 电子转移数目也可能不同 , 不能一概而论。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 .(2019· 山东青岛二模 ) 用 N A 表示阿伏加德罗常数的值。下列叙述正确的是 ( ) B.25 g 胆矾溶于水形成 1 L 溶液 , 所得溶液中 Cu 2+ 数目为 0.1 N A C.1 L 0.1 mol·L -1 NH 4 NO 3 溶液中的氮原子数为 0.2 N A D . 常温下 ,1 L pH=7 的 1 mol·L -1 CH 3 COONH 4 溶液中 ,CH 3 COO - 答案 : C 题点一 题点二 题点三 真题诊断 必备知识 对点演练 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 . 设 N A 为阿伏加德罗常数的值 , 下列说法正确的是 ( ) A. 某温度下 ,1 L pH=2 的 H 2 SO 4 溶液中 , 硫酸和水电离的 H + 总数为 0.01 N A B.25 ℃ 时 ,1.0 L pH=13 的 Ba(OH) 2 溶液中含有的 OH - 数目为 0.2 N A C.pH=11 的 Ca(OH) 2 溶液中 OH - 离子数为 0.002 N A D.1 L pH=6 的纯水中含有 OH - 数目为 10 -8 N A 答案 : A 解析 : 某温度下 ,1 L pH=2 的 H 2 SO 4 溶液中 H + 总数为 0.01 N A ,H + 是由硫酸和水电离出来的 ,A 正确 ;25 ℃ 时 ,1.0 L pH=13 的 Ba(OH) 2 溶液中 OH - 浓度为 0.1 mol·L -1 , 含有的 OH - 数目为 0.1 N A ,B 错误 ; 没有给定溶液体积 , 无法计算离子数目 ,C 错误 ;pH=6 的纯水中 c (H + )= c (OH - )=10 -6 mol·L -1 ,1 L pH=6 的纯水中含有 OH - 的数目为 10 -6 N A ,D 错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 . 设 N A 为阿伏加德罗常数的值 , 下列说法正确的是 ( ) A. 某温度下纯水的 pH=6, 该温度下 10 L pH=11 的 NaOH 溶液中含 OH - 的数目为 N A 答案 : A 题点一 题点二 题点三 真题诊断 必备知识 对点演练查看更多