- 2022-06-13 发布 |
- 37.5 KB |
- 51页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【创新设计】高考化学二轮复习简易通知能提升课件:第2讲 化学常用计量 (高考命题视角+考场失分防范+学科素养提升)
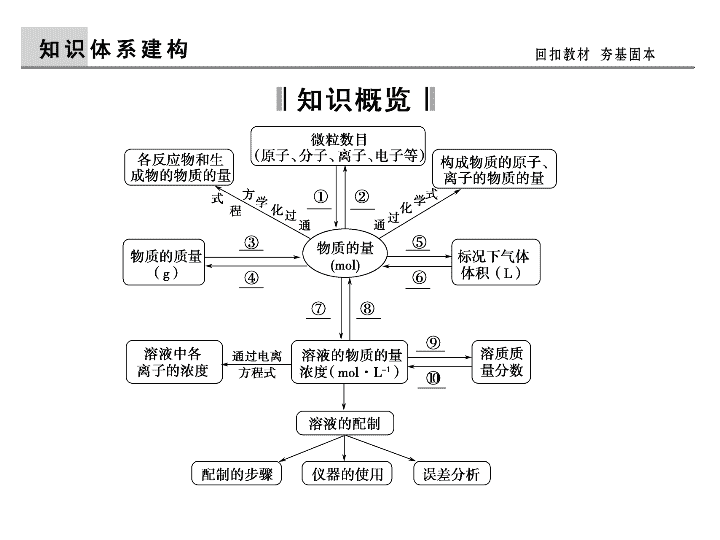
第2讲 化学常用计量\n【考纲点击】1.了解物质的量、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。2.根据物质的量与微粒(原子、分子、离子等)数目、物质质量、气体体积(标准状况下)之间的相互关系进行有关计算。3.了解溶液的含义。了解溶解度、饱和溶液的概念。4.理解溶液中质量分数、物质的量浓度的概念,并能进行有关计算。5.掌握一定溶质质量分数、物质的量浓度溶液的配制方法。\n\n\n1.阿伏加德罗常数的研究对象是什么?通过什么与宏观的量联系?\n2.有关溶液的物质的量浓度的计算中应注意什么?答案 溶液的物质的量浓度的计算中应注意:求谁的浓度就用谁的物质的量除以溶液的体积;溶质可以是分子、离子或其他特定组合等,溶液的体积而非溶剂水的体积。\n3.定容时俯视、仰视对所配制溶液的浓度有何影响?答案 如图1所示,俯视刻度线,导致溶液体积偏小,溶液浓度偏大;如图2所示,仰视刻度线,导致溶液体积偏大,溶液浓度偏小。\n知识链接气体摩尔体积是一定的温度和压强下,单位物质的量的气体所占的体积,标准状况下,气体摩尔体积约为22.4L·mol-1,气体可以是单一气体也可以是混合气体。若题中出现物质的体积,需要考虑所给物质的状态是否是气体,条件是否是标准状况。在标准状况下的非气态物质有:H2O、SO3、己烷、苯、CHCl3、CCl4等。考点一 阿伏加德罗常数的综合应用角度1气体摩尔体积的使用条件(2013·广东,9C)\n知识链接注意物质的微观结构:①注意某些物质分子中的原子个数,如Ne、O3、P4等;②特殊物质的摩尔质量,如D2O、T2O、18O2、H37Cl等;③一些物质中的化学键数目,如SiO2、Si、金刚石、CH4、P4、CO2、烃分子中碳碳键数等;④一些根或官能团所含有的电子数,1mol—OH含有9NA,1molOH-含有10NA;⑤Fe(OH)3胶体中的胶体粒子数目;⑥水溶液中H、O原子数。角度2物质的微观结构(2013·江苏,7B、C)\n知识链接复杂氧化还原反应中,转移的电子数的求算,如Na2O2、NO2与H2O的反应,Na2O2与CO2的反应,Cl2与H2O、NaOH、Fe的反应,Fe、Cu与S、硝酸的反应,电解AgNO3溶液等。角度3氧化还原反应中的电子转移数目(2013·广东,9D)\n角度4电解质溶液中离子数目(2013·江苏,7A)\n1.(2013·江苏,7)设NA为阿伏加德罗常数的值,下列说法正确的是()。A.1L1mol·L-1的NaClO溶液中含有ClO-的数目为NAB.78g苯含有C==C双键的数目为3NAC.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NAD.标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA[高考印证]\n解析A项,由于ClO-水解,ClO-数目小于NA,错误;B项,苯分子中无C==C,错误;C项,N2和CO的摩尔质量均为28g·mol-1,均为双原子分子,14g混合气体的物质的量为0.5mol,原子数为NA,正确;D项,由反应3NO2+H2O===2HNO3+NO可知,3molNO2参加反应转移电子数为2NA,则0.3molNO2参加反应,转移电子数目为0.2NA,错误。答案C\n1.(2013·浙江绍兴鲁迅中学高三期中,5)下列叙述中完全正确的一组是()。①常温常压下,1mol甲基(—CH3)所含的电子数为10NA②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路中通过电子0.2NA③5.6g铁粉与硝酸反应失去的电子数一定是0.3NA④常温常压下,16gO2和O3的混合物中所含的原子数为NA[应用体验]\n⑤1molC10H22分子中共价键总数为31NA⑥1molCl2发生反应时,转移的电子数一定是2NA⑦标准状况下,22.4L水中含分子数为NAA.②③④B.②③⑥⑦C.①②④⑤D.②④⑤\n解析1mol甲基所含的电子数为9NA,①错。5.6g铁粉与硝酸反应时,若Fe只被氧化为Fe3+,失去的电子数为0.3NA;若Fe只被氧化为Fe2+,失去的电子数为0.2NA;若Fe被氧化为Fe3+、Fe2+,失去的电子数在0.2NA~0.3NA之间,③错。1个C10H22分子中含9个C—C键、22个C—H键,共价键总数为31,⑤正确。1molCl2与NaOH溶液发生反应时,转移的电子数是NA,⑥错。标准状况下,水不是气体,22.4L水不是1mol,其所含的分子数远大于NA,⑦错。答案D\n考点二 以物质的量为中心的有关计算角度1物质的量、物质的质量、微粒数的关系[2013·浙江,28(5)]\n知识链接物质的量(n)与标准状况气体体积(V)的关系:V=22.4L·mol-1·n。注意:在应用Vm=22.4L·mol-1时,一定注意是“标准状况”和“气体状态”两个前提条件(混合气体也适用)。角度2物质的量与标准标况下气体体积的关系(2013·四川,7C)\n角度3溶液中溶质的物质的量与溶液物质的量浓度的关系[2013·浙江,28(5)]\n2.(2013·四川理综,7)1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是()。A.该合金中铜与镁的物质的量之比是2∶1B.该浓硝酸中HNO3的物质的量浓度是14.0mol/LC.NO2和N2O4的混合气体中,NO2的体积分数是80%D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL[高考印证]\n\n\n答案D\n2.(2013·嘉兴统考)标准状况下,将aLSO2和Cl2组成的混合气体通入100mL0.1mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65g。则下列关于该过程的推断不正确的是()。A.所得沉淀为0.05mol的BaSO4B.混合气体中SO2的体积为0.448LC.aL混合气体的物质的量为0.04molD.a的取值范围为0.672<a<0.896[应用体验]\n解析 沉淀是硫酸钡,其物质的量是0.05mol,所以硫酸根离子的物质的量是0.05mol;硫酸铁溶液中硫酸根离子的物质的量是0.03mol,所以二氧化硫和氯气生成的硫酸根离子的物质的量是0.02mol,则SO2的体积标准状况下为0.448L,由于溶液棕黄色变浅,说明Fe3+也氧化了SO2,因此不能计算气体的物质的量,故C错误;极值法计算a的取值范围,若0.02molSO2全部被Cl2氧化,Cl2的物质的量为0.02mol,若0.02molFe3+全部氧化了SO2,则Cl2的物质的量为0.01mol,因此a的取值范围为0.672<a<0.896。答案C\n考点三 物质的量浓度的计算及溶液配制角度1由溶液的质量分数计算物质的量浓度(2013·江苏,6C)\n知识链接(1)溶液的稀释:①“溶质的物质的量”守恒:c1·V1=c2·V2;②“溶质的质量”守恒:V1·ρ1·w1=V2·ρ2·w2。(2)溶液的混合:①混合后溶液体积不变:c1V1+c2V2=c(混)(V1+V2);②混合后溶液体积改变:c1V1+c2V2=c(混)V(混)。注意:溶液稀释(混合)后的体积一般不可直接相加,需用V(混)=m(混)/ρ(混)。角度2溶液的稀释与混合(2012·浙江,12A)\n角度发散常以两种同溶质溶液等质量、等体积混合时质量分数的判定、质量分数与密度的关系为命题角度。\n知识链接(1)配制步骤:计算(固体质量或浓溶液体积)→称量(托盘天平称或量筒量)→溶解(烧杯、玻璃棒)→移液(冷至室温,用容量瓶和玻璃棒)→洗涤→定容(胶头滴管)→摇匀。(2)误差分析角度3溶液的配制及误差分析(2013·江苏,5)\n角度发散仪器的选择和定量仪器的读数也是常见的命题点。\n3.(高考题汇编)下列有关叙述正确的是()。A.配制0.1000mol·L-1NaCl溶液时,将液体转移到容量瓶中需用玻璃棒引流。(2013·福建,10C)B.用固体NaCl配制0.5mol·L-1的溶液,用到烧杯、玻璃棒、胶头滴管、容量瓶(2013·山东,11C)C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小(2013·天津理综,4B)D.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%(2008·山东,12A)[高考印证]\n答案A\n3.(2013·嘉兴市高中学科基础测试)某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体自己配制480mL含NaClO25%,密度为1.19g·cm-3的消毒液。下列说法正确的是()。A.配制过程只需要三种仪器即可完成B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小D.需要称量的NaClO固体的质量为142.8g[应用体验]\n解析 配制过程中需要用到天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管等,A项错误;容量瓶用蒸馏水洗净后不需要烘干,B项错误;需要称量的NaClO固体的质量为500mL×1.19g·cm-3×25%=148.75g,D项错误。答案C\n知识链接在解答有关NA的正误判断问题时,若涉及到物质体积要注意看是否为标准状况和物质的状态是否为气态;求算电解质溶液中的粒子数目时,特别要注意电解质是否是弱电解质,有时还要注意是否有能水解的离子等。防范1忽视物质的状态或电解质的强弱\n[防范演练]\n解析B项,水是非气体,气体摩尔体积对其不适用,错;C项,醋酸是弱酸,只有部分电离,错。D项,没有外界条件,无法计算气体的物质的量及氮原子个数,错。答案A\n知识链接(1)同种物质在不同的反应中其“角色”可能不同,电子转移数目也可能不同,不能一概而论,如1molCl2分别与Fe、NaOH溶液、H2O反应时转移的电子数就不一样。(2)电子转移的数目根据不足者计算,如1molFe和1molCl2充分反应,电子转移2mol而不是3mol。防范2忽视氧化还原反应的本质及反应物“量”的问题\n2.NA为阿伏加德罗常数的数值。下列有关说法中,正确的是()。A.常温常压下,1molCl2分别和足量NaOH溶液、Fe充分反应,电子转移都为2NAB.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去NA个电子C.铝与NaOH溶液反应生成1molH2转移的电子数为3NAD.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA[防范演练]\n解析A项,1molCl2分别和足量NaOH溶液、Fe反应转移电子数分别为NA、2NA,错;B项,1molNa无论生成Na2O还是Na2O2,Na的化合价均是由0价升高到+1价,1molNa失去NA个电子,正确;C项,生成1molH2转移电子数为2NA,错误;D项,Cl2的物质的量小于1.5mol,Al没有完全反应,转移电子数小于3NA,错误。答案B\n防范3对配制溶液的误差分析不当\n[防范演练]3.下列有关说法正确的是()。A.配制NaOH溶液时称量的NaOH已经潮解会造成浓度偏高B.定容时未将洗涤烧杯、玻璃棒的洗液转移至容量瓶,结果使浓度偏高C.配制溶液时,若加水超过容量瓶刻度线,应用胶头滴管将多余溶液吸出D.配制1mol·L-1Na2CO3溶液时,定容时仰视刻度线,会造成浓度小于1mol·L-1的结果\n解析NaOH已经潮解及未将洗涤烧杯、玻璃棒的洗液转移至容量瓶,使溶质的物质的量偏小,浓度偏低,A、B错;配制溶液时,若加水超过容量瓶刻度,应重新配制,C错;定容时仰视刻度线,会使溶液的体积变大、浓度偏低,D项正确。答案D\n“物质的量”在化学计算中的应用\n一、“物质的量”在有关NA正误判断中的应用“阿伏加德罗常数”是“物质的量”的基准,能够计算所有的微观粒子。关于阿伏加德罗常数的判断题,解答时,一是要正确求算给定物质的物质的量;二是熟练识别此类题目常见的干扰因素,如涉及气体体积时要特别注意物质的状态和条件,理清NA表示的粒子与所给物质的关系(物质组成)、氧化还原反应中电子转移、注意弱电解质的电离与水解、一些特殊的变化(如可逆反应)、胶体的微粒数等。\n二、“物质的量”在化学方程式计算中的应用“物质的量”在化学方程式计算中的应用,要注意:(1)化学计量数之比=反应中各物质的粒子数之比=反应中各物质的物质的量之比=反应中各气态物质的体积之比(同温同压)。(2)物质的量在化学方程式计算中关键是找出已知量和未知量(可以是物质的量、质量、体积等),把已知和未知量分别写在化学方程式中有关化学式的下面。(3)若在同一题目中的两个量单位不一致,要做到两个量及其单位“上下一致、左右对应”。(4)在计算过程中,注意使用差量法、关系式法、守恒法、极值法等。\n[应用体验]\n\n\n\n查看更多