2018届一轮复习人教版原子结构与性质学案(4)
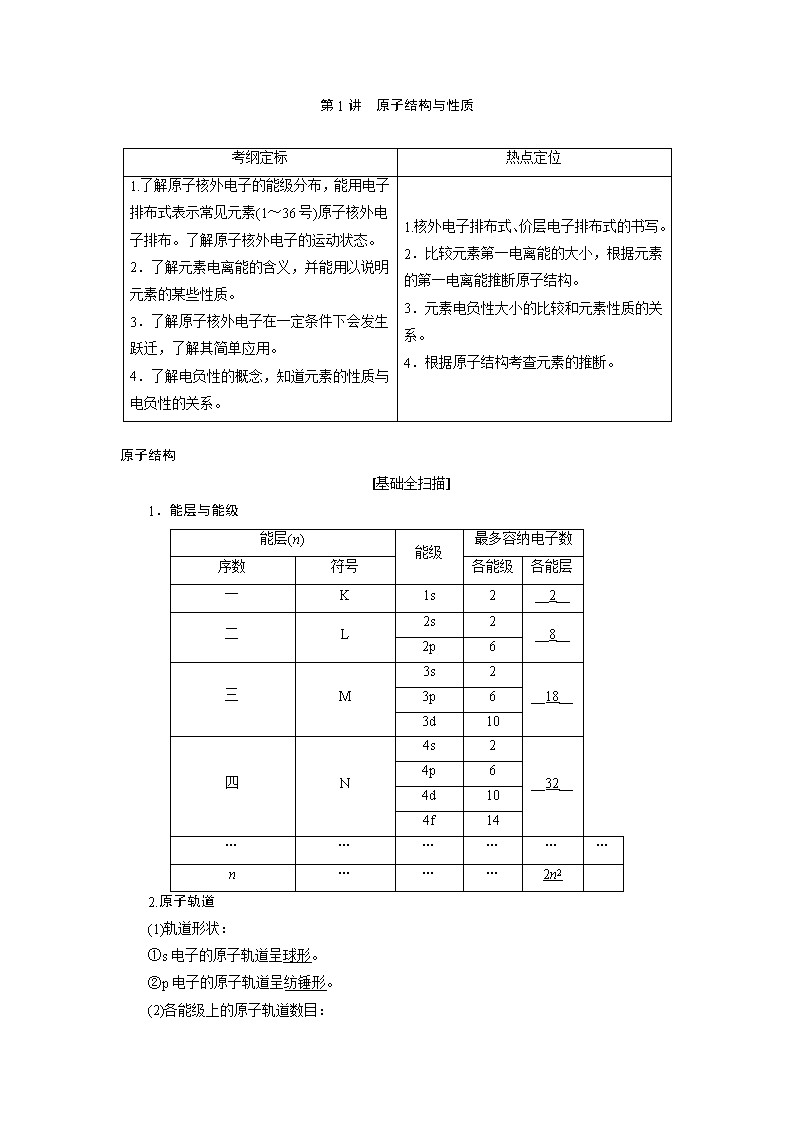
第1讲原子结构与性质考纲定标热点定位1.了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子排布。了解原子核外电子的运动状态。2.了解元素电离能的含义,并能用以说明元素的某些性质。3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。4.了解电负性的概念,知道元素的性质与电负性的关系。1.核外电子排布式、价层电子排布式的书写。2.比较元素第一电离能的大小,根据元素的第一电离能推断原子结构。3.元素电负性大小的比较和元素性质的关系。4.根据原子结构考查元素的推断。原子结构[基础全扫描]1.能层与能级能层(n)能级最多容纳电子数序数符号各能级各能层一K1s2__2__二L2s2__8__2p6三M3s2__18__3p63d10四N4s2__32__4p64d104f14………………n………2n22.原子轨道(1)轨道形状:①s电子的原子轨道呈球形。②p电子的原子轨道呈纺锤形。(2)各能级上的原子轨道数目:\n能级nsnpndnf原子轨道数1357(3)能量关系:①相同能层上原子轨道能量的高低:ns
Al,P>S。[练习点点清]3.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5则下列有关比较中正确的是( )A.第一电离能:④>③>②>①B.原子半径:④>③>②>①C.电负性:④>③>②>①D.最高正化合价④>③=②>①解析:选A ①~④四种元素分别为S、P、N、F,第一电离能F>N>P>S,A项正确。原子半径P>S>N>F,B项错误。电负性F>N>S>P,C项错误。F无正化合价,N、S、P最高正化合价分别为+5、+6、+5价,D项错误。[考点一 基态原子核外电子排布的表示方法]1.核外电子排布规律(1)遵守能量最低原理、泡利原理、洪特规则。(2)能级交错现象:核外电子的能量并不是完全按能层序数的增加而升高,不同能层的能级之间的能量高低有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。(3)当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。如24Cr的基态原子电子排布式为:1s22s22p63s23p63d54s1,而不是:1s22s22p63s23p63d44s2。2.表示方法(1)电子排布式:按电子排入各电子层中各能级的先后顺序,用能级符号依次写出各能级中的电子数,同时注意特例。如:Cu:1s22s22p63s23p63d104s1。\n(2)简化电子排布式:“[稀有气体]+价层电子”的形式表示。如:Cu:[Ar]3d104s1。(3)电子排布图(轨道表示式):用方框表示原子轨道,用“↑”或“↓”表示自旋方向不同的电子,按排入各电子层中各能级的先后顺序和在轨道中的排布情况书写。如:S:[例1] (1)①可正确表示原子轨道的是________。A.2s B.2dC.3pxD.3f②写出基态镓(Ga)原子的电子排布式:________。(2)基态Mn2+的核外电子排布式为________。(3)铜原子基态电子排布式为___________________________________;(4)基态氮原子的价电子排布式是____________。[解析] (1)①电子层数为2的能级包括s、p;电子层数为3的能级包括s、p、d;②镓(Ga)的原子序数为31,电子分布的能级为1s、2s、2p、3s、3p、3d、4s、4p。(2)Mn是25号元素,其电子排布式为[Ar]3d54s2,失去最外层的2个电子,即得Mn2+∶[Ar]3d5。(3)Cu是29号元素,其电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,(4)氮原子的最外层有5个电子,其价电子排布式为2s22p3。[答案] (1)①A、C ②1s22s22p63s23p63d104s24p1(2)1s22s22p63s23p63d5或[Ar]3d5(3)1s22s22p63s23p63d104s1 (4)2s22p31.下列说法错误的是( )A.ns电子的能量不一定高于(n-1)p电子的能量B.6C的电子排布式1s22s22p违反了洪特规则C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理解析:选A A项,关键在于熟记构造原理,各能级能量的大小顺序为1s2s2p3s3p4s3d4p5s……ns电子的能量一定高于(n-1)p电子的能量;B项,对于C原子来说,2p能级有3个能量相同的原子轨道,最后2个电子应该以自旋状态相同的方式分布在两个不同的2p轨道上,违反了洪特规则;C项,根据轨道能量高低顺序可知E4sAl。B.锗的第一电离能高于碳而电负性低于碳C.Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳D.元素的第一电离能:Al
查看更多