- 2022-06-13 发布 |
- 37.5 KB |
- 4页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届云南省曲靖市沾益县第一中学高二上学期第二次质量检测(2016
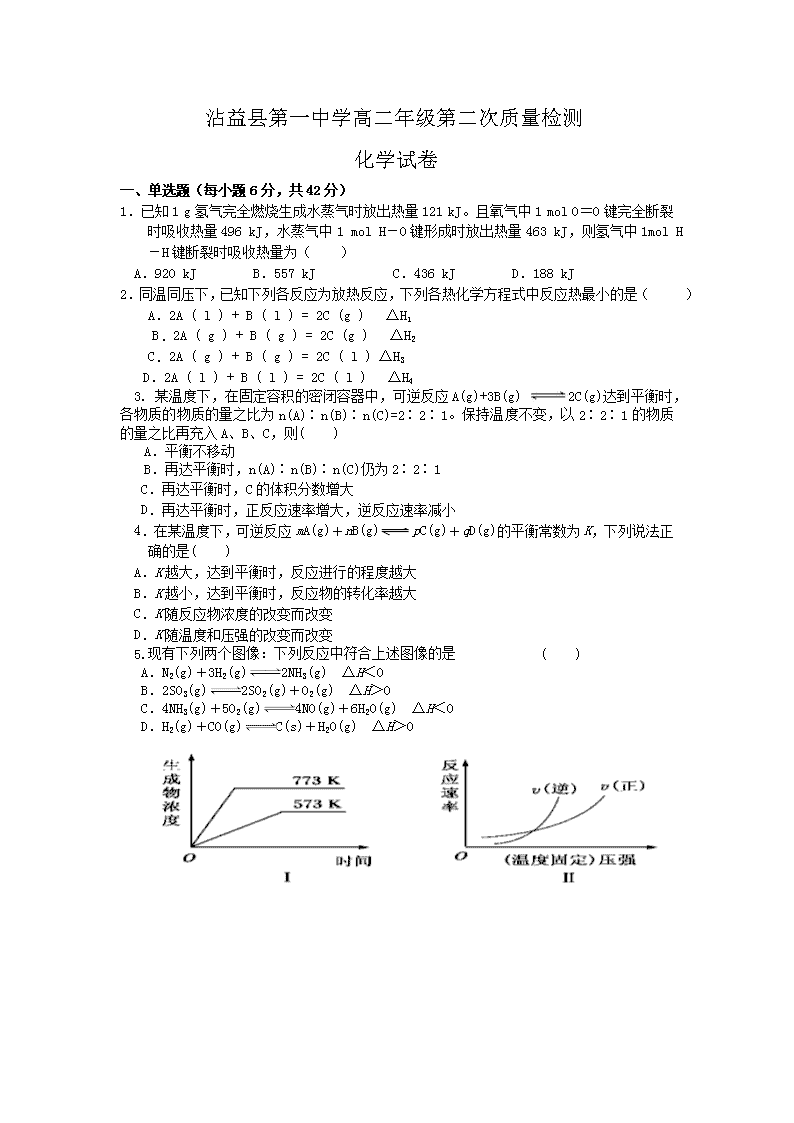
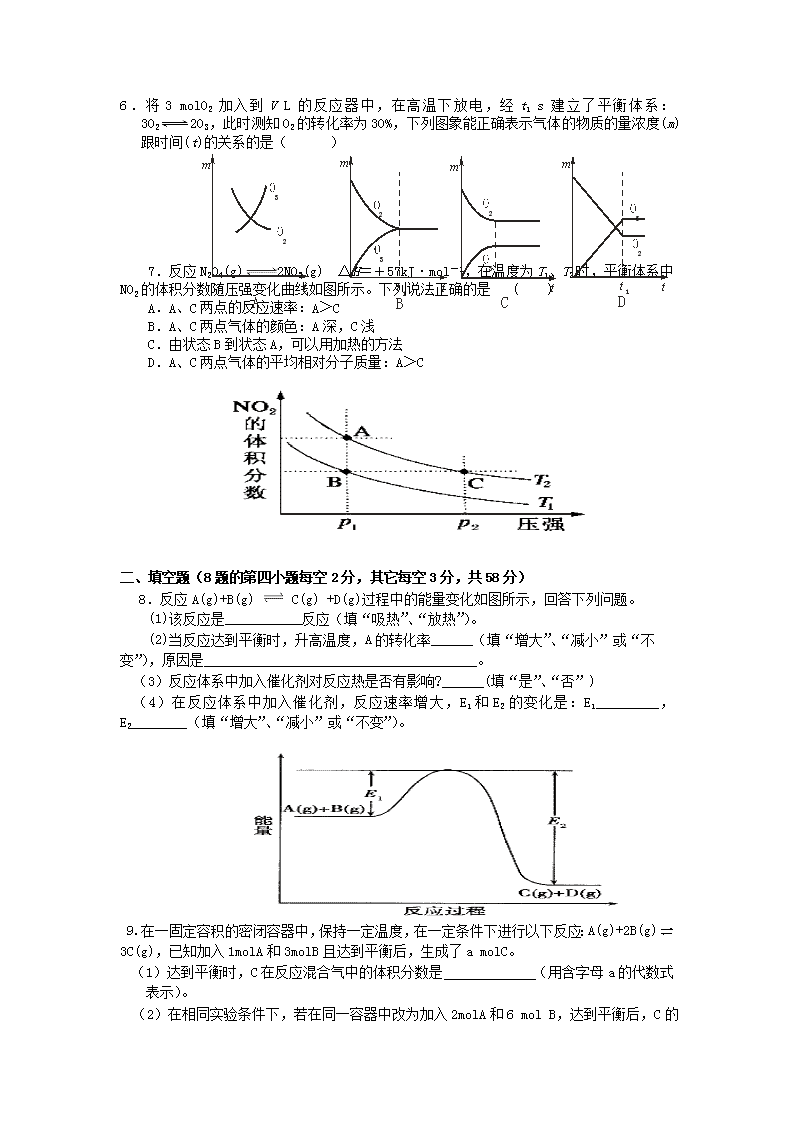
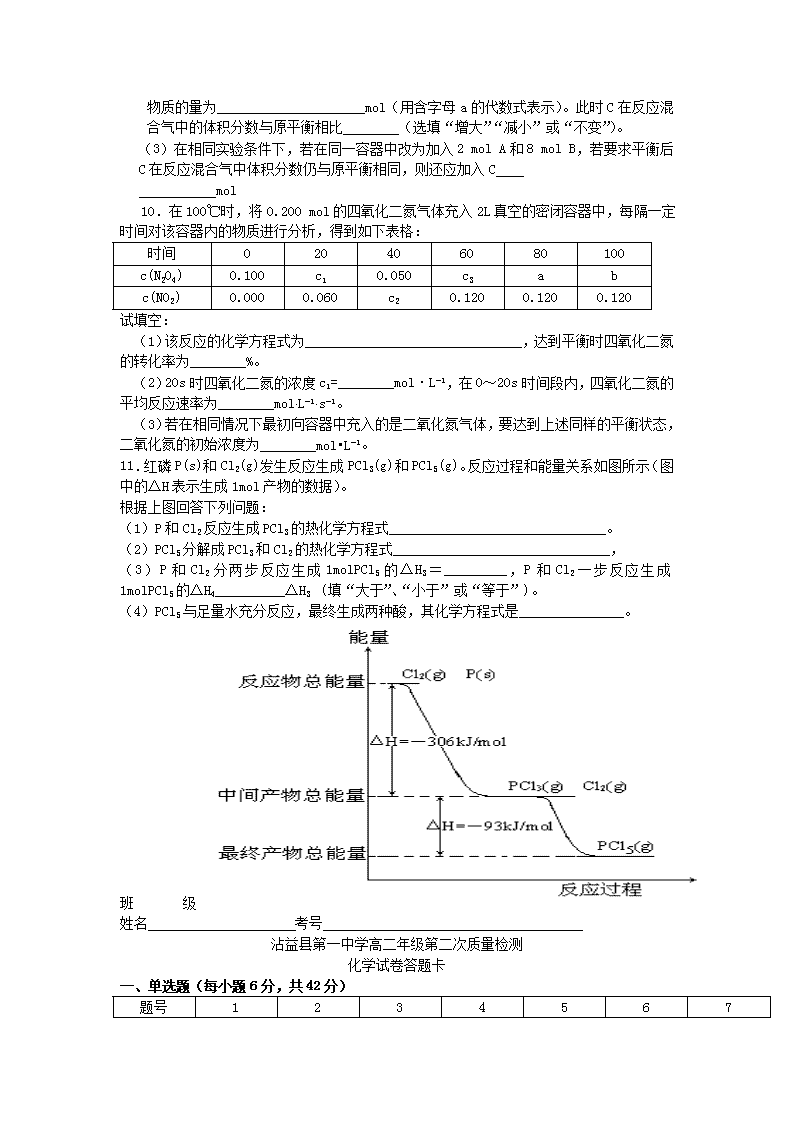
沾益县第一中学高二年级第二次质量检测化学试卷一、单选题(每小题6分,共42分)1.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为()A.920kJB.557kJC.436kJD.188kJ2.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是()A.2A(l)+B(l)=2C(g)△H1B.2A(g)+B(g)=2C(g)△H2C.2A(g)+B(g)=2C(l)△H3D.2A(l)+B(l)=2C(l)△H43.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则()A.平衡不移动B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1C.再达平衡时,C的体积分数增大D.再达平衡时,正反应速率增大,逆反应速率减小4.在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )A.K越大,达到平衡时,反应进行的程度越大B.K越小,达到平衡时,反应物的转化率越大C.K随反应物浓度的改变而改变D.K随温度和压强的改变而改变5.现有下列两个图像:下列反应中符合上述图像的是( )A.N2(g)+3H2(g)2NH3(g) ΔH<0B.2SO3(g)2SO2(g)+O2(g) ΔH>0C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0D.H2(g)+CO(g)C(s)+H2O(g) ΔH>0\n6.将3molO2加入到VL的反应器中,在高温下放电,经t1s建立了平衡体系:3O22O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是()A23mtD23mtt1B23mtt1C23mt7.反应N2O4(g)2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )A.A、C两点的反应速率:A>CB.A、C两点气体的颜色:A深,C浅C.由状态B到状态A,可以用加热的方法D.A、C两点气体的平均相对分子质量:A>C二、填空题(8题的第四小题每空2分,其它每空3分,共58分)8.反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题。(1)该反应是___________反应(填“吸热”、“放热”)。(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),原因是_______________________________________。(3)反应体系中加入催化剂对反应热是否有影响?______(填“是”、“否”)(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。9.在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)3C(g),已知加入1molA和3molB且达到平衡后,生成了amolC。 (1)达到平衡时,C在反应混合气中的体积分数是(用含字母a的代数式表示)。(2)在相同实验条件下,若在同一容器中改为加入2molA和6molB,达到平衡后,C\n的物质的量为mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比(选填“增大”“减小”或“不变”)。(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入Cmol10.在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:时间020406080100c(N2O4)0.100c10.050c3abc(NO2)0.0000.060c20.1200.1200.120试填空:(1)该反应的化学方程式为_______________________________,达到平衡时四氧化二氮的转化率为________%。(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol×L-1×s-1。(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。11.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式_______________________________。(2)PCl5分解成PCl3和Cl2的热化学方程式_______________________________,(3)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4__________△H3(填“大于”、“小于”或“等于”)。(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_______________。班级姓名考号沾益县第一中学高二年级第二次质量检测化学试卷答题卡一、单选题(每小题6分,共42分)题号1234567\n答案二、填空题(8题的第四小题每空2分,其它每空3分,共58分)8题:(1)(2)A的转化率原因是。(3)_________(4)E1,E29题:(1)(2)mol、。(3)mol10题:(1),________%。(2)c1=mol·L-1,mol×L-1×s-1。(3)mol•L-1。11题:(1)。(2),(3)△H3=_________,△H4__________△H3(4)。查看更多