- 2021-07-02 发布 |
- 37.5 KB |
- 17页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省泸州市泸县第二中学2020届高三上学期开学考试理综-化学试题
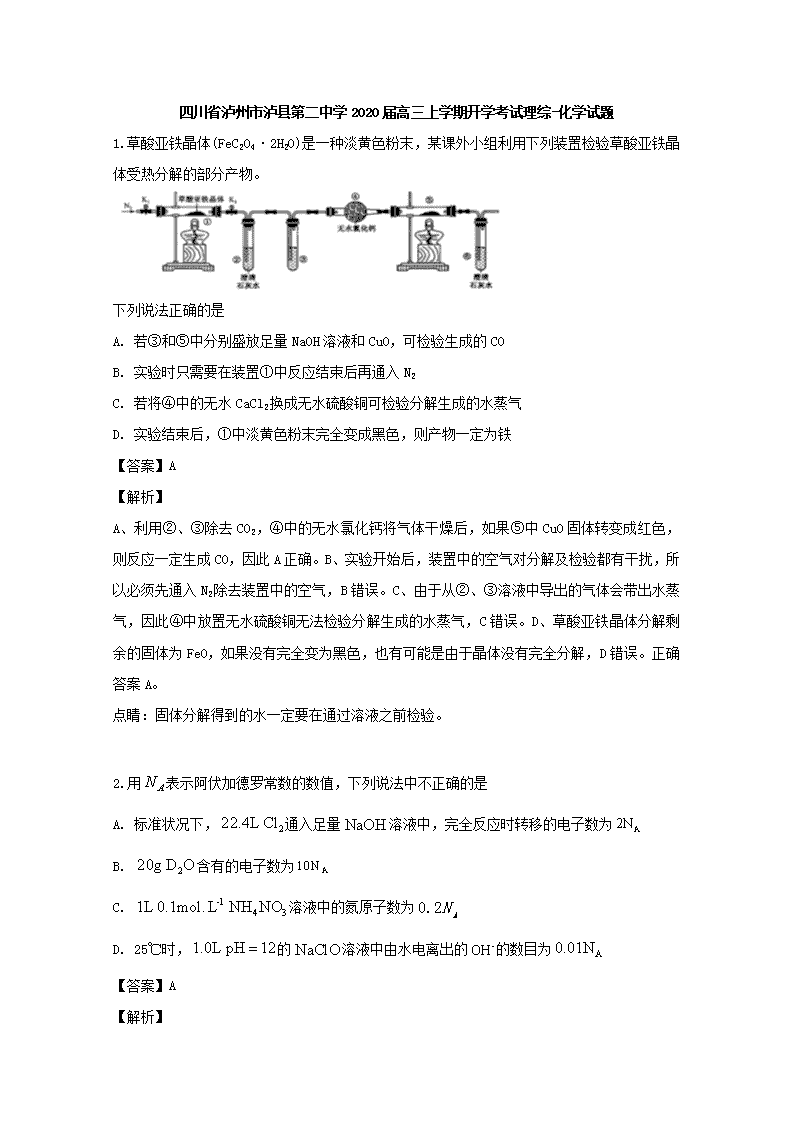
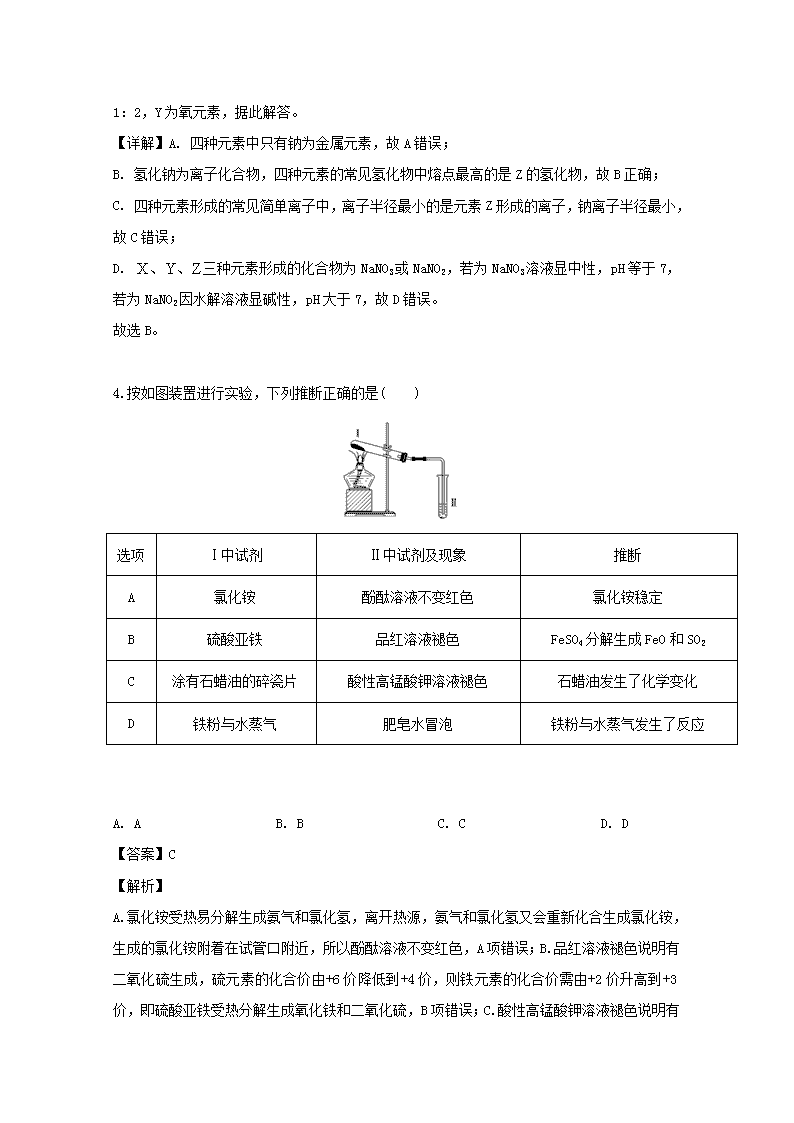
四川省泸州市泸县第二中学2020届高三上学期开学考试理综-化学试题 1.草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。 下列说法正确的是 A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO B. 实验时只需要在装置①中反应结束后再通入N2 C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气 D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁 【答案】A 【解析】 A、利用②、③除去CO2,④中的无水氯化钙将气体干燥后,如果⑤中CuO固体转变成红色,则反应一定生成CO,因此A正确。B、实验开始后,装置中的空气对分解及检验都有干扰,所以必须先通入N2除去装置中的空气,B错误。C、由于从②、③溶液中导出的气体会带出水蒸气,因此④中放置无水硫酸铜无法检验分解生成的水蒸气,C错误。D、草酸亚铁晶体分解剩余的固体为FeO,如果没有完全变为黑色,也有可能是由于晶体没有完全分解,D错误。正确答案A。 点睛:固体分解得到的水一定要在通过溶液之前检验。 2.用表示阿伏加德罗常数的数值,下列说法中不正确的是 A. 标准状况下,通入足量溶液中,完全反应时转移的电子数为 B. 含有的电子数为 C. 溶液中的氮原子数为 D. 25℃时,的溶液中由水电离出的的数目为 【答案】A 【解析】 【详解】A. 由反应式Cl2+2NaOH=NaCl+NaClO+H2O可知,1molCl2参加反应转移1mol电子,转移的电子数为NA,故A错误; B. 20 g重水(D 2O)的物质的量为1 mol,D 2O又是10电子微粒,故其含有的电子数为10NA,故B正确; C. 溶液中含NH4NO3物质的量为0.1mol/L1L=0.1mol,所以含氮原子数为0.2N A,故C正确; D. 25℃时,pH=12的1.0L NaClO溶液中氢氧根离子浓度为0.01mol/L,含有0.01mol氢氧根离子,次氯酸根离子部分水解促进了水的电离,其溶液中的氢氧根离子是水电离的,则水电离出的OH-的数目为0.01NA,故D正确。 答案选A。 【点睛】本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。 3.四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是 A. 四种元素中至少有两种金属元素 B. 四种元素的常见氢化物中熔点最高的是的氢化物 C. 四种元素形成的简单高子中,离子半径最小的是元素形成的离子 D. 常温下,三种元素形成化合物的水溶液的小于7 【答案】B 【解析】 【分析】 原子序数依次增大,位于不同主族的四种短周期元素X、Y、Z、W,X的内层电子与最外层电子数之比为2:5,X为氮元素,Z和W位于同周期。Z的化合物与人类生活关系密切,Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Z为钠元素,W为氯元素。Y和Z可形成两种离子化合物,其中阴、阳离子数之比均为1:2,Y为氧元素,据此解答。 【详解】A. 四种元素中只有钠为金属元素,故A错误; B. 氢化钠为离子化合物,四种元素的常见氢化物中熔点最高的是Z的氢化物,故B正确; C. 四种元素形成的常见简单离子中,离子半径最小的是元素Z形成的离子,钠离子半径最小,故C错误; D. 三种元素形成的化合物为NaNO3或NaNO2,若为NaNO3溶液显中性,pH等于7,若为NaNO2因水解溶液显碱性,pH大于7,故D错误。 故选B。 4.按如图装置进行实验,下列推断正确的是( ) 选项 Ⅰ中试剂 Ⅱ中试剂及现象 推断 A 氯化铵 酚酞溶液不变红色 氯化铵稳定 B 硫酸亚铁 品红溶液褪色 FeSO4分解生成FeO和SO2 C 涂有石蜡油的碎瓷片 酸性高锰酸钾溶液褪色 石蜡油发生了化学变化 D 铁粉与水蒸气 肥皂水冒泡 铁粉与水蒸气发生了反应 A. A B. B C. C D. D 【答案】C 【解析】 A.氯化铵受热易分解生成氨气和氯化氢,离开热源,氨气和氯化氢又会重新化合生成氯化铵,生成的氯化铵附着在试管口附近,所以酚酞溶液不变红色,A项错误;B.品红溶液褪色说明有二氧化硫生成,硫元素的化合价由+6价降低到+4价,则铁元素的化合价需由+2价升高到+3价,即硫酸亚铁受热分解生成氧化铁和二氧化硫,B项错误;C.酸性高锰酸钾溶液褪色说明有还原性物质生成,所以加热石蜡油生成了具有还原性的物质,发生了化学变化,C项正确;D.气体具有热胀冷缩的性质,若加热试管Ⅰ中的空气,肥皂水也会冒泡,D项错误。答案选C。 5.菲斯科(FiskerInc.)公司宣布正在开发的固态锂电池能量密度是现有电池的2.5倍,续航里程可达500英里(约804公里),最快充电时间可以分钟计,钴酸锂(LiCoO2) 电池的工作原理如图所示,M极材料是金属锂和碳的复合材料(碳作金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过。下列说法正确的是 A. 电池的总反应式为:LixC6+Li1-xCoO2==C6+LiCoO2 B. M为电池的正极 C. 放电时,N为负极,电极发生氧化反应 D. 充电时,M为阳极,电极发生氧化反应 【答案】A 【解析】 M极材料是金属锂和碳的复合材料(碳作金属锂的载体),故M为负极,LixC6-xe—=xLi++C6,发生氧化反应,N极为正极,电极反应为:Li1-xCoO2+xe—+ xLi+= LiCoO2,B、C项错误;正、负极反应式之和等于其总反应方程式:LixC6+Li1-xCoO2==C6+LiCoO2,A项正确;充电时,M为阴极,电极发生还原反应,D项错误。 6.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( ) A. 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3,其中c(CO32-)的大小关系为:②>④>③>① B. pH=2 的H2C2O4溶液与pH=12 的NaOH 溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(HC2O4-)+c(C2O42-) C. 向0.2mo/L 的NaHCO3 溶液中加入等体积0.1mo/L 的NaOH 溶液:c(CO32- )>c(HCO3-)>c(OH-)>c(H+) D. 常温下,等浓度的CH3COOH与CH3COONa 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(H+)+c(Na+) 【答案】A 【解析】 A. 等物质的量浓度的下列溶液:①H2CO3+H+ ,H+ +,第二步电离受到第一步的抑制,②+H2O+OH-,③H+ +,④+H2O+OH-,+H2ONH3 ·H2O+H+,两离子的水解互促,的电离程度:③>①,的水解程度:④>②,所以其中c(CO32-)的大小关系为:②>④>③>①,故A正确;B. 溶液电荷守恒:c(H+)+c(Na+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故B错误;C. NaHCO3有一半转化为Na2CO3,形成等浓度NaHCO3和Na2CO3的混合溶液,H+ +,+H2O+OH-,Na2CO3的水解程度大于NaHCO3,所以c(HCO3-)>c(CO32- )>c(OH-)>c(H+),故C错误;D. CH3COOHCH3COO-+H+,CH3COO-+ H2O CH3COOH+OH-,溶液的pH<7表明CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH),电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),因此,c(CH3COOH)+c(OH-)查看更多
相关文章
- 当前文档收益归属上传用户