- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省宜丰中学2018-2019学年高二上学期期末考试化学试卷
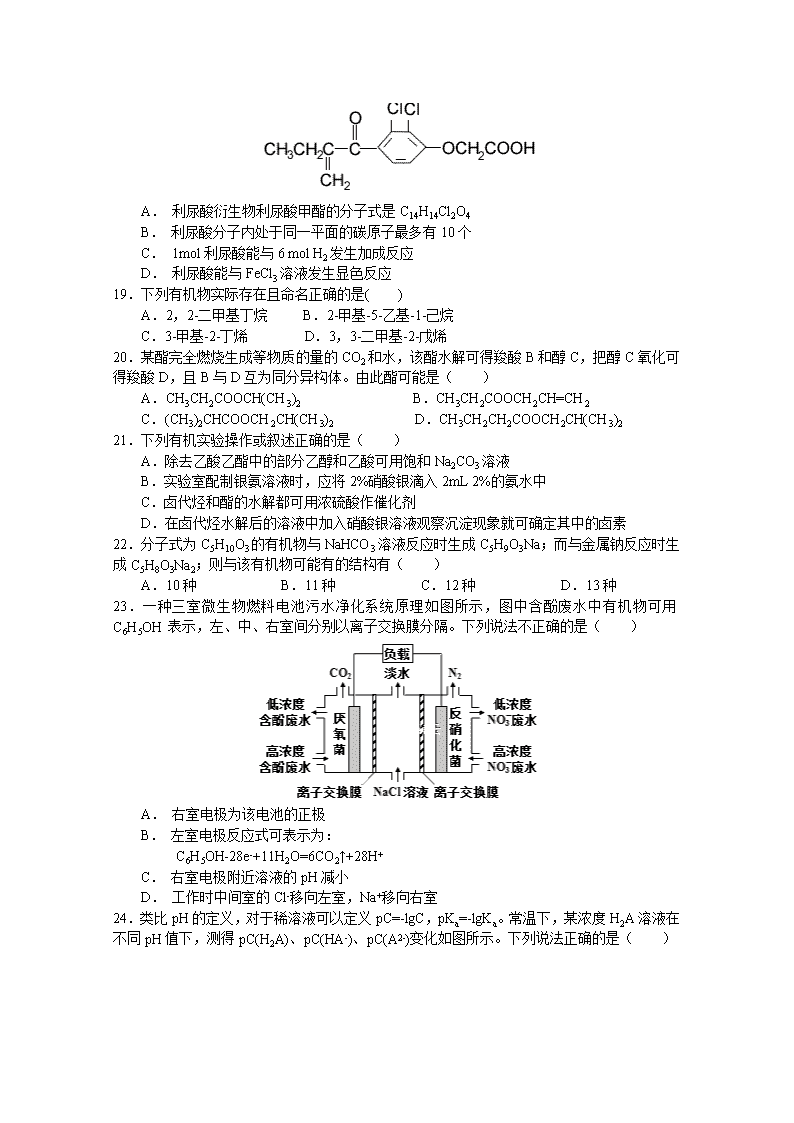
2018-2019学年度(上)高二期末考试化学试卷 可能用到的相对原子质量:H:1 C:12 N:14 O:16 P:31S:32 Cu:64 一.选择题(每小题只有一项符合题意,每小题2分,共48分) 1.下列属于弱电解质的是( ) A. 氨水 B. 麦芽糖 C. 干冰 D. 碳酸 2.下列表达式正确的是( ) A.小苏打溶液电离:NaHCO3=Na++H++CO32- B.HS-的水解方程式:HS-+ H2OH3O++S2- C.稀醋酸呈酸性:CH3COOH+H2OCH3COO-+H3O+ D.重晶石的电离:BaSO4Ba2++SO42- 3.下列说法不正确的是( ) A. Ksp只与难溶电解质的性质和温度有关 B. 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 C. ①0.01mol/L的盐酸,②0.01mol/L的醋酸溶液。将①和②均稀释100倍,稀释后的溶液的pH:①﹤② D. 两种难溶电解质,Ksp越小的电解质,其溶解度一定更小 4.下列说法中,与盐类水解有关的是( ) ①明矾可以做净水剂;②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;④在NH4Cl溶液中加入金属镁会产生氢气;⑤草木灰与铵态氮肥不能混合施用;⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性. A. ①④⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥ 5.下列有关金属腐蚀与防护的说法正确的是( ) A.黄铜(铜锌合金)制作的铜锣易产生铜绿 B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 C.钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面上镀上了铬 6.已知室温时,0.1mol/L的一元酸HA在水中有0.1%发生电离,下列叙述错误的是( ) A.溶液的PH=4 B.升高温度,溶液PH增大 C.此酸的电离平衡常数为1×10-7 D.由HA电离的c(H+)约为水电离出来的c(H+)的106倍 7.常温下,下列各组离子在指定溶液中能大量共存的是( ) A. 的溶液中: 、 、 、 B. 的溶液中: 、 、 、 C. 加入铝片能放出的溶液中: 、 、 、 D. 水电离出来的的溶液中: 、 、、 8.25 ℃时,将pH=2的强酸溶液与pH=13的强碱溶液混合,所得混合液的pH=11 ,则强酸溶液与强碱溶液的体积比是(忽略混合后溶液的体积变化( ) A. 11∶1 B. 9∶1 C. 1∶11 D. 1∶9 9.用标准浓度的NaOH溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( ) ①碱式滴定管用蒸馏水洗净后未用标准溶液润洗 ②锥形瓶中盛有少量蒸馏水,再加待测液 ③酸式滴定管用蒸馏水洗净后,未用盐酸润洗 ④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失 ⑤滴定后观察碱式滴定管读数时,俯视刻度线. A. ①④ B. ①③ C. ②③ D. ④⑤ 10.下列说法正确的是( ) A.升高温度,Al2(SO4)3溶液的pH增大。 B.0.1mol•L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol•L-1 C.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2 D.0.1 mol·L-1的醋酸溶液中:c(OH-)+c(CH3COO-)=c(H+) 11.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( ) A. 原子核内有10个中子的氧原子:18O B. 乙烯的结构简式: CH2CH2 C. CH4分子的比例模型: D. -CH3(甲基)的电子式为: 12.对于苯乙烯()的下列叙述,其中正确的是( ) ①能使酸性KMnO4溶液褪色 ②可发生加聚反应 ③可溶于水 ④可溶于苯中 ⑤能与浓硝酸发生取代反应 ⑥所有的原子可能共平面 A.只有①②④⑤ B.只有①②⑤⑥ C.①②④⑤⑥ D.全部正确 13.已知:乙醇可被强氧化剂氧化为乙酸。BrCH2CH=CHCH2Br可经三步反应制取HOOCCH(Cl)CH2COOH,发生反应的类型依次是( ) A.水解反应、加成反应、氧化反应 B.加成反应、水解反应、氧化反应 C.水解反应、氧化反应、加成反应 D.加成反应、氧化反应、水解反应 14.下列关于实验原理或操作的叙述中,正确的是( ) ①从碘水中提取单质碘时,可用无水乙醇代替CCl4 ②可以用NaOH溶液除去溴苯中的溴杂质 ③用酸性KMnO4溶液可以除去乙烷中混有的乙炔 ④实验室中提纯混有少量水的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 A.①② B.②③ C.②④ D.①③ 15.等浓度的下列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的pH由大到小排列正确的是( ) A.④②③① B.③①②④ C.①②③④ D.①③②④ 16.分子式为C5H10的属于烯烃的同分异构体有多少种(不考虑顺反异构现象( ) A. 4种 B. 5种 C. 6种 D. 7种 17.烯烃在一定条件下发生氧化反应时C===C键发生断裂, RCH===CHR′可以氧化成RCHO和R′CHO, 在该条件下,下列烯烃分别被氧化后产物可产生乙二醛的是( ) A. CH3CH===CH(CH2)2CH3 B. CH2===CH(CH2)2CH3 C. CH3CH===CH—CH===CHCH3 D. CH3CH2CH===CHCH2CH3 18.利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是( ) A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 B. 利尿酸分子内处于同一平面的碳原子最多有10 个 C. 1mol 利尿酸能与6 mol H2发生加成反应 D. 利尿酸能与FeCl3溶液发生显色反应 19.下列有机物实际存在且命名正确的是( ) A.2,2-二甲基丁烷 B.2-甲基-5-乙基-1-己烷 C.3-甲基-2-丁烯 D.3,3-二甲基-2-戊烯 20.某酯完全燃烧生成等物质的量的CO2和水,该酯水解可得羧酸B和醇C,把醇C氧化可得羧酸D,且B与D互为同分异构体。由此酯可能是( ) A.CH3CH2COOCH(CH3)2 B.CH3CH2COOCH2CH=CH2 C.(CH3)2CHCOOCH2CH(CH3)2 D.CH3CH2CH2COOCH2CH(CH3)2 21.下列有机实验操作或叙述正确的是( ) A.除去乙酸乙酯中的部分乙醇和乙酸可用饱和Na2CO3溶液 B.实验室配制银氨溶液时,应将2%硝酸银滴入2mL 2%的氨水中 C.卤代烃和酯的水解都可用浓硫酸作催化剂 D.在卤代烃水解后的溶液中加入硝酸银溶液观察沉淀现象就可确定其中的卤素 22.分子式为C5H10O3的有机物与NaHCO3溶液反应时生成C5H9O3Na;而与金属钠反应时生成C5H8O3Na2;则与该有机物可能有的结构有( ) A.10种 B.11种 C.12种 D.13种 23.一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH 表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( ) A. 右室电极为该电池的正极 B. 左室电极反应式可表示为: C6H5OH-28e-+11H2O=6CO2↑+28H+ C. 右室电极附近溶液的pH减小 D. 工作时中间室的Cl-移向左室,Na+移向右室 24.类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是( ) A. pH=3.50时,c(H2A)>c(HA-)>c(A2-) B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80 C. b点时,=104.50 D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小 二、填空题(共52分) 25.(每空2分,共8分)现有下列几种有机物: A.CH4 B.(CH3)2C=CHCH3 C.C2H2 D.C6H14 E.CH2=CHCH=CH2 F.环戊烷 请回答下列问题:[第(1)问请用A、B、C等代码作答,第(3)问请用化学用语作答] (1)上述有机物中互为同系物的是________,互为同分异构体的是________。 (2)请用系统命名法对B进行命名__________。 (3)CH4的质谱图上质荷比为16的微粒符号是________。 26.(每空2分,共10分)溶液中的化学反应大多是离子反应。根据要求回答下列问题: (1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示盐碱地呈碱性的原因:____________________________________。 (2)已知水存在平衡2H2OH3O++OH-,向水中加入NaHSO4固体,水的电离平衡________(填“向左”或 “ 向右”)移动,所得溶液显________性。 (3)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍,稀释后pH仍相等,则m________ n(填“>”“<”或“=”)。 (4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,由水电离出来的c(OH-)=________mol·L-1。 27.(除注明外,每空1分,共8分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则 ①电解池中X极上的电极反应是______________。②Y电极上的电极反应式是______________。检验该电极反应产物的方法是______________。 (2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是___________________,电极反应式是______________。 (3)若X、Y都是惰性电极,电解100 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入________(填写物质的化学式)________g。(2分) 28.(每空1分,共10分)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯 (1)制备粗品 将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。 ①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是___________。 ②试管C置于冰水浴中的目的是____________________________________________。 (2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。 a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 ②再将环己烯按如图装置蒸馏,蒸馏时要加入生石灰,目的是__________________。 ③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(______) a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了 c.制备粗品时环己醇随产品一起蒸出 (3)以下区分环己烯精品和粗品的方法,合理的是_________。 a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点 (4)设计实验检验环己烯精品中是否含己二醛_______________________。 29.(每空2分,共16分) 氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:回答下列问题: (1)A的结构简式为____________。 (2)③的反应试剂是____________________,该反应的类型是__________。 (3)⑤的反应方程式为___________________________________________。吡啶是一种有机碱性溶剂,其作用是____________。 (4)G的分子式为______________。 (5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H 可能的结构有______种。 (6)4-甲氧基乙酰苯胺()是重要的精细化工中间体,写出由苯甲醚()制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。 高二期末考试化学参考答案 1.D 2.C 3.D 4.D 5.B 6.B 7.B 8.B 9.A 10.D 11.A 12.C 13.A 14.C 15.A 16.B 17.C 18.A 19.A 20.D 21.A 22.C 23.C 24.C 25.(每空2分,共8分) AD BF 2-甲基-2-丁烯 CH 26.(每空2分,共10分) CO+H2OHCO+OH- 向左 酸 < 1×10-8 27.(除注明外,每空1分,共8分) 2H+ + 2e - = H2↑ 2Cl - - 2e - = Cl2 ↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色 纯铜/精铜 Cu2+ + 2e - = Cu CuO/CuCO3 0.4/0.62(2分) 28.(每空1分,共10分)防暴沸 冷凝 防止环己烯挥发 上 c 干燥/与H2O反应 83℃ c b 取精品试液少许于试管中, 新制氢氧化铜悬浊液后加热,若能观察到砖红色的沉淀,则证明环己烯精品中含有己二醛,反之则无(答案合理均给分) 29.(每空2分,共16分) 浓HNO3/浓H2SO4 取代反应 +HCl 吸收反应产生的HCl,提高反应转化率 C11H11F3N2O3 9 查看更多