- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省大连市旅顺口区2020届高三上学期期中考试化学试卷
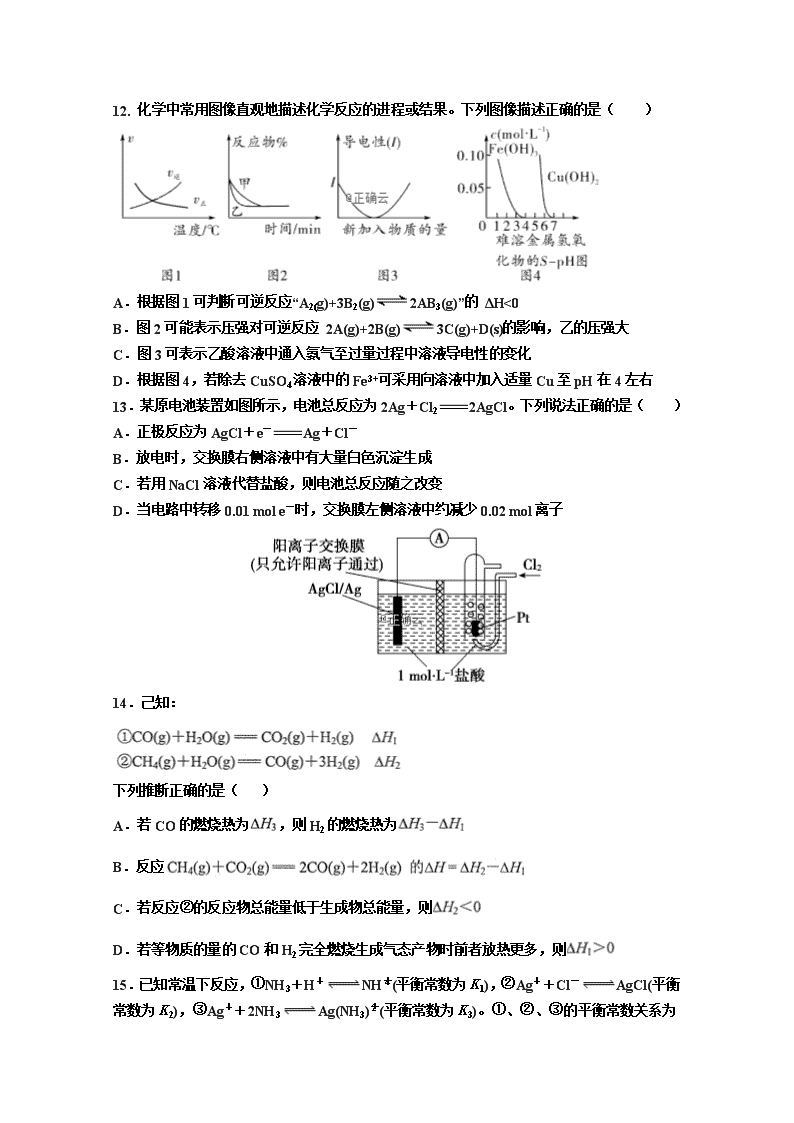
高 三 化 学 期 中 考 试 卷 本卷共分为选择题和非选择题两部分,满分100分;答题时间90分钟。 可能用到的相对原子质量:O 16 Na 23 Cl 35.5 Fe 56 K39 Mn55 第Ⅰ卷(选择题 共60分) 本卷选择题共20小题,每小题3分,共60分,每小题只有一个选项符合题意。 1.化学深入我们生活,下列说法不正确的是( ) A.食盐可做食物调味剂,也可做食品防腐剂 B.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 D.用浸泡过高锰酸钾溶液的硅藻土吸收水果中的乙烯,可以实现水果保鲜的目的 2.下列化学用语正确的是( ) A.丙烯的实验式:C3H6 B.CO2的电子式: C.镁离子的结构示意图: D.中子数为18的氯原子符号: 3.用NA表示阿伏伽德罗常数的值,下列叙述正确的是 ( ) A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA B.16 g O3和O2混合物中氧原子数为NA C.1mol的羟基与1mol的氢氧根离子所含的电子数均为9NA D.标准状况下,0.1mol Cl2溶于水,转移电子数为0.1NA 4.下列有关分类的说法正确的是( ) A.胶体的本质特征是具有丁达尔效应 B.阳离子、阴离子中均分别只含有一种元素,则由这样的阴、阳离子组成的物质一定是纯净物 C.白磷转化为红磷是物理变化 D.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 5.在室温下,下列各组离子一定能大量共存的是( ) A.滴入石蕊试液显红色的溶液:K+、Mg2+、AlO2−、SO32− B.1.0 mol·L−1的KNO3溶液:H+、Fe2+、Cl−、SO42− C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3− D.通入足量CO2的溶液:Ca2+、Cl−、K+、Na+ 6.下列事实不能用元素周期律解释的是( ) A.气态氢化物的稳定性:HBr > HI B.0.1 mol·L-1溶液的pH:NaOH > LiOH C.向Na2SO3溶液中加盐酸,有气泡产生 D.Mg、Al与同浓度盐酸反应,Mg更剧烈 7. 下列离子方程式正确的是( ) A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合: Ba2++2OH−+ NH4++HCO3−BaCO3↓+NH3·H2O+H2O B.将磁性氧化铁溶于盐酸:Fe3O4+8H+3Fe3++4H2O C.用铁电极电解氯化钠溶液:2Cl−+2H2O2OH−+H2↑+Cl2↑ D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO−+SO2+H2OCaSO3↓+2HClO 8. 有机物的结构可用“键线式”表示,如CH3—CHCH—CH3可简写为,有机物X的键线式为。下列说法中不正确的是( ) A.X的分子式为C8H8 B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为 C.X能使KMnO4酸性溶液褪色 D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯化物有4种 9.某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-, 且这三种离子物质的量浓度之比为l:l:6。下列有关该溶液的判断正确的是( ) A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变 B.向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为l D.向该溶液中加入过量铁粉,只发生置换反应 10.根据如图的转化关系判断下列说法正确的是(反应条件已略去) ( ) A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应 B.反应⑤说明该条件下铝可用于制熔点较高的金属 C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1 D.反应①中氧化剂与还原剂的物质的量之比为1∶4 11.分子式为C4H2Cl8的同分异构体共有(不考虑立体异构)( ) A.10种 B.9种 C.8种 D.7种 12. 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( ) A.根据图1可判断可逆反应“A2(g)+3B2(g)2AB3(g)”的 ΔH<0 B.图2可能表示压强对可逆反应 2A(g)+2B(g)3C(g)+D(s)的影响,乙的压强大 C.图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 D.根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 13.某原电池装置如图所示,电池总反应为2Ag+Cl22AgCl。下列说法正确的是( ) A.正极反应为AgCl+e-Ag+Cl- B.放电时,交换膜右侧溶液中有大量白色沉淀生成 C.若用NaCl溶液代替盐酸,则电池总反应随之改变 D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 14.己知: 下列推断正确的是( ) A.若CO的燃烧热为,则H2的燃烧热为 B.反应 C.若反应②的反应物总能量低于生成物总能量,则 D.若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则 15.已知常温下反应,①NH3+H+NH(平衡常数为K1),②Ag++Cl-AgCl(平衡常数为K2),③Ag++2NH3Ag(NH3)(平衡常数为K3)。①、②、③的平衡常数关系为K1 >K3>K2,据此所做的以下推测合理的是( ) A.氯化银不溶于氨水 B.银氨溶液中加入少量氯化钠有白色沉淀 C.银氨溶液中加入盐酸有白色沉淀 D.银氨溶液可在酸性条件下稳定存在 16.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g) 按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 下列说法正确的是( ) A.2c1<1.5 B.ρ1=ρ2 C.ω1=2ω3 D.在该温度下甲容器中反应的平衡常数 17.下列有关说法正确的是( ) A.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH -) B.pH相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③ C.常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+) D.常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 18.常温下,含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的质量分数与溶液pH的关系如图所示,下列说法错误的是( ) A.pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-) B.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 D.若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) 19.25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[−lgc(M2+)]与溶液pH的变化关系如图所示,已知:该温度下, Ksp[Cu(OH)2]查看更多