- 2021-07-02 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习分子结构与性质作业
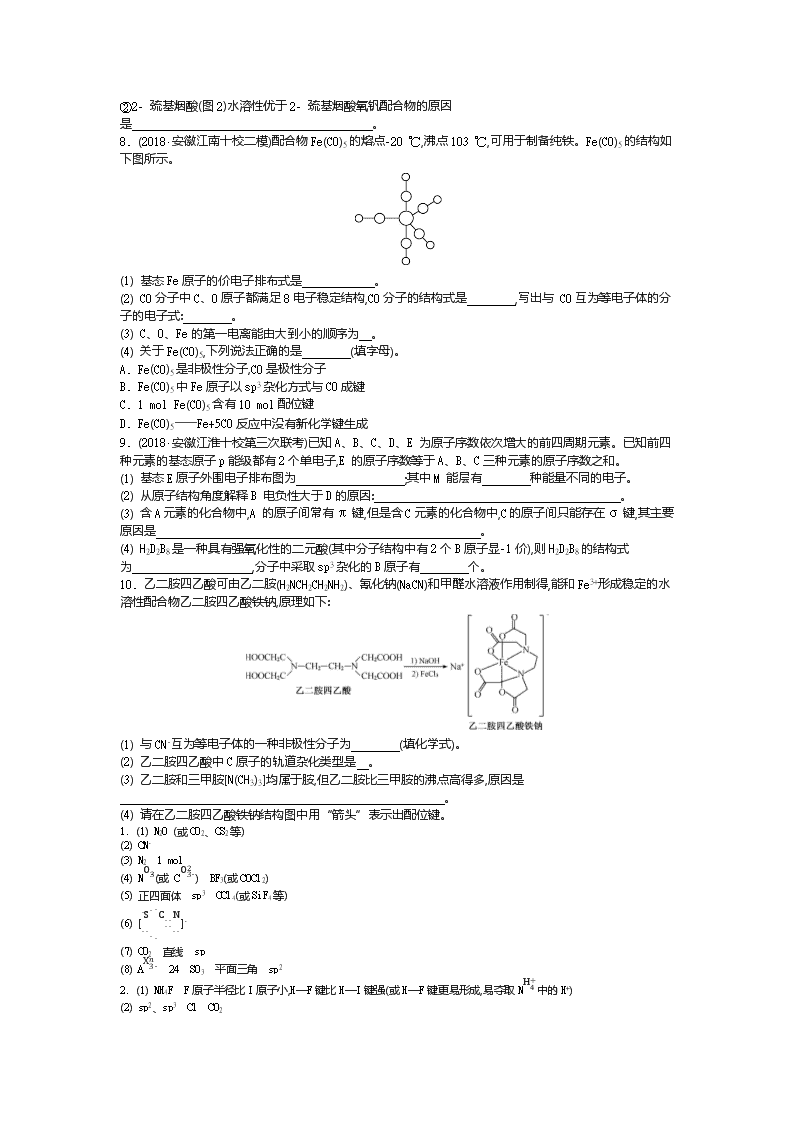
第37讲 分子结构与性质 1. 填空: (1) 与NO2+互为等电子体的一种分子为 (填化学式) (2) 与CO互为等电子体且带1个单位负电荷的阴离子化学式为 。 (3) 与CO互为等电子体的一种分子为 (填化学式),1 mol CO中含有的σ键数目为 。 (4) 与SO3互为等电子体的离子与分子分别为 、 (填化学式)。 (5) (2018·黄山一模)SO42-空间构型为 ,中心原子的轨道杂化方式是 ,写出一个与SO42-互为等电子体的分子的化学式: 。 (6) SCN-与N2O互为等电子体,则SCN-的电子式为 。 (7) CNS-、NO2+都有3个原子,它们的价电子总数都是16,因此它们的结构与由第2周期两元素组成的 分子的结构相同,微粒呈 形,中心原子都采取 杂化。 (8) CO32-、NO3-等微粒具有相同的通式: ,它们的价电子总数都是 ,因此它们与由ⅥA族两元素组成的 分子的结构相同,呈 形,中心原子都采取 杂化。 2. (1) (2018·广东韶关二模)铵盐大多不稳定。NH4F、NH4I中,较易分解的是 ,原因是 。 (2) (2018·广东潮州二模)TiCl3可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛作催化剂时,可以发生聚合反应: nCH3CHCH2。该反应中涉及的物质中碳原子的杂化轨道类型有 ;反应中涉及的元素中电负性最大的是 。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是 。 (3) (2017·全国Ⅲ卷)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 ,原因是 。 3. (2018·合肥二检)氮(N)、磷(P)、砷(As)等ⅤA族元素化合物在研究和生产中有重要用途。如我国科研人员研究发现As2O3(或写成As4O6,俗称砒霜)对白血病有明显的治疗作用。回答下列问题: (1) 写出一种与CN-互为等电子体的粒子: (用化学式表示);(SCN)2分子中σ键和π键个数比为 。 (2) 砒霜剧毒,可用石灰消毒生成AsO33-和少量AsO43-,其中AsO33-中As的杂化方式为 ,AsO43-的空间构型为 。 (3) NH4+中H—N—H的键角比NH3中H—N—H的键角大的原因是 ;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如下图),该化合物加热时首先失去水,请从原子结构角度加以分析: 。 4. (2018·广东肇庆一模)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。 (1) 拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 (CN)2分子中氮原子的轨道杂化类型为 ,σ 键与 π 键数目之比为 。 (2) (SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—NCS),其原因是 。 (3) ①卤化物 RbICl2在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为 。 ②一定条件下(SCN)2可氧化为CO32-和SO32-等离子,其中SO32-的立体构型为 。 (4) 写出与C22-互为等电子体的微粒符号: 、 。 5. (2017·河北保定一模)铁和钴是两种重要的过渡元素。 (1) 钴位于元素周期表中 族,其基态原子中未成对电子的个数为 。 (2) [Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为 ,尿素分子中C、N原子的杂化方式分别是 、 ,其分子中σ键与π键的数目之比为 ,所含非金属元素的电负性由大到小的顺序是 。 (3) Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为 。 6. (2018·广东珠海一模) (1) 固体可分为晶体、非晶体和准晶体三大类,可通过 方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为 。 (2) PCl3的立体构型为 ,中心原子的杂化轨道类型为 。 (3) 硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。 BF3 BCl3 BBr3 BI3 沸点/K 172 285 364 483 ①四种卤化物沸点依次升高的原因是 。 ②B、C、N、O三种元素第一电离能由小到大的顺序为 。 ③用BF3分子结构解释反应BF3(g)+NH4F(s)NH4BF4(s)能够发生的原因: 。 (4) 碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图。 石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm,其原因是金刚石中只存在C—C间的 (填“σ”或“π”)共价键,而石墨层内的C—C间存在 共价键。 7. (2018·广东佛山一模) (1) 多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是 (填字母)。 A. SO2 B. SO42- C. H2S D. CS2 (2) 2- 巯基烟酸氧钒配合物(图1)是副作用小的有效调节血糖的新型药物。 图1 图2 ①基态S原子中原子核外未成对电子数为 ,该药物中S原子的杂化方式是 。所含第2周期元素第一电离能按由大到小顺序排列是 。 ②2- 巯基烟酸(图2)水溶性优于2- 巯基烟酸氧钒配合物的原因是 。 8. (2018·安徽江南十校二模)配合物Fe(CO)5的熔点-20 ℃,沸点103 ℃,可用于制备纯铁。Fe(CO)5的结构如下图所示。 (1) 基态Fe原子的价电子排布式是 。 (2) CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是 ,写出与 CO互为等电子体的分子的电子式: 。 (3) C、O、Fe的第一电离能由大到小的顺序为 。 (4) 关于Fe(CO)5,下列说法正确的是 (填字母)。 A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键 C. 1 mol Fe(CO)5含有10 mol配位键 D. Fe(CO)5Fe+5CO反应中没有新化学键生成 9. (2018·安徽江淮十校第三次联考)已知A、B、C、D、E 为原子序数依次增大的前四周期元素。已知前四种元素的基态原子p能级都有2个单电子,E 的原子序数等于A、B、C三种元素的原子序数之和。 (1) 基态E原子外围电子排布图为 ;其中M 能层有 种能量不同的电子。 (2) 从原子结构角度解释B 电负性大于D的原因: 。 (3) 含A元素的化合物中,A 的原子间常有π键,但是含C元素的化合物中,C的原子间只能存在σ键,其主要原因是 。 (4) H2D2B8是一种具有强氧化性的二元酸(其中分子结构中有2个B原子显-1价),则H2D2B8的结构式为 ,分子中采取sp3杂化的B原子有 个。 10. 乙二胺四乙酸可由乙二胺(H2NCH2CH2NH2)、氰化钠(NaCN)和甲醛水溶液作用制得,能和Fe3+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如下: (1) 与CN-互为等电子体的一种非极性分子为 (填化学式)。 (2) 乙二胺四乙酸中C原子的轨道杂化类型是 。 (3) 乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是 。 (4) 请在乙二胺四乙酸铁钠结构图中用“箭头”表示出配位键。 1. (1) N2O (或CO2、CS2等) (2) CN- (3) N2 1 mol (4) NO3-(或 CO32-) BF3(或COCl2) (5) 正四面体 sp3 CCl4(或SiF4等) (6) [S········C····N····]- (7) CO2 直线 sp (8) AX3n- 24 SO3 平面三角 sp2 2. (1) NH4F F原子半径比I原子小,H—F键比H—I键强(或H—F键更易形成,易夺取NH4+中的H+) (2) sp2、sp3 Cl CO2 (3) H2O>CH3OH>CO2>H2 H2O和CH3OH均为极性分子,H2O中氢键比CH3OH多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力较大 解析 (2) 单键碳为sp3杂化,双键碳为sp2杂化;涉及的元素中Cl的非金属性最强,所以Cl的电负性最大;在氧气中三乙基铝完全燃烧生成氧化铝、二氧化碳、水,氧化铝是离子化合物、CO2为直线形分子、H2O是V形分子。 3. (1) CO(或N2) 5∶4 (2) sp3 正四面体 (3) NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子与成键电子之间的排斥力强于成键电子与成键电子之间的排斥力,导致NH4+中H—N—H的键角比NH3中大 由于O原子半径小,电负性大,提供孤对电子能力比N原子弱,故水分子形成的配位键弱于氨分子 解析 (1) CN-有2个原子、10个价电子,与其互为等电子体的粒子有CO、N2、C22-等;(SCN)2的结构式为 N≡C—S—S—C≡N,单键全是σ键,三键中有1个σ键和2个π键,(SCN)2分子中有5个σ键、4个π键,σ键和π键个数比为5∶4。(2) AsO33-中As上的孤电子对数=12(5+3-3×2)=1,成键电子对数为3,As的价层电子对数为1+3=4,As的杂化方式为sp3;AsO43-中As上的孤电子对数=12(5+3-4×2)=0,成键电子对数为4,As的价层电子对数为0+4=4,AsO43-的空间构型为正四面体。 4. (1) sp 3∶4 (2) 异硫氰酸分子间可形成氢键,而硫氰酸不能 (3) ①RbCl ②三角锥形 (4) CO、NO+、CN-(任写两种) 解析 (1) (CN)2的结构式为N≡C—C≡N,为直线形分子,故分子中氮原子的轨道杂化类型为sp杂化;单键为σ键,三键含有1个σ键、2个π键,则其分子中σ键与π键数目之比为3∶4。(3) ①已知RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,因为氯离子的半径小于碘离子的半径,所以RbCl的离子键键长小于RbI的离子键键长,则RbCl的晶格能较大,故A为RbCl。②SO32-中S形成3个σ键,孤电子对数为6+2-2×32=1,立体构型为三角锥形。(4) C22-有2个原子、10个价电子,与N2、CO、NO+、CN-等互为等电子体。 5. (1) Ⅷ 3 (2) [Ar]3d5(或1s22s22p63s23p63d5) sp2 sp3 7∶1 O>N>C>H (3) SO42-、NH3 解析 (2) 尿素的结构简式为,碳原子存在双键,氮原子全部是单键,且存在孤对电子,所以分子中C、N原子的杂化方式分别是sp2、sp3;单键都是σ键,双键中含有1个σ键和1个π键,则尿素分子中σ键与π键的数目之比为7∶1;非金属性越强电负性越大。(3) 在第一种配合物溶液中加硝酸银溶液产生白色沉淀,白色沉淀是硫酸银,说明硫酸根不是配体;在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,淡黄色沉淀是溴化银,说明溴离子不是配体。 6. (1) X- 射线衍射 [Ar]3d54s2 (2) 三角锥形 sp3 (3) ①分子结构相似,相对分子质量增大,分子间作用力增强 ②B查看更多