2017-2018学年山西省临汾第一中学高二下学期期末考试化学试题 Word版
2017-2018学年山西省临汾第一中学高二下学期期末考试化学试题
可能用到的相对原子质量: H-1 C-12 N-14 O-16 F-19 Na -23 Al-27 Si-28 S-32 Ti-48 Fe-56 Ni-59 Cu-64 Ba-137
第 I卷 选择题(共40分)
一、选择题(本大题共20小题,每小题2分,共40分,每小题只有1个正确答案)
1、化学与人类的生产、生活密切相关,下列说法正确的是
A.某糕点只含面粉、油脂、蛋白质,不含糖,是糖尿病人的最佳食品
B.用作荧光灯内壁保护层的氧化铝纳米材料属于胶体
C.尼龙、羊毛和棉花都是天然纤维
D.高温结构陶瓷耐高温、耐氧化,是喷气发动机的理想材料
2、中国文化源远流长,下列对描述内容所做的相关分析不正确的是
选项
描述
分析
A
熬胆矾铁釜,久之亦化为铜
其反应原理是电镀
B
以火烧之,紫青烟起,乃真硝石(KNO3)
紫青烟是因为发生了焰色反应
C
冬月灶中所烧薪柴之灰,令人以灰淋之,取碱浣衣
这里的碱主要是K2CO3
D
用浓酒和糟入甑,蒸令气上,用器承滴露
其中涉及的操作是蒸馏
3、设NA为阿伏伽德罗常数的值,下列说法正确的是
A.100g46%的乙醇溶液中,含H-O键的数目为NA
B.1 molNaHSO4在熔融状态下电离出的阳离子数为2NA
C.氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
D.常温常压下,92g的NO2和NO混合气体含有的原子数为6NA
4、下列实验中的颜色变化,与氧化还原反应无关的是
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
NaS溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
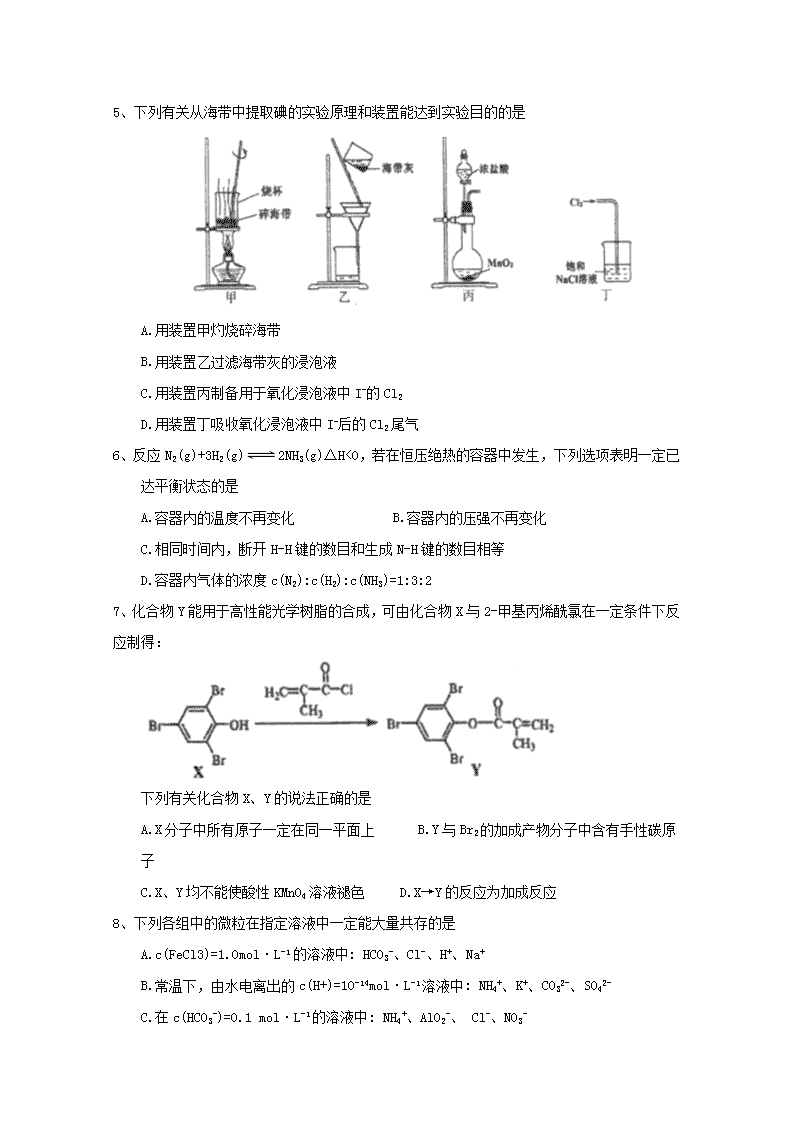
5、下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中I-的Cl2
D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
6、反应N2(g)+3H2(g)2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
A.容器内的温度不再变化 B.容器内的压强不再变化
C.相同时间内,断开H-H键的数目和生成N-H键的数目相等
D.容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
7、化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:
下列有关化合物X、Y的说法正确的是
A.X分子中所有原子一定在同一平面上 B.Y与Br2的加成产物分子中含有手性碳原子
C.X、Y均不能使酸性KMnO4溶液褪色 D.X→Y的反应为加成反应
8、下列各组中的微粒在指定溶液中一定能大量共存的是
A.c(FeCl3)=1.0mol·L-1的溶液中: HCO3-、Cl-、H+、Na+
B.常温下,由水电离出的c(H+)=10-14mol·L-1溶液中: NH4+、K+、CO32-、SO42-
C.在c(HCO3-)=0.1 mol·L-1的溶液中: NH4+、AlO2-、 Cl-、NO3-
D.常温下=0.1 mol·L-1的溶液中:K+、NH3·H2O、SO42- 、NO3-
9、室温下,向圆底烧瓶中加入1mo1C2H5OH和1 molAR的氢溴酸,溶液中发生反应C2H5OH+ HBrC2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物均增大至2mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60℃,可缩短反应达到平衡的时间
10、短周期主族元素X、Y、Z、W原子序数次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素期表ⅢA族,冒与X属于同一主族。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y) B.由X、Y组成的化合物中均不含共价键
C.Y的最高价氧化物的水化物的碱性比Z的弱 D.X的简单气态氢化物的热稳定性比W的强
11、人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是
A.a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C.阳极室中发生的电极反应为2H++2e-=H2↑
D.若两极共收集到气体13.44L(标准状况)则除去的尿素为7.2g(忽略气体的溶解)
12、下列指定反应的离子方程式正确的是
A.饱和Na2CO3溶液与CaSO4固体反应:CO32-+CaSO4=CaCO3+SO42-
B.酸化NaIO3和NaI的混合溶液:I-+IO3-+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+4H++H2O
D.电解饱和食盐水:2Cl-+2H+ Cl2↑+H2↑
13、一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图:
下列关于该高分子的说法正确的是
A.完全水解产物的单个分子中,苯环上的原子具有不同的化学环境
B.完全水解产物的单个分子中,含有官能团—COOH或—NH2
C.氢键对该高分子的性能没有影响
D.结构简式为:
14、下列叙述中不正确的是
A.0.1mo1·L-1NH4HS溶液中有:c(NH4+)
a>b
D.b点溶液中: c(OH-)> c(H+)+c(CH3COO-)+c(CH3COOH)
20、根据下列图示所得出的结论不正确的是
A.图甲是CO(g)+H2O(g)CO2(g)+H2(g)平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到淀溶解平衡时,溶液中(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小
第II卷(非选择题,共60分)
本卷包括必做题和选做题两部分,第21~24题为必做题,每个试题学生都必须作答,第25~26为选做题,请根据考试要求作答。
21、某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题。
(1)写出酸性KMnO4溶液和H2C2O4的离子方程式____________________________。
(2)配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是__________________。
(3)将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序
KMnO4溶液紫色褪去所需的时间
先滴入第1滴
60s
褪色后,再滴入第2滴
15s
褪色后,再滴入第3滴
3s
褪色后,再滴入第4滴
1s
请分析KMnO4溶液褪色时间变化的可能原因_________________。
22、(14分)以C12、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知:①C12+2OH-=C1O-+C1-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaC1O剧烈反应生成N2。
(1)步骤I制备NaC1O溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________;实验中控制温度除用冰水浴外还需采取的措施是________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如图-1所示NaC1O碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_______________________;使用冷凝管的目的是_______________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图-2所示,Na2SO3的溶解度曲线如图-3所示)
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为____________________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:____________________________,用少量无水乙醇洗涤,干燥,密封包装。
23、(15分)我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”—钛酸钡( BaTiO3)的工艺流程如下:
查阅资料可知:
①常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiCl4在常温下是无色液体,遇水容易发生水解:TiC14+2H2O=TiO2+4HCl
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________________________,此反应的平衡常数K=__________(填写计算结果)。若不考虑CO32-的水解,则至少需要使用_______mol/L的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)配制TiC14溶液时通常将TiC14
固体溶于浓盐酸再加水稀释,其目的是_______________________。(3)可循环使用的物质X是___________________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_________________________________。
(4)写出煅烧草酸氧钛钡晶体的化学方程式:_________________________________。
24、(15分)CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=______。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) (2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键
C—H
C=O
H—H
CO
键能/kJ·mol-1
413
745
436
1075
则该反应的△H=___________。分别在vL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____________(填“A”或“B”)
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是__________________。
(3)O2辅助的A1-CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e-=6O2-
6CO2+6O2-=3C2O42-+6O2
反应过程中O2的作用是_______________。
该电池的总反应式:_______________________。
选做题(从以下两个模块中任选一题作答)
25、(10分)钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题。
(1)写出基态Ti原子的电子排布式:________________,Ni在元素周期表中的位置是___________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为___________,中心原子的轨道杂化类型是__________________。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时.现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___________________。
(4)一种钛镍合金的立方晶胞结构如图所示:
①该合金中Ti的配位数为______________。
②若合金的密度为dg/cm3,晶胞边长a=_________pm。(用含d的计算式表示)
26、[化学—有机化学基础](10分)
研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):
已知:I.
Ⅱ.
回答下列问题:
(1)B的名称是______________。
(2)反应⑤所属的反应类型为______________。
(3)反应⑥的化学方程式为___________________________。
(4)芳香族化合物X是C的同分异构体,只含一种官能团且1molX与足量 NaHCO3溶液发生反应生成2 molCO2,则X的结构有_______种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3:2:2:1的结构简式为______________。
(5)写出以乙醇和甲苯为原料制备的路线(其他无机试剂任选)________________________________。
答案
1-10 DADCB ABDDD 11-20 DABDD ADCDC
21、(6分)(1)①2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
②100mL容量瓶、胶头滴管
③反应生成的Mn2+对反应有催化作用,且Mn2+的浓度大催化效果更好
22、(14分)(1)3Cl2+6OH−5Cl−+ClO3−+3H2O 缓慢通入Cl2
(2)NaClO碱性溶液 减少水合肼的挥发
(3)①测量溶液的pH,若pH约为4,停止通SO2 (3分)
②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤 (3分)
23、(15分) (1) BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq)
0.04 (或1/25 ) 2.5×10-4
(2)抑制TiCl4的水解
(3)HCl 取最后一次洗涤液少许,滴入稀硝酸酸化的硝酸银,若无沉淀生成,则说明晶体已经洗涤干净
(4)BaTiO(C2O4)2·4H2OBaTiO3 + 2CO2 +2CO +4H2O (3分)
24、(15分)(1)CO32- 10
(2)①+120 kJ·mol-1 B
②900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,
但能耗升高,经济效益降低。 (3分)
(3)催化剂 2Al+6CO2=Al(C2O4)3
25、(10分)
(1) 1s22s22p63s23d24s2或[Ar] 3d24s2 第4周期第VIII族
(2)正四面体 sp3
(3)产生白色沉淀; [Co (NH3)5SO4]Br (2分)
(4)6 ×103(2分)
26、[有机化学基础]
(1)对苯二甲酸(1分)
(2)加成反应(1分)
(3)(2分)
(4)10(2分); (1分);(1分)
(5)
(或其他合理答案)(2分)