2021届一轮复习人教版水的电离和溶液的酸碱性作业
水的电离和溶液的酸碱性
时间:45 分钟
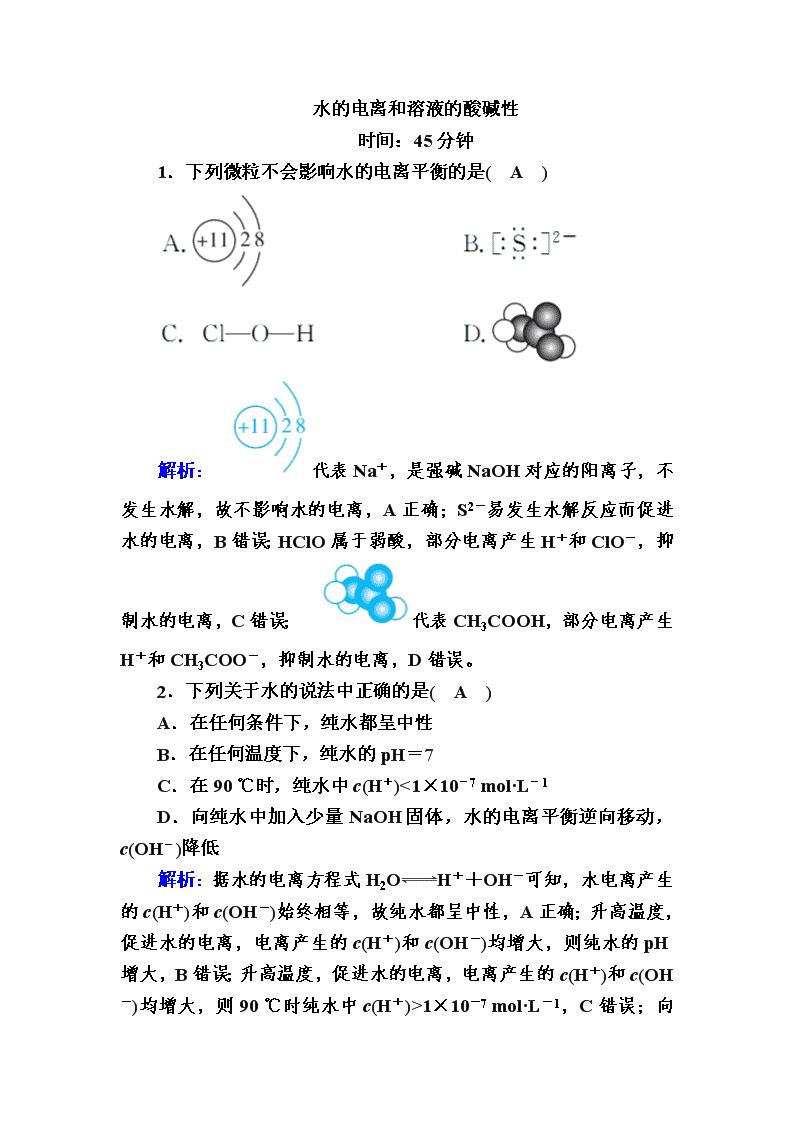
1.下列微粒不会影响水的电离平衡的是( A )
解析: 代表 Na+,是强碱 NaOH 对应的阳离子,不发
生水解,故不影响水的电离,A 正确;S2-易发生水解反应而促进水
的电离,B 错误;HClO 属于弱酸,部分电离产生 H+和 ClO-,抑制
水的电离,C 错误; 代表 CH3COOH,部分电离产生 H+
和 CH3COO-,抑制水的电离,D 错误。
2.下列关于水的说法中正确的是( A )
A.在任何条件下,纯水都呈中性
B.在任何温度下,纯水的 pH=7
C.在 90 ℃时,纯水中 c(H+)<1×10-7 mol·L-1
D.向纯水中加入少量 NaOH 固体,水的电离平衡逆向移动,
c(OH-)降低
解析:据水的电离方程式 H2O H++OH-可知,水电离产生
的 c(H+)和 c(OH-)始终相等,故纯水都呈中性,A 正确;升高温度,
促进水的电离,电离产生的 c(H+)和 c(OH-)均增大,则纯水的 pH 增
大,B 错误;升高温度,促进水的电离,电离产生的 c(H+)和 c(OH-)
均增大,则 90 ℃时纯水中 c(H+)>1×10-7 mol·L-1,C 错误;向纯水
中加入少量 NaOH 固体,溶液中 c(OH-)增大,水的电离平衡逆向移
动,D 错误。
3.已知 40 ℃时水的离子积常数为 KW。该温度下,将浓度为 a
mol·L-1 的一元酸 HA 与 b mol·L-1 的一元碱 BOH 等体积混合,该溶
液呈中性时,下列叙述不正确的是 ( A )
A.a=b,pH=7
B.混合溶液的 c(H+)=c(OH-)
C.混合溶液中 c(B+)=c(A-)
D.混合溶液中 c(OH-)= KW mol·L-1
解析:40 ℃时水的离子积常数 KW>1.0×10-14,溶液呈中性时,
pH<7,故 pH=7 的溶液呈碱性,A 错误;混合溶液的 c(H+)=c(OH
-),则该溶液呈中性,B 正确;混合溶液呈电中性,据电荷守恒可得
c(B+)+c(H+)=c(A-)+c(OH-),若溶液中,c(B+)=c(A-),故 c(H+)
=c(OH-),则该溶液呈中性,C 正确;在水溶液中,KW=c(H+)·c(OH
-),将 c(OH-)= KW mol·L-1 代入可得 c(H+)= KW mol·L-1,此时
c(H+)=c(OH-),则该溶液呈中性,D 正确。
4.常温下,0.1 mol·L-1 某一元酸(HA)溶液中cOH-
cH+
=1.0×10-
8,则下列叙述中正确的是( D )
A.该一元酸溶液的 pH=1
B.该溶液中由水电离出的 c(H+)=1.0×10-3 mol·L-1
C.该溶液中水的离子积常数为 1.0×10-22
D.用 0.1 mol·L-1 NaOH 溶液 V1 L 与 V2 L 0.1 mol·L-1 该一元酸
(HA)溶液混合,若混合溶液的 pH=7,则 V1
7
D.常温下,测定 0.01 mol·L-1NH4Cl 溶液的 pH 小于 7,可证明
NH3·H2O 为弱电解质
解析:pH=a 的 Na2A 溶液中 OH-全部来源于水的电离,则由
水电离产生的 c(OH-)=10a-14 mol·L-1,A 错误。pH 均为 3 的醋酸
和盐酸等体积混合,若醋酸的电离程度不变,则混合液的 pH 仍为 3,
实际上盐酸抑制了醋酸的电离,故混合液的 pH>3,B 错误。若 HA
为强酸,与 pH=11 的 NaOH 溶液等体积混合,二者恰好完全反应生
成 NaA,溶液的 pH=7;若 HA 为弱酸,pH=3 的 HA 溶液与 pH=
11 的 NaOH 溶液等体积混合,反应后 HA 溶液剩余,溶液显酸性,
综述可知,所得溶液的 pH≤7,C 错误。常温下,0.01 mol·L-1 NH4Cl
溶液的 pH<7,说明 NH +
4 发生了水解反应,从而推知 NH3·H2O 为弱
电解质,D 正确。
6.关于下列各实验或装置的叙述中,不正确的是( D )
A.实验①可用于测溶液 pH
B.实验②是用酸性 KMnO4 溶液滴定
C.装置③是滴定操作时手的操作
D.装置④中最后一滴 NaOH 标准液使溶液由无色变为红色,即
达到滴定终点
解析:A、B、C 三项均正确;装置④中最后一滴 NaOH 标准液
使溶液由无色变为红色,半分钟不恢复成原来的颜色,即达到滴定终
点,D 项错误。
7.实验室用标准盐酸溶液测定某 NaOH 溶液的浓度,用甲基橙
作指示剂,下列操作中可能使测定结果偏低的是( C )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗 2~3 次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡
消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面
所在刻度
D.盛 NaOH 溶液的锥形瓶滴定前用 NaOH 溶液润洗 2~3 次
解析:A 项,所用的盐酸的实际用量大于理论用量,故导致测定
结果偏高;B 项,这种操作会导致盐酸读数偏大,测出 NaOH 溶液
浓度也偏高;C 项,由黄色变为橙色可能是由于局部 c(H+)变大引起
的,振荡后可能还会恢复黄色,应在振荡后半分钟内颜色保持不变才
能认为已达到滴定终点,故所用盐酸的量比理论用量偏小,测出的
NaOH 溶液浓度偏低;D 项,用 NaOH 溶液润洗,直接导致盐酸的
用量偏大,故测定 NaOH 浓度偏高。
8.298 K 时,用 0.100 0 mol·L-1 稀硫酸滴定 20.00 mL 0.100 0
mol·L-1 氨水,溶液中水的电离程度随所加稀硫酸体积的变化如图所
示。下列说法中不正确的是( D )
A.该实验可选择甲基橙作指示剂
B.从 P 点到 N 点,溶液中水的电离程度先增大后减小
C.M 点对应的溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.N 点对应的溶液中:c(NH+
4 )+c(NH3·H2O)=2c(SO2-
4 )
解析:达到滴定终点时,溶质为硫酸铵,水解后溶液呈酸性,可
选用甲基橙作指示剂,A 项正确;从 P 点到 M 点,碱性逐渐减弱,
溶液中水的电离程度增大,从 M 点到 N 点,溶液中水的电离程度减
小,B 项正确;M 点溶质为硫酸铵,对应的溶液中存在质子守恒:c(H
+)=c(OH-)+c(NH3·H2O),C 项正确;N 点溶质为等物质的量的
H2SO4 和 NH3·H2O,N 原子与 S 原子物质的量之比为 1∶1,对应的
溶液中物料守恒式为 c(NH+
4 )+c(NH3·H2O)=c(SO2-
4 ),D 项错误。
9.对于常温下 pH=1 的硝酸溶液,有下列相关叙述,其中正确
的是( A )
①该溶液 1 mL 稀释至 100 mL 后,pH=3 ②向该溶液中加入
等体积、pH=13 的氢氧化钡溶液恰好完全中和 ③该溶液中硝酸电
离出的 c(H+)与水电离出的 c(H+)比值为 1×10-12 ④向该溶液中加
入等体积、等浓度的氨水,所得溶液 pH=7
A.①② B.①③ C.②④ D.③④
解析:pH=1 的硝酸溶液 c(H + )=0.1 mol·L - 1 ,①c= n
V
=
0.1 mol·L-1×0.001 L
0.1 L
=0.001 mol·L-1,pH=3,故①正确;②pH=
13 的氢氧化钡溶液 c(OH-)=0.1 mol·L-1,等体积混合恰好完全中和,
故②正确;③硝酸电离出的 c(H + )=0.1 mol·L - 1 ,由 KW =c(H
+)×c(OH-)=10-14 可知,水电离出的 c(H+)=10-13 mol·L-1,该溶液
中硝酸电离出的 c(H+)与水电离出的 c(H+)之比为 1012,故③错误;
④反应生成强酸弱碱盐 NH4NO3,NH +
4 发生水解,使反应后溶液呈
酸性,故④错误。
10.常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定相同浓度的 20 mL
一元弱酸 HA 溶液,滴定过程中溶液的 pH 随滴定分数(滴定分数=
滴定用量
总滴定用量)的变化曲线如图所示(忽略中和热效应),下列说法中不正
确的是( C )
A.HA 溶液加水稀释后,溶液中cHA
cA-
的值减小
B.当滴定分数为 1 时,溶液中水的电离程度最大
C.当滴定分数大于 1时,溶液中离子浓度关系一定是 c(Na+)>c(A
-)>c(OH-)>c(H+)
D.当滴定分数为 x 时,HA 的电离常数为 K(HA)=(10-7x)/(1-
x)
解析:在 HA 溶液中存在电离平衡:HA H++A-,cHA
cA-
=
cHA
cA-×cH+
×c(H+)= 1
KHA
×c(H+),加水稀释,c(H+)减小,则溶
液中cHA
cA-
的值减小,A 项正确;当滴定分数为 1 时,二者恰好完全
反应,溶液中的溶质为 NaA,属于强碱弱酸盐,促进水的电离,溶
液中水的电离程度最大,B 项正确;当滴定分数大于 1 时,溶液中离
子浓度关系可能是 c(Na+ )>c(A- )>c(OH- )>c(H + )、也可能是 c(Na
+ )>c(OH - )>c(A - )>c(H + ),C 项错误;HA 的电离常数 K(HA)=
cH+·cA-
cHA
=10-7 x
1-x
,D 项正确。
11.已知 H2A 为二元弱酸,室温下向 100.0 mL 0.1 mol·L-1 H2A
溶液中加入不同质量的 NaOH 固体,pH 变化如下表(不考虑溶液体
积变化)。下列分析正确的是( D )
m(NaOH)/g 0 0.4 0.8 1.2
pH 3.8 8.3 12.0 13.2
A.H2A 第一步电离 K1 的数量级为 10-8
B.上述过程中水的电离程度一直增大
C.m(NaOH)=0.6 g 时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.若溶液中加 NaOH 至cHA-
cA2-
=100 时,c(OH-)>100c(H+)
解析:初始时,0.1 mol·L-1 H2A 溶液的 pH=3.8,根据氢离子浓
度的近似计算公式 c(H+)= Ka1×c= Ka1×0.1=10-3.8 mol·L-1,所
以 Ka1=10-6.6,其数量级为 10-7,A 错误。初始时,0.1 mol·L-1 H2A
溶液对于水的电离一定是抑制,随着 H2A 逐渐被中和,转化为盐,
则变成对水的电离产生促进,最后氢氧化钠过量,再对水的电离产生
抑制,B 错误。加入的氢氧化钠为 0.6 g(0.015 mol)时,溶液为浓度相
等的Na2A和NaHA混合溶液,由表中数据得到此时溶液一定显碱性,
因为 A2-的水解能力强于 HA-,且 A2-水解得到 HA-,所以 c(A2
-)8 时,一定有 c(OH-)>100c(H+),D 正确。
12.常温下,向浓度均为 0.1 mol·L-1 体积均为 10 mL 的两种一
元酸(HX、HY)溶液中,分别滴入 0.1 mol·L-1 NaOH 溶液,pH 的变
化曲线如图所示。下列说法中错误的是 ( A )
A.N 点:c(Na+)=c(Y-)+c(HY)
B.M 点:c(X-)>c(Na+)
C.滴至 pH=7 时,消耗 NaOH 溶液的体积:HX 溶液>HY 溶
液
D.滴入 10 mL NaOH 溶液时,溶液中水的电离程度:HX 溶液
c(Na+),
B 项正确;据图可知,浓度均为 0.1 mol·L-1 的两种一元酸 HX、HY
溶液的 pH 大小关系为 pH(HX)HY,因
酸性越弱其对应的阴离子水解程度越大,所以滴至 pH=7 时,消耗
NaOH 溶液的体积:HX 溶液>HY 溶液,C 项正确;滴入 10 mL NaOH
溶液时,HX 和 HY 均恰好完全反应分别得到 NaX 溶液和 NaY 溶液,
因酸性:HX>HY,则 X-的水解程度小于 Y-的水解程度,溶液中水
的电离程度:HX 溶液c(OH-),C 项错误;溶液 pH 由 1 升至 2.6 时,从图中看出
主要是将 H3X+转化为 H2X,D 项错误。
14.水溶液是中学化学的重点研究对象。
(1)水是极弱的电解质,也是最重要的溶剂。常温下,某电解质
溶解在水中后,溶液中 c(H+)=1×10-9 mol·L-1,则该电解质可能是
________(填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)已知 HClO 是比 H2CO3 还弱的酸,要使新制稀氯水中的
c(HClO)增大,可采取的措施有(至少答两种)___________________。
(3)常温下,将 pH=3 的盐酸 a L 分别与下列三种溶液混合,所
得溶液均呈中性。
①浓度为 1.0×10-3 mol·L-1 的氨水 b L;②c(OH-)=1×10-3
mol·L-1 的氨水 c L;③c(OH-)=1×10-3 mol·L-1 的氢氧化钡溶液 d
L,则 a、b、c、d 之间的大小关系是________。
(4)强酸制弱酸是水溶液中的重要经验规律。
已知 HA、H2B 是两种弱酸,存在以下关系:H2B(少量)+2A-
===B2-+2HA,则 A-、B2-、HB-三种阴离子结合 H+的难易顺序为
________。
(5)已知:H2A===H++HA-、HA- H++A2-,常温下,0.1
mol·L-1NaHA 溶液的 pH=2,则 0.1 mol·L-1H2A 溶液中 c(H+)的大
小范围是____________;NaHA 溶液中各离子浓度大小关系为
____________。
解析:(1)常温下,水的离子积为 KW=c(H+)·c(OH-)=1×10-14,
溶液中 c(H+)=1×10-9 mol·L-1,则有 c(OH-)=1×10-5 mol·L-1,该
溶液呈碱性。HCl 和 CuSO4 溶液都呈酸性,Na2S 和 NaOH 溶液呈碱
性,K2SO4 溶液呈中性。(2)新制稀氯水中存在平衡:Cl2+H2O HCl
+HClO、HClO H++ClO-,由于酸性:HCl>H2CO3>HClO,要
使新制氯水中 c(HClO)增大,可采取的措施有通入 Cl2 或加入碳酸钙
等,使平衡 Cl2+H2O HCl+HClO 正向移动,或加入 NaClO 等,
使平衡 HClO H++ClO-逆向移动。(3)HCl 是强酸,Ba(OH)2 是
强碱,均完全电离;NH3·H2O 是弱碱,部分发生电离。①a L pH=3
的盐酸与浓度为 1.0×10-3 mol·L-1 的氨水 b L 混合,若恰好完全反
应生成 NH4Cl,由于 NH +
4 发生水解而使溶液呈酸性,而所得溶液呈
中性,则有 b>a;②a L pH=3 的盐酸与 c(OH-)=1×10-3 mol·L-1
的氨水 c L 混合,所得溶液呈中性,则有 a>c;③a L pH=3 的盐酸
与 c(OH-)=1×10-3mol·L-1 的氢氧化钡溶液 d L 混合,所得溶液呈
中性,则有 a=d;综上所述,a、b、c、d 之间的大小关系是 b>a=
d>c。(4)据反应 H2B(少量)+2A-===B2-+2HA 可得,A-结合 H+的
能力强于 HB-和 B2-;H2B 是弱酸,第一步电离生成 HB-,第二步
电离生成 B2-,而第二步比第一步更难电离,故 B2-结合 H+能力强于
HB-,因此三种阴离子结合 H+的难易顺序为 A->B2->HB-。(5)H2A
第一步完全电离生成 HA-和 H+,HA-则部分电离生成 H+和 A2-,
故 0.1 mol·L-1 H2A 溶液中 c(H+)>0.1 mol·L-1;常温下,0.1 mol·L-1
NaHA 溶液的 pH=2,则 HA-电离产生 c(H+)=0.01 mol·L-1,由于
第一步电离产生 H+抑制 HA-的电离,故 0.1 mol·L-1 H2A 溶液中 HA
-电离产生 c(H+)<0.01 mol·L-1,故该溶液中 c(H+)的大小范围是 0.1
mol·L-1c(OH-);由于 Na+不水解,HA-的电离程
度较小,故溶液中离子浓度大小关系为 c(Na+)>c(HA-)>c(H+)>c(A2
-)>c(OH-)。
答案:(1)CD (2)再通入氯气、加入碳酸钙、加入次氯酸钠等
(3)b>a=d>c (4)A->B2->HB-
(5)0.1 mol·L-1c(HA-)>c(H+)>c(A2-)>c(OH-)
15.蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐
折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为 SO2,然
后通过碘标准溶液滴定吸收液。
实验步骤如下:
Ⅰ.SO2 含量的测定
烧瓶 A 中加中药粉 10 g,加蒸馏水 300 mL;锥形瓶中加蒸馏水
125 mL 和淀粉溶液 1 mL 作为吸收液;打开冷凝水,通氮气,滴入
盐酸 10 mL;加热烧瓶 A 并保持微沸约 3 min 后,用 0.010 00 mol·L
-1 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液 V1 mL。
Ⅱ.空白实验
只加 300 mL 蒸馏水,重复上述操作,需碘标准溶液体积为 V0
mL。
(1)仪器 C 的名称为________。仪器 B 的入水口为________(填“a”
或“b”)。
(2)滴入盐酸前先通氮气一段时间的作用是________________。
测定 过程 中氮气 的流速 过快 会导致 测量结 果________(填“ 偏
大”“偏小”或“不变”)。
(3)①滴定过程中使用的滴定管为________。
A.无色酸式滴定管 B.棕色酸式滴定管
C.无色碱式滴定管 D.棕色碱式滴定管
②滴定时锥形瓶中反应的离子方程式为______________,滴定终
点的现象是______________。
(4)空白实验的目的是____________________________________
______________________________________________________。
(5)该中药粉中 SO2 的含量为________mg/kg。
解析:(1)仪器 C 下端有旋塞,应是分液漏斗。仪器 B 应该起到
冷凝作用,冷却水应该下口入上口出,所以入水口为 b。(2)二氧化硫
是强还原性物质,容易被氧化,所以先通入 N2 将装置内的空气排净,
避免氧气将二氧化硫氧化。氮气的流速如果过快,会使一部分的二氧
化硫来不及溶解在水中就被氮气带出,所以导致结果偏小。(3)①碘
会腐蚀碱式滴定管下端的橡胶管,所以只能用酸式滴定管。同时,碘
标准溶液实际是将碘溶解在碘化钾溶液中制得的,此时单质碘与碘离
子作用形成 I-
3 ,既增大了碘的溶解度又避免了碘的挥发,而光照会
促进 I -
3 的分解,所以使用棕色酸式滴定管。②滴定时,单质碘将二
氧化硫氧化为硫酸,离子方程式为 I2+SO2+2H2O===4H++SO2-
4 +
2I-。达到滴定终点时,二氧化硫都被反应完,加入的单质碘遇淀粉
溶液显蓝色,所以终点的现象为当滴入最后一滴碘标准溶液时,锥形
瓶内溶液由无色变为蓝色,且在 30 s 内不变色。(5)用于氧化二氧化
硫的碘标准液体积为(V1-V0)mL,其物质的量为0.010 00V1-V0
1 000
mol,所以二氧化硫的物质的量也是0.010 00V1-V0
1 000 mol,质量为
0.64V1-V0
1 000 g,为 10 g 中药粉中的含量,所以 1 kg 中药粉中有
64V1-V0
1 000 g SO2,即有 64(V1-V0) mg SO2。
答案:(1)分液漏斗 b
(2)排出装置内的空气,避免空气中的 O2 干扰 SO2 的测定 偏小
(3)①B ②I2+SO2+2H2O===4H++SO2-
4 +2I- 当滴入最后一
滴碘标准溶液时,锥形瓶内溶液由无色变为蓝色,且在 30 s 内不变
色
(4)消除其他试剂、实验操作等因素引起的误差
(5)64(V1-V0)