- 2021-07-02 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年湖北省十堰市竹溪一中、竹山一中等三校高二9月月考化学试题 Word版
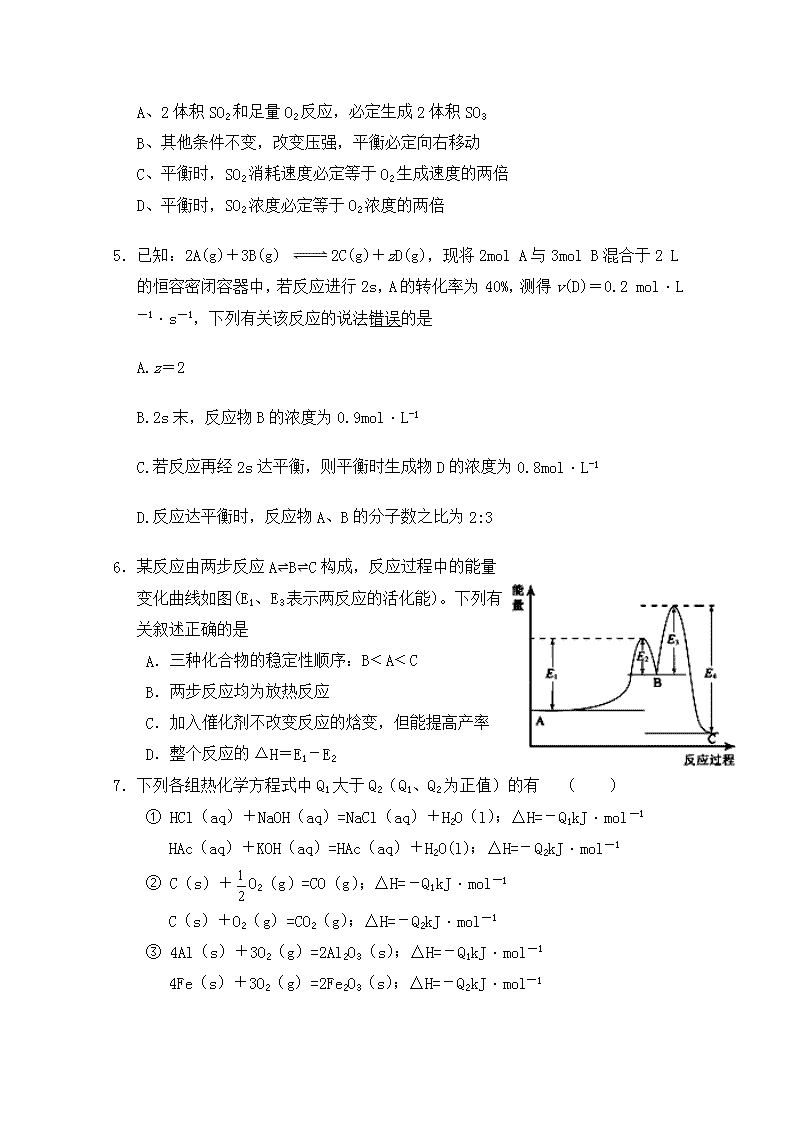
湖北省十堰市竹溪一中、竹山一中等三校2019-2020学年高二9月月考 化 学 试 题 时限:90分钟 满分:100分 相对原子量:C:12 H:1 O:16 N:14 Na:23 Mg:24 Al:27 第I卷(选择题,共48分) 一、选择题(每小题只有一个最佳选项,共16题,每题3分,共48分) 1、下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 A B C D 强电解质 Cu NaCl CaCO3 HNO3 弱电解质 CH3COOH NH3 Al(OH)3 Fe(OH)3 非电解质 酒精 BaSO4 SO2 O2 2、下列化学实验基本操作中,正确的是 A、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中并搅拌 B、用量筒量取液体时,视线与量筒内液体液面保持水平 C、用滴管滴加液体时,为防止液滴飞溅,滴管紧贴试管内壁 D、用用托盘天平称量物质时,称量物放在左盘,砝码放在右盘 3.下列说法正确的是 A.放热反应一定是断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少 B.1mol H2SO4和1mol Ba(OH)2完全反应所放出的热量称为中和热 C.反应物的总能量低于生成物的总能量的化学反应为放热反应 D.在化学反应中需要加热的反应就是吸热反应 4.对于反应2SO2+O2 2SO3,下列判断正确的是 A、2体积SO2和足量O2反应,必定生成2体积SO3 B、其他条件不变,改变压强,平衡必定向右移动 C、平衡时,SO2消耗速度必定等于O2生成速度的两倍 D、平衡时,SO2浓度必定等于O2浓度的两倍 5.已知:2A(g)+3B(g) 2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2s,A的转化率为40%,测得v(D)=0.2 mol·L-1·s-1,下列有关该反应的说法错误的是 A.z=2 B.2s末,反应物B的浓度为0.9mol·L-1 C.若反应再经2s达平衡,则平衡时生成物D的浓度为0.8mol·L-1 D.反应达平衡时,反应物A、B的分子数之比为2:3 6.某反应由两步反应ABC构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是 A.三种化合物的稳定性顺序:B﹤A﹤C B.两步反应均为放热反应 C.加入催化剂不改变反应的焓变,但能提高产率 D.整个反应的ΔH=E1-E2 7.下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有 ( ) ① HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1 HAc(aq)+KOH(aq)=HAc(aq)+H2O(l);△H=-Q2kJ·mol-1 ② C(s)+O2(g)=CO(g);△H=-Q1kJ·mol-1 C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1 ③ 4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1 4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1 ④ H2(g)+O2(g)=H2O(g);△H=-Q1kJ·mol-1 H2(g)+O2(g)=H2O(l);△H=-Q2kJ·mol-1 A.①② B.③④ C.②④ D.①③ 8.在容积一定的密闭器中发生可逆反应: A(g)+2B(g) 2C(g) △H =+Q (Q>0),条件变化时,影响平衡移动的关系如图所示。下列说法不正确的是 A.,纵坐标指A的质量分数 B.,纵坐标指C的质量分数 C.,纵坐标指混合气体的平均摩尔质量 D.,纵坐标指A的转化率 9.在一定条件下,发生CO+NO2CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是 A.正反应为吸热反应 B.正反应为放热反应 C.降温后CO的浓度增大 D.降温后各物质的浓度不变 10.在某温度下,将3 mol A和2 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为 A.20 % B.60 % C.40% D.50% 11.下列四种烃的名称所表示的物质,命名正确的是 ( ) A.2,4,4—三甲基戊烷 B.2-甲基-2—乙基丁烷 C.3—甲基—2—丁烯 D.2—甲基—2—丁烯 12.已知某有机物的结构简式如下,下列有关该分子的说法正确的是( ) A.分子式为C10H14O6 B.含有的官能团为羟基、羧基两种 C.该分子能发生取代、氧化和加成等反应 D.它属于芳香烃 13.某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2 + O2 == 2H2O,下列有关说法正确的是 A.电子通过外电路从b极流向a极 B.b极上的电极反应式为: O2 + 2H2O + 4e- == 4OH- C.每转移0.1mol电子,消耗1.12L的H2 D.H+由a极通过固体酸电解质传递到b极 14.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是 A.体积相等时密度相等 B.原子数相等时具有的中子数相等 C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等 15.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是 A.原子半径的大小顺序:r(Y)>r(Z)>r(W) B.元素Z、W的简单离子的电子层结构相同 C.元素Y的简单气态氢化物的热稳定性比Z的强 D.只含X、Y、Z三种元素的化合物,只能是离子化合物 16、某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;将沉淀过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( ) A.至少存在5种离子 B. Cl-一定存在,且c(Cl-)≥0.4mol/L C . SO42-、NH4+一定存在,Cl-可能不存在 D. CO32-、Al3+一定不存在,K+可能存在 第II卷(非选择题,共52分) 17.(8分)已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得: 2CH3OH(g)CH3OCH3(g)+ H2O(g)△H=+23.5kJ•mol-1. 在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题: (1)该条件下反应平衡常数表达式K= ______ .在t1℃时,反应的平衡常数为 ______ .用CH3OH表示的化学反应速率 ______ . (2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.6mol•L-1、c(H2O)=0.6mol•L-1、c(CH3OCH3)=1.2mol•L-1,此时正、逆反应速率的大小:v (正) ______ v (逆)(填“>”、“<”或“=”). 18.(10分)I.某可逆反应在某体积为5L的密闭容器中进行,在从0~3min各物质的量的变化情况如图所示(A、B、C均为气体) (1)该反应的的化学方程式为 。 (2)反应开始至2min时,B的平均反应速率为_____________________。 (3)能说明该反应已达到平衡状态的是 。 a.v(A)= 2v(B) b.容器内压强保持不变 c.v逆(A)= v正(C) d.容器内混合气体的密度保持不变 (4)由如图求得A的平衡时的转化率为 。 Ⅱ.(5)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表 共价键 H—H N—H N≡N 能量变化/kJ·mol-1 436 390.8 946 则合成氨反应:N2(g) + 3H2 (g) 2NH3(g) H = 。 19、(14分)50mL 0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热,回答下列问题: (1)烧杯间填满碎泡沫塑料的作用是______________________________________ (2)如用铜制搅拌棒代替玻璃搅拌棒,求得的中和热数值______________(填“有”“无”)影响. (3)实验中改用60ml0.50mol/L盐酸进行反应,与上述实验相比,所放出的热量__________ (填“相等”、“不相等”),所求中和热____________(填“相等”、“不相等”),简述理由_________________________________________________________ (4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________________ 填“偏大”、“偏小”“无影响”). (5)若混合物温度上升的平均值为t0C,则利用上述方法测定中和热为△H=__________________________________(用简单数据和含t计算式表示) 20.(8分)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式 ①H2(g)+O2(g)= H2O(g) H =﹣242kJ/mol; ②2H2(g)+ O2(g)= 2H2O(l) H =﹣572kJ/mol; ③C(s)+O2(g)= CO(g) H =﹣110.5kJ/moL; ④C(s)+ O2(g)= CO2(g) H =﹣393.5kJ/moL; ⑤CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)H = + 802kJ/moL 回答下列问题 化学键 OO=O CC-C HH-H OO-O CC-O OO-H CC-H 键能kJ/mol 4497 3348 4436 1142 3351 4463 4414 (1)写出能表示H2燃烧热的热化学方程_________________________________________________________。 (2)由①和③借助盖斯定律可知C(s)+ H2O(g) = H2(g)+ CO(g)H = ___________ kJ/moL; (3) 由⑤借助键能算反应热推算出C=O键能为_______________________kJ/moL。 (4) 由①②和⑤借助盖斯定律推知CH4的燃烧热△H = — ___________ kJ/moL。 21.(12分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题: (1)用太阳能分解10mol水消耗的能量是_____________kJ; (2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________; (3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃); 下列说法正确的是________(填序号) ①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为 v(CH3OH)= mol·L-1·min-1 ②该反应在T1时的平衡常数比T2时的小 ③该反应为放热反应 ④处于A点的反应体系从T1变到T2,达到平衡时增大 (4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______; (5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。 参 考 答 案 一、 选择题: 1、C 2、D 3、A 4、C 5、C 6、A 7、D 8、A 9、B 10、B 11、D 12、C 13、D 14、C 15、B 16、B 二、17、(1)K=c(CH3OCH3)c(H2O)/c2(CH3OH); 5.0; 1.6/t1(mol.L-1.min-1) (2) > 18、(1)2A+B2C (2) 0.1 mol.L-1.min-1 (3) b、c (4) 40%; (5) -- 90.8kJ/mol 19、(1)保温隔热,减少实验过程中热量损失。 (2)有 (3)不相等;相等;盐酸用量增多,参加反应的酸碱量增多,反应放出的热量更多。但折算出生成1摩尔水放出热量相同,即中和热相等。 (4)偏小; (5)--0.418t/0.025KJ/mol 20、(1)H2(g)+1/2O2(g)=H2O(l) H =﹣286kJ/moL (2) +131.5 (3) 800 (4) 890 21、27.(1)2858 (2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443.5kJ· mol-1; (3)③④ (4) (5)CH3OH+H2O—6e- =CO2+6H+- 查看更多