- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高三化学下学期第六次诊断考试试题(新版)新人教版
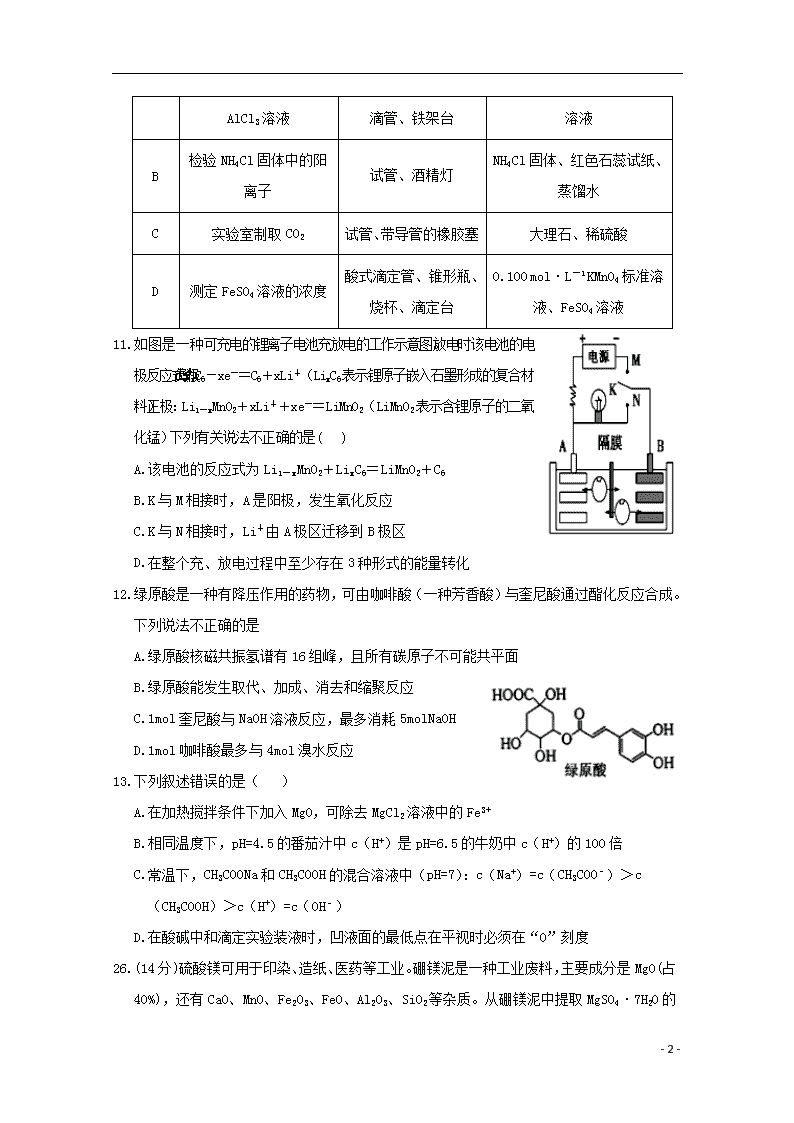
2019学年度高三第六次诊断考试 化 学 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Fe 56 Cu 64 Au 197 第I卷 一、选择题:(共 13小题,每小题6分,共78分,每小题只有一个选项正确,有选错的或不答的得0分) 7.下列说法错误的是 A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 B.盐酸、福尔马林、漂粉精、碱石灰都是混合物 C.直径在10-9 ~ 10-7m的NaCl固体小颗粒分散到水中能形成胶体 D.“陶成雅器”的主要原料是黏土 8.设NA代表阿伏加德罗常数的值,下列说法正确的是( ) A.常温常压下,11.2L氧气所含的氧原子数为NA B.46gNO2和N2O4混合物含有的原子数为3 NA~6 NA之间 C.1mol·L-1的CaCl2溶液中含有的Cl-为2NA D.1mol羟基中含有的电子数为9NA 9.W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不正确的是 A.原子半径:X>Y>Z>W B.Y位于第三周期第ⅢA族 C.W和X组成的化合物一定是碱性氧化物 D.向W、X、Y组成化合物的水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清 10.为实现下列实验目的,下表提供的主要仪器和所用试剂合理的是( ) 选项 实验目的 主要仪器 所用试剂 A 提纯混有MgCl2 待提纯的AlCl3 - 7 - 杂质的AlCl3溶液 烧杯、分液漏斗、胶头滴管、铁架台 溶液、NaOH溶液 B 检验NH4Cl固体中的阳离子 试管、酒精灯 NH4Cl固体、红色石蕊试纸、蒸馏水 C 实验室制取CO2 试管、带导管的橡胶塞 大理石、稀硫酸 D 测定FeSO4溶液的浓度 酸式滴定管、锥形瓶、烧杯、滴定台 0.100 mol·L-1 KMnO4标准溶液、FeSO4溶液 11.如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)下列有关说法不正确的是( ) A.该电池的反应式为Li1-xMnO2+LixC6=LiMnO2+C6 B.K与M相接时,A是阳极,发生氧化反应 C.K与N相接时,Li+由A极区迁移到B极区 D.在整个充、放电过程中至少存在3种形式的能量转化 12.绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法不正确的是 A.绿原酸核磁共振氢谱有16组峰,且所有碳原子不可能共平面 B.绿原酸能发生取代、加成、消去和缩聚反应 C.1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH D.1mol咖啡酸最多与4mol溴水反应 13.下列叙述错误的是( ) A.在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ B.相同温度下,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO﹣)>c(CH3COOH)>c(H+)=c(OH﹣) D.在酸碱中和滴定实验装液时,凹液面的最低点在平视时必须在“0”刻度 26.(14分)硫酸镁可用于印染、造纸、医药等工业。硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2 - 7 - O的流程如下: (1)实验中需用3mol·L-1的硫酸500mL,若用98%的浓硫酸(ρ=1.84g·mL-1)来配制,量取浓硫酸时,需使用的量筒的规格为 ________(填字母)。 A.10 mL B.20 mL C.50 mL D.100 mL (2)加入的NaClO可与Mn2+反应,方程式为( )Mn2++( )ClO-+( )===( )MnO2↓+( )+( ),补充完整上述反应;还有一种离子也会被NaClO氧化,该反应的离子方程式为_______________________________。 (3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有____________ ____。 (4)在“除钙”步骤前,若要检验混合液中是否还存在Fe2+,简述检验方法:_____________________________________。 (5)已知MgSO4、CaSO4的溶解度如下表(溶解度单位为g/100g水): 温度/℃ 40 50 60 70 MgSO4 30.9 33.4 35.6 36.9 CaSO4 0.210 0.207 0.201 0.193 “除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、_____。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,_________,便得到了MgSO4·7H2O。 27.(14分)为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。 方案I:利用FeO吸收CO2 获得H2 ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H1=-76.0kJ/mol 0.80 0 10 t/min C(CH4)/mol·L-1 ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) △H2=+113.4kJ/mol (1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=______。 (2)在反应i中,每放出38.0kJ热量,有_______gFeO 被氧化。 - 7 - 方案II:利用CO2制备CH4 300℃时,向2L恒容密闭容器中充入2molCO2 和8molH2,发生反应:CO2(g) +4H2(g)CH4(g) +2H2O(g) △H4,混合气体中CH4 的浓度与反应时间的关系如图所示。 (3)①从反应开始到恰好达到平衡时,H2 的平均反应速率v(H2) =_________。 ②300℃时,反应的平衡常数K=____________。 ③300℃时,向1L恒容密闭容器中充入2molCO2 和8molH2,发生反应,请在右图中画出c(CH4)随时间t变化趋势图。 ④300℃时,从反应开始至建立平衡的过程中容器中气体的密度 (填增大、减小或不变)。 (4)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则△H4______0(填“>”“<”或“=”)。 28.(15分)苯佐卡因(对氨基苯甲酸乙酯)常用于创面、溃疡面及痔疮的镇痛。在实验室用对氨基苯甲酸()与乙醇反应合成苯佐卡因,有关数据和实验装置图如下: 相对分子质量 密度 (g·cm-3) 熔点/℃ 沸点/℃ 溶解性 乙醇 46 0.79 -114.3 78.5 与水任意比互溶 对氨基苯甲酸 137 1.374 188 399.9 微溶于水,易溶于乙醇 对氨基苯甲酸乙酯 165 1.039 90 172 难溶于水,易溶于醇、醚类 产品合成: 在250mL圆底烧瓶中加入8.2g对氨基苯甲酸(0.06mol) 和80mL无水乙醇(约1.4mol),振荡溶解,将烧瓶置于冰水浴并加入10mL浓硫酸,将反应混合物在80℃水浴中加热回流1h,并不时振荡。 分离提纯: 冷却后将反应物转移到400mL烧杯中,分批加入10%Na2CO3溶液直至pH=9,转移至分液漏斗中,用乙醚(密度0.714g·cm-3 - 7 - ) 分两次萃取,并向醚层加入无水硫酸镁,蒸出醚层,冷却结晶,最终得到产物3.3g。 (1)仪器A的名称为______,在合成反应进行之前,圆底烧瓶中还应加入适量的______。 (2)分液漏斗使用之前必须进行的操作是__ _____,乙醚层应从分液漏斗______口放出;分离提纯操作加入无水硫酸镁的作用是___ ______。 (3)合成反应中加入远过量的乙醇目的是__ _____;分离提纯过程中加入10%Na2CO3溶液的作用是__ _____ 。 (4)本实验中苯佐卡因的产率为_________(保留3位有效数字)。该反应产率较低的原因是_________ (填标号)。 a.浓硫酸具有强氧化性和脱水性,导致副反应多 b.催化剂加入量不足 c.产品难溶于水,易溶于乙醇、乙醚 d.酯化反应是可逆反应 35.(15分)[化学一选修3:物质结构与性质]我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。 (1)Cu2+的未成对电子数有______个,H、O、S 电负性由大到小的顺序为_______。 (2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。 ①[Cu(NH3)4]SO4中化学键类型有_______,[Cu(NH3)4]2+ 的结构简式为_______,阴离子中心原子杂化类型为______。 ②氨的沸点远高于膦(PH3),原因是______________。 (3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因____________。 (4)金铜合金的一种晶体结构为立方晶型,如图所示。 ①该合金的化学式为____; ②已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。 36.(15分)[化学一选修5:有机化学基础]用石油产品烃A(质谱如图1)为主要原料,合成具有广泛用途的有机玻璃PMMA。流程如图2(部分产物和条件省略) - 7 - 试回答下列问题: (1)B的名称________;X试剂为_______(写电子式);D中官能团名称____ ____。 (2)E→G的化学方程式为__ __,反应类型是_________。 (3)T是G的同分异构体,1molT与足量新制Cu(OH)2悬浊液反应最多生成2molCu2O沉淀,T的结构有________种(不含立体结构)。 (4)I是A的同系物,相对分子质量相差14, I存在顺反异构体,写出反式I的结构简式_____ __。 (5)参照上述流程,以为原料合成(其它原料自选)。设计合成路线:_______ _________________。 高三化学参考答案 7.C 8.D 9.C 10.D 11.C 12.C 13.D 26.(14分每空2分) D H2O 2H+ Cl- 2Fe2++ClO-+2H+===2Fe3++Cl-+H2O MnO2 SiO2 取少量滤液,向其中加入紫色高锰酸钾溶液 ,若溶液紫色不变浅或褪色,则说明滤液中不含Fe2+;或者加入K3Fe(CN)6是否出现蓝色沉淀(加KSCN溶液与氯水不给分) 趁热过滤 过滤(或过滤洗涤) 27.(14分每空2分) +18.7kJ/mol 144 0.32 mol.L-1.min-1 25L2.mol-2 不变 < - 7 - 28. (15分) 球形冷凝管(1分) 沸石(或碎瓷片) (1分) 检查是否漏液 (1分) 上 ; 干燥吸水;(2分) 作溶剂,提高对氨基苯甲酸的转化率; (2分) 中和过量的浓硫酸和调节pH ;(2分)33.3%(或33.4%);(2分) a d(2分) 35.(15分) 1 O、S、H 共价键、配位键、离子键 sp3杂化 氨分子间存在氢键 金属晶体 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3 AuCu3(或Cu3Au) 36. 2—丙醇(或异丙醇)(1分) (2分) 羧基、羟基 (2分) (2分)酯化反应(或取代反应)(1分) 4 (2分) (2分) (3分每步1分) - 7 -查看更多