- 2021-07-02 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版化学平衡化学平衡常数作业
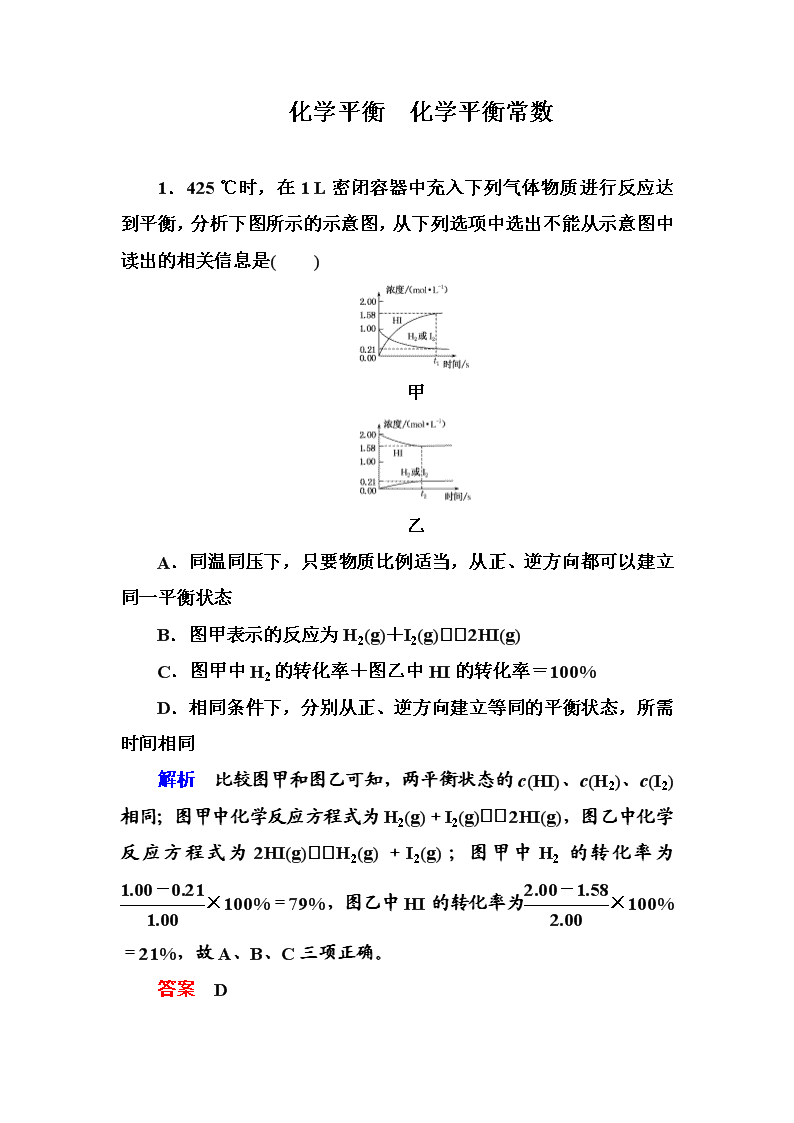
化学平衡 化学平衡常数 1.425 ℃时,在1 L密闭容器中充入下列气体物质进行反应达到平衡,分析下图所示的示意图,从下列选项中选出不能从示意图中读出的相关信息是( ) 甲 乙 A.同温同压下,只要物质比例适当,从正、逆方向都可以建立同一平衡状态 B.图甲表示的反应为H2(g)+I2(g)2HI(g) C.图甲中H2的转化率+图乙中HI的转化率=100% D.相同条件下,分别从正、逆方向建立等同的平衡状态,所需时间相同 解析 比较图甲和图乙可知,两平衡状态的c(HI)、c(H2)、c(I2)相同;图甲中化学反应方程式为H2(g)+I2(g)2HI(g),图乙中化学反应方程式为2HI(g)H2(g)+I2(g);图甲中H2的转化率为×100%=79%,图乙中HI的转化率为×100%=21%,故A、B、C三项正确。 答案 D 2.为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5 mL 0.5 mol·L-1 KI溶液,滴加0.1 mol·L-1 FeCl3溶液5~6滴,充分反应。下列实验操作能验证该反应是否存在限度的是( ) A.再滴加AgNO3溶液,观察是否有黄色沉淀产生 B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色 C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生 D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色 解析 发生反应:2FeCl3+2KI===2FeCl2+2KCl+I2,由于KI过量,主要检验是否存在Fe3+。 答案 D 3.已知450℃时,反应H2(g)+I2(g) 2HI(g)的K=50,由此推测在450℃时,反应2HI(g) H2(g)+I2(g)的化学平衡常数为( ) A.50 B.0.02 C.100 D.无法确定 解析 题中两反应互为逆反应,相同温度下,其化学平衡常数互为倒数,故所求反应的化学平衡常数为=0.02。 答案 B 4.恒温、恒压下,将1 mol O2和2 mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2(g)+O2(g) 2SO3(g),状态Ⅱ时达平衡,则O2的转化率为( ) A.60% B.40% C.80% D.90% 解析 恒温、恒压下,气体的体积比等于物质的量之比。设O2的转化率为x。 2SO2(g)+O2(g) 2SO3(g) n(始)/mol 2 1 0 n(变)/mol 2x x 2x n(平)/mol 2-2x 1-x 2x 有(2-2x)+(1-x)+2x=3×,解得x=0.6。 答案 A 5.在1 L定容的密闭容器中,可以证明可逆反应N2+3H22NH3已达到平衡状态的是( ) A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 B.一个N≡N断裂的同时,有3个H—H生成 C.其他条件不变时,混合气体的密度不再改变 D.v正(N2)=2v逆(NH3) 解析 c(N2)∶c(H2)∶c(NH3)=1∶3∶2等于化学方程式各物质的计量数之比,但不能说明各物质的浓度不变,不一定为平衡状态,A项错误;一个N≡N断裂的同时,有3个H—H生成,说明正、逆反应速率相等,反应达到了平衡,B项正确;混合气体的密度ρ=,质量在反应前后是守恒的,体积不变,密度始终不变,所以密度不变的状态不一定是平衡状态,C项错误;v正(N2)=2v逆(NH3)时,正、逆反应速率不相等,未达到平衡状态,D项错误。 答案 B 6.顺1,2二甲基环丙烷(g)和反1,2二甲基环丙烷(g)可发生如下转化: 该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1。下列说法错误的是( ) A.t1温度下,反应的平衡常数值K1=3 B.该反应的活化能Ea(正)小于Ea(逆) C.t2温度下,上图中表示顺式异构体的质量分数随时间变化的曲线为B曲线 D.由上图信息可以确定温度t2小于t1 解析 根据v(正)=k(正)c(顺),k(正)=0.006 s-1,则v(正)=0.006c(顺),v(逆)=k(逆)c(反),k(逆)=0.002 s-1,则v(逆)=0.002c(反),达到化学平衡状态时正逆反应速率相等,则0.006c(顺)=0.002c(反),该温度下反应的平衡常数值K1===3,选项A正确;该反应为放热反应,故该反应的活化能Ea(正)小于Ea(逆),选项B正确;随着时间的推移,顺式异构体的质量分数不断减少,则符合条件的曲线是B,选项C正确;设顺式异构体的起始浓度为x,由于可逆反应左右物质的化学计量数相等,均为1,则平衡时,顺式异构体为0.3x,反式异构体为0.7x,所以平衡常数K2==,因为K1>K2 ,放热反应升高温度时平衡逆向移动,所以温度t2>t1,选项D错误。 答案 D 7.一定条件下合成乙烯:6H2(g)+2CO2(g) CH2===CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是( ) A.M点的正反应速率v正大于N点的逆反应速率v逆 B.若投料比n(H2)∶n(CO2)=4∶1,则图中M点乙烯的体积分数为5.88% C.250 ℃,催化剂对CO2平衡转化率的影响最大 D.当温度高于250 ℃,升高温度,平衡逆向移动导致催化剂的催化效率降低 解析 化学反应速率随温度的升高而加快,由图可得,催化剂的催化效率随温度的升高而降低,所以M点的正反应速率v正有可能小于N点的逆反应速率v逆,故A项错误;设开始投料n(H2)为4 mol,则n(CO2)为1 mol,如图当在M点平衡时二氧化碳的转化率为50%,列三段式得: 6H2(g)+2CO2(g) CH2===CH2(g)+4H2O(g) 开始(mol) 4 1 0 0 转化(mol) 1.5 0.5 0.25 1 平衡(mol) 2.5 0.5 0.25 1 所以乙烯的体积分数为0.25÷(2.5+0.5+0.25+1)×100%≈ 5.88%,故B项正确;催化剂不影响平衡转化率,只影响化学反应速率,故C项错误;根据图象,当温度高于250 ℃,升高温度,二氧化碳的平衡转化率降低,则说明平衡逆向移动,但催化剂与化学平衡没有关系,并不是平衡逆向移动导致催化剂的催化效率降低,故D项错误。 答案 B 8.O3是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下: 反应① O3O2+[O] ΔH>0 平衡常数为K1; 反应② [O]+O32O2 ΔH<0 平衡常数为K2; 总反应:2O33O2 ΔH<0 平衡常数为K。 下列叙述正确的是( ) A.降低温度,K减小 B.K=K1+K2 C.适当升温,可提高消毒效率 D.压强增大,K2减小 解析 降温,总反应平衡右移,K增大,A项错误;K1=、K2=、K==K1·K2,B项错误;升温,反应①右移,c([O])增大,提高消毒效率,C项正确;对于给定的反应,平衡常数只与温度有关,D项错误。 答案 C 9.某科研小组利用如下反应消除NO和CO的污染;2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=x kJ/mol。T ℃时,在容积为2 L的恒容密闭容器中充入2 mol NO和2 mol CO,保持温度不变,5 min时达到平衡状态,此时c(N2)=0.4 mol/L。下列说法中不正确的是( ) A.x<0 B.NO转化率α(NO)=80% C.0~5 min内,v(CO)=0.16 mol/(L·min) D.保持温度不变,若再向上述平衡体系中充入2 mol NO和2 mol CO,重新达到平衡时,c(N2)=0.8 mol/L 解析 该反应ΔS<0,若要自发,必须为放热反应,故ΔH<0,即x<0,故A项正确;5 min时达到平衡状态,c(N2)=0.4 mol/L,则n(N2)=0.4 mol/L×2 L=0.8 mol,根据方程式可知反应中Δn(NO)=Δn(CO)=1.6 mol,则NO的转化率α(NO)=×100%=80%,故B项正确;v(NO)===0.16 mol/(L·min),故C项正确;5 min时达到平衡状态,n(NO)=n(CO)=(2-1.6)mol=0.4 mol,则平衡时c(NO)=c(CO)=0.2 mol/L,又c(N2)=0.4 mol/L,可得c(CO2)=0.8 mol/L,所以该反应的平衡常数K==。保持温度不变,再充入2 mol NO和2 mol CO,平衡向右移动,假设重新达到平衡时,c(N2)=0.8 mol/L,则平衡转化率不变,各物质的量浓度分别为c(NO)=c(CO)=0.4 mol/L,c(CO2)=1.6 mol/L,Qc==≠K,故假设不成立,c(N2)=0.8 mol/L时,不是平衡状态,此时反应正向进行,达到新平衡时,c(N2)>0.8 mol/L,故D项错误。 答案 D 10.固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s) NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g),测得平衡时c(I2)=0.5 mol·L-1,反应①的平衡常数为20,则下列结论不正确的是( ) A.平衡时c(NH3)=5 mol·L-1 B.平衡时HI分解率为20% C.混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 D.平衡后缩小容器容积,NH4I的物质的量增加,I2的物质的量不变 解析 设碘化铵生成氨气和碘化氢的浓度为x 2HI(g) H2(g)+I2(g) 起始(mol·L-1) x 0 0 变化(mol·L-1) 1 0.5 0.5 平衡(mol·L-1) x-1 0.5 0.5 根据反应①的平衡常数为20,得x(x-1)=20,解得x=5 mol·L-1,c(NH3)=5 mol·L-1,A项正确;平衡时HI分解率为×100%=20%,B项正确;反应①固体生成气体,平均摩尔质量始终不变,反应②反应前后物质的量不变,平均摩尔质量始终不变,故混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志,C项正确;平衡后缩小容器容积,平衡①逆向移动,NH4I的物质的量增加,HI的物质的量降低,平衡②逆向移动,则I2的物质的量减小,D项错误。 答案 D 11.苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g) C8H8(g)+H2(g) ΔH=+120 kJ·mol-1 。某温度下,将0.40 mol苯乙烷充入2 L真空密闭容器中发生反应,测定不同时间该容器内气体的物质的量,得到数据如下表: 时间/min 0 10 20 30 40 n(C8H10)/mol 0.40 0.30 0.24 n2 n3 n(C8H8)/mol 0.00 0.10 n1 0.20 0.20 (1)当反应进行到20 min时,该段时间内H2的平均反应速率是__________________。 (2)该温度下,该反应的化学平衡常数是______。 (3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”),且正反应速率__________逆反应速率(填“大于”“小于”或“等于”)。 (4)对于反应C8H10(g) C8H8(g)+H2(g),下列说法正确的是__________(填选项字母)。 A.恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态 B.压强增大该反应的平衡常数也增大 C.在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1 解析 (1)将0.40 mol苯乙烷充入2 L真空密闭容器中发生反应,20 min后,剩余0.24 mol,减少了0.16 mol,则 C8H10(g) C8H8(g)+H2(g) 起始量/mol 0.40 0 0 变化量/mol 0.16 0.16 0.16 20 min量/mol 0.24 0.16 0.16 v(H2)===0.004 mol·L-1·min-1。 (2)由表中数据可知,反应进行到30 min时达到平衡,则 C8H10(g) C8H8(g)+H2(g) 起始量/(mol·L-1) 0.20 0 0 变化量/(mol·L-1) 0.10 0.10 0.10 30 min量/(mol·L-1) 0.10 0.10 0.10 化学平衡常数K==0.1。 (3)根据C8H10(g) C8H8(g)+H2(g) ΔH=+120 kJ·mol-1,可知C8H8(g)+H2(g) C8H10(g) ΔH=-120 kJ·mol-1,有30 kJ热量放出时,说明消耗H2的物质的量为0.25 mol,所以氢气转化率为×100%=50%。由于正、逆反应的平衡常数之积为1,而(2)中计算的平衡常数为0.1,故C8H8(g)+H2(g) C8H10(g)的平衡常数为10。 C8H8(g)+H2(g) C8H10(g) 起始量/(mol·L-1) 0.25 0.25 0 变化量/(mol·L-1) 0.125 0.125 0.125 某时刻量/(mol·L-1) 0.125 0.125 0.125 =8<10,故反应未达到平衡状态,反应向正方向进行,正反应速率大于逆反应速率。 (4)恒温恒容条件下C8H10(g)和C8H8 (g)生成速率相等,说明正、逆反应速率相等,该反应达到平衡状态,A项正确;平衡常数只与温度有关,压强增大该反应的平衡常数不变,B项错误;反应热与热化学方程式的书写有关,与实际参加反应的反应物的量无关,C项错误。 答案 (1)0.004 mol·L-1 ·min-1 (2)0.1 (3)50% 否 大于 (4)A 12.为妥善处理氯甲烷生产企业的副产物CCl4,以减少对其臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。 (1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。 实验 序号 温度 /℃ 初始CCl4 的浓度 /(mol·L-1) 初始H2 的浓度 /(mol·L-1) CCl4的平 衡转化率 1 110 0.8 1.2 A 2 110 1 1 50% 3 100 1 1 B ①此反应的化学平衡常数表达式为_______________________, 在110 ℃时平衡常数为________。 ②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。 ③实验2中,10 h后达到平衡,H2的平均反应速率为__________。 ④实验3中,B的值________(填选项字母)。 A.等于50% B.大于50% C.小于50% D.从本题资料无法判断 (2)120 ℃时,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。 ①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填选项字母)。 ②根据上图曲线,氢气的起始浓度为________ mol·L-1时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。你判断的依据是__________________________________________________。 解析 (1)因为CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃,所以在110 ℃或100 ℃时反应中各物质的状态均为气态,其平衡常数K=。110 ℃时,由实验2可知反应中各物质的平衡浓度均为0.5 mol·L-1,代入表达式计算得平衡常数为1。实验1和实验2的反应温度相同,所以其平衡常数相同,利用平衡常数相等,可以求出实验1中CCl4的平衡转化率为60%,大于50%。对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小。 (2)由图象可知,氢气的浓度越大反应速率越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2的起始浓度为2 mol·L-1 时,消耗CCl4的百分率变化曲线是c,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高的是a和b,此时氢气的浓度为4 mol·L-1。 答案 (1)①K= 1 ②大于 ③0.05 mol·L-1·h-1 ④D (2)①c ②4 从图中可见,4 mol·L-1的a、b曲线比2 mol·L-1的c、d曲线的CCl4的转化率和产物中CHCl3的百分含量的数值都高查看更多