2018-2019学年黑龙江省大庆实验中学高一下学期第一次月考化学(理科)试题
2018-2019学年黑龙江省大庆实验中学高一下学期第一次月考化学(理科)试题
答题要求 1. 本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间60分钟。
2. 可能用到的相对原子质量: H:1 C:12 N:14 O:16 Na:23 S:32
Fe:56 Al:27
第Ⅰ卷 选择题(共61分)
一、选择题(本大题共12小题,第小题3分,共36分,每小题只有一个选项符合题意。)
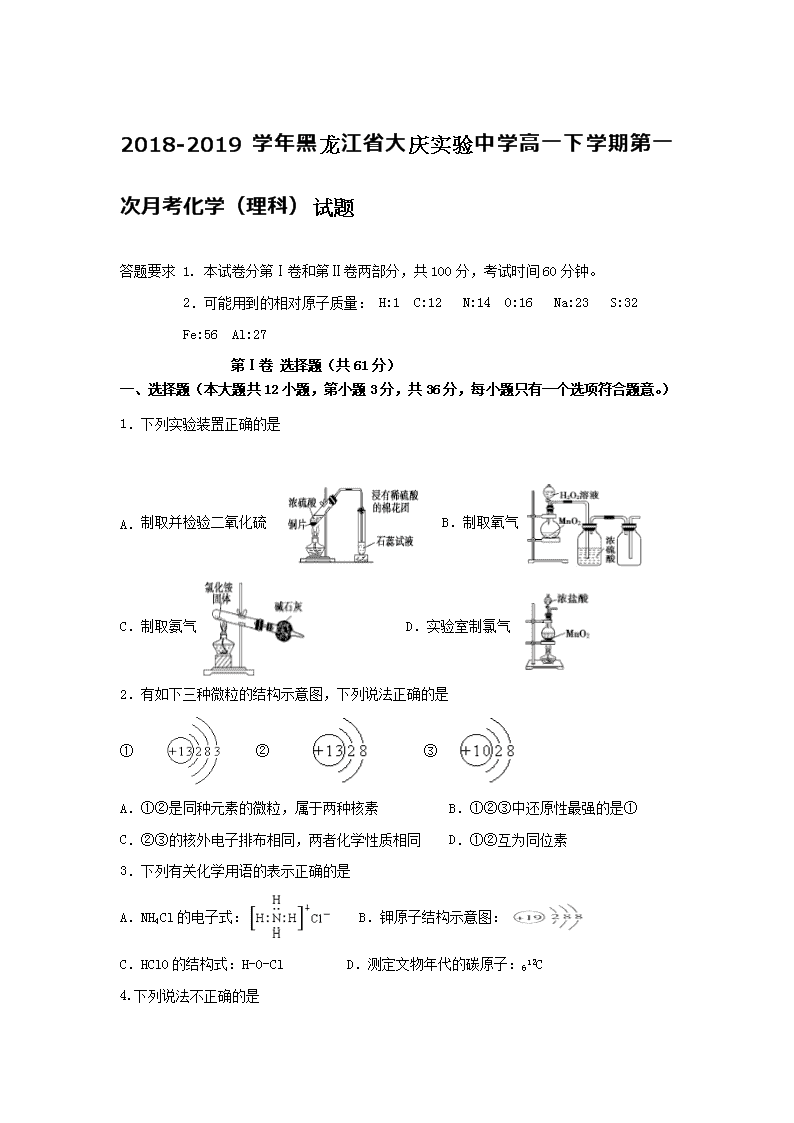
1.下列实验装置正确的是
A. 制取并检验二氧化硫 B.制取氧气
C.制取氨气 D.实验室制氯气
2.有如下三种微粒的结构示意图,下列说法正确的是
① ② ③
A.①②是同种元素的微粒,属于两种核素 B.①②③中还原性最强的是①
C.②③的核外电子排布相同,两者化学性质相同 D.①②互为同位素
3.下列有关化学用语的表示正确的是
A.NH4Cl的电子式: B.钾原子结构示意图:
C.HClO的结构式:H-O-Cl D.测定文物年代的碳原子:612C
4.下列说法不正确的是
A.卤素单质的熔沸点随着核电荷数的增大逐渐增大
B.碱金属单质的密度随着核电荷数的增大逐渐增大
C.卤素单质的颜色随着核电荷数的增大而加深
D.碱金属的熔沸点随着核电荷数的增大逐渐减小
5.W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是
A.原子半径大小为W < X < Y < Z B.氢化物水溶液酸性: X > Z
C. Y2W2与ZW2均含有极性共价键 D.X氢化物的沸点高于Z的氢化物的沸点
6.将0.02mol铜片溶于100mL9mol/LHNO3中,产生336mL气体(只含NO、NO2)。该气体与一定量O2混合后用水恰好完全吸收,则通入的O2体积为(气体体积均为标准状况)
A.22.4mL B.33.6mL C.44.8mL D.224mL
7.依据元素周期律,下列推断正确的是
A.酸性:H2SiO3>H2CO3 B.热稳定性:H2Se>H2S>H2O
C.碱性:CsOH>Ca(OH)2 D.若离子半径:R2->M+,则原子序数:R >M
8.元素周期表共有18个纵列,下列有关元素周期表的说法错误的是
A.第3列含有的元素种类最多 B.第14列元素所形成的化合物种类最多
C.第2列到第12列都是金属元素 D.最高价为+7的元素均在第17列
9.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,
说明NH4HCO3具有热不稳定性
D.将红热的Pt丝伸入上图所示的锥形瓶中,瓶口出现少量
的红棕色气体,说明氨气催化氧化的产物中有NO
10.元素周期表隐含着许多信息和规律。以下所涉及的元素均为中学化学中常见的短周期元素,其原子半径及主要化合价列表如下,其中R2Q2用于呼吸面具或潜水艇中作为氧气来源。
元素代号
M
R
Q
T
X
Y
Z
原子半径/nm
0.037
0.186
0.074
0.102
0.150
0.160
0.099
主要化合价
+1
+1
-2
+6 -2
+3
+2
-1
下列说法正确的是
A.T、Z的氧化物对应水化物的酸性T
Z>X B.X元素最高价氧化物的水化物酸性最强
C.Y元素的简单氢化物稳定性最强 D.Z单质难溶于化合物WZ2
17.下列反应的离子方程式正确的是
A.向碳酸氢钠溶液中滴入少量氢氧化钙溶液:Ca2−+2HCO3−+2OH–= CaCO3↓+ 2H2O+CO32+
B.向 FeBr2 溶液中通入足量氯气:2Fe2++4Br−+3Cl2=2Fe3++2Br2+6Cl−
C.在足量的稀硝酸中加入铁粉:3Fe+8H+ +2NO3–= 3Fe2++2NO↑+4H2O
D.向碳酸氢铵溶液中滴加少量氢氧化钠溶液:NH4++OH–= NH3·H2O
第Ⅱ卷 非选择题 (共39分)
三、填空题(本题包括3大题,共39分)
18.(12分)下表是元素周期表中的一部分。
根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是 ,氧化性最强的单质是 ,用一个化学反应证明H单质的氧化性强于G单质 。
(2)D的最高价氧化物与I的最高价氧化物对应的水化物反应的离子方程式为 。
(3)A分别与F、G、H形成的简单化合物中,稳定性由强到弱的顺序为 。
(4)B、C、D、G、I离子半径由大到小的顺序是 。
(5)用电子式表示化合物CI2的形成过程 。
19.(15分)隔绝空气加热至500℃时硫酸亚铁铵[(NH4)2Fe(SO4)2]能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行分步实验(夹持装置略)。
实验Ⅰ 甲同学为探究分解产物中的硫氧化物是 SO2 还是 SO3,连接装置A-E-F-B 进行实验。
(1)实验过程中观察到:E 中没有明显现象,F 中溶液褪色,据此得出的结论是 。
(2)B 的作用是 。
实验Ⅱ 验证分解产物中含有水蒸气和氨气,并探究残留固体成分。
(3)所选用装置的正确连接顺序为 (填装置的字母序号)。
(4)证明有水蒸气生成的实验现象为 。
(5)证明有氨气生成的实验现象为 。
(6)A 中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体中含有三价铁 。
(7)实验证明(NH4)2Fe(SO4)2 受热分解除上述产物外,还有N2 生成,写出A 中反应的化学方程式 。
20.(12分) 某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.为了用实验的方法验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
(1) 以上两实验方案实验现象较为明显的是方案 。
(2) 学生乙在实验中取了一段黑色的镁带,投入稀盐酸中,现象不十分明显,请分析原因 。
(3) 学生内另辟蹊径,不用镁、铝的单质,而用镁、铝的可溶盐及一些其它化学试剂,进行实验也得出正确的结论,简述学生丙用的是什么方法? 。
Ⅱ.学生丁设计了下图装置以验证硫、碳、硅元素的非金属性强弱。已知B是一种正盐,是工业生成玻璃的主要原料之一。
(1) 写出所选用物质的化学式:A: ,B: 。
(2)写出烧杯中发生反应的离子方程式: 。
月考试题答案
一、选择题
1
2
3
4
5
6
7
8
9
10
D
B
C
B
D
D
C
D
B
C
11
12
13
14
15
16
17
18
19
20
D
B
C
AB
D
A
AB
二、填空题
18.(12分)(1)Ne (1分) F2 (1分) 2F2+2H2O=4HF+O2 (2分)
(2)Al2O3+6H+=2Al3++3H2O(2分) (3)HF>H2O>NH3 (2分)
(4)O2->F->Na+>Mg2+>Al3+(2分) (5) MgCl2的形成过程(略)(2分)
19.(15分)(1)分解产物中有SO2没有SO3 (2分) (2) 吸收SO2防止污染空气 (2分)
(3) ACBD (2分) (4)C中无水硫酸铜变蓝色 (2分) (5) D中溶液变红色(2分)
(6) 取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量KSCN溶液,溶液变红色,说明含三价铁(2分)
(7)2(NH4)2Fe(SO4)2 Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑(3分)
20.(12分)I.(1)方案二 (2分) (2)未除去镁表面的氧化膜(2分) (3)取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH)3,溶解,而Mg(OH)2则不溶(2分)
Ⅱ.(1)H2SO4(2分) ;Na2CO3 (2分)
(2)CO2+SiO32-+H2OH2SiO3↓+CO32- 或:2CO2+SiO32-+2H2OH2SiO3↓+2HCO3-(2分)