- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届青海省西宁五中高二上学期期末考试(2017
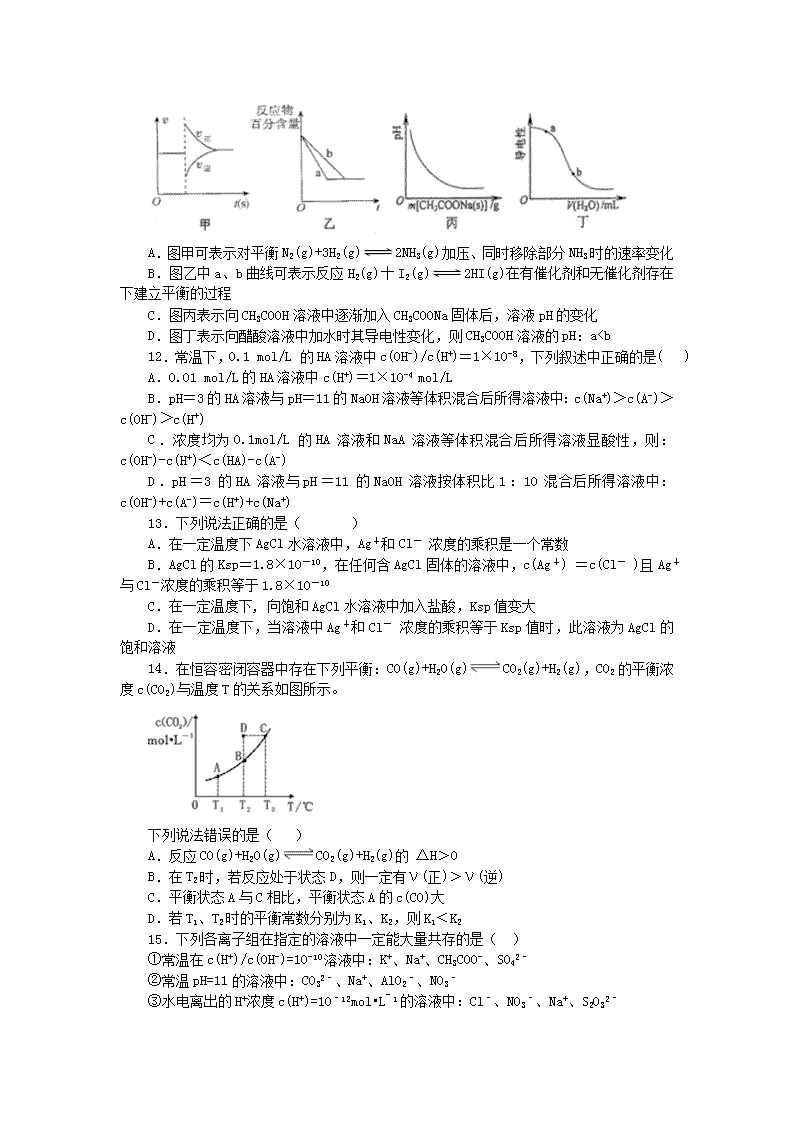
西宁五中2016-2017学年度第一学期高二期末考试化学试卷 考试时间:120分钟 命题校对:韩玉海 第I卷(选择题 共40分) 一、 选择题(只有一个答案正确,每题2分,共40分) 1.下列说法不正确的是( ) A.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 B.NH4HCO3(s)=NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 D.ΔH<0、ΔS>0的反应在任何温度下都能自发进行 2.通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看成该化学键的键能。已知热化学方程式:N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ/mol 化学键 H-H N≡N H-N 键能 436 kJ/mol x 391kJ/mol 请根据热化学方程式和表中数据计算N≡N键的键能x约为( ) A.431kJ/mol B.946kJ/mol C.649kJ/mol D.869kJ/mol 3.下列说法正确的是( ) A.1 mol H2SO4与 1 mol Ba(OH)2完全反应放出的热量叫做中和热 B.等物质的量强酸和弱酸分别与等量的烧碱反应生成等量的水,弱酸反应放出的热量比强酸少 C.CO能继续与O2反应生成稳定的氧化物CO2,所以说CO与O2的反应是吸热反应 D.在101 kPa时,1 mol C燃烧时放出的热量为C的燃烧热 4.关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( ) A.水电离出的c(H+):②>① B.c(NH4+):③>① C.①和②等体积混合后的溶液:c(H+) = c(OH- ) + c(NH3·H2O) D.①和③等体积混合后显碱性,c(NH4+)>c(Cl-)>c(NH3·H2O ) 5.下列叙述正确的是(忽略混合时溶液体积变化) ( ) A.0.2 mol·L-1的盐酸与等体积水混合后pH=1 B.pH=3的醋酸溶液,稀释至10倍后pH=4 C.95 ℃纯水的pH<7,说明加热可导致水呈酸性 D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 6.在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+ B2(g)2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( ) A.图中a点的值为0.15 B.该反应的平衡常数K=0.03 C.温度升高,平衡常数K值减小 D.平衡时A2的转化率为62.5% 7.通过以下反应均可获取H2。下列有关说法正确的是( ) ①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)ΔH1=+571.6kJ·mol–1 ②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol–1 ③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 D.反应CH4(g)=C(s)+2H2(g)的ΔH =+74.8kJ·mol–1 8.在一个恒容绝热的容器内发生反应: mA(g)+nB(g) pC(s)+qQ(g)当m、n、p、q为任意数时,达到平衡的标志是:( ) ①体系的气体密度不再改变 ②体系的温度不再改变 ③生成物C的浓度不再改变 ④气体的总质量不再改变 ⑤反应速率n v(A) = m v(B) ⑥单位时间内m mol A断键反应,同时q mol Q也断键反应 A.①②④⑤ B.②③④⑥ C.①③④⑤ D.①②④⑥ 9.室温下,下列溶液中粒子浓度关系正确的是( ) A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4) C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-) D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) 10.N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表: 时间/s 0 500 1000 1500 c(N2O5)/(mol·L—1) 5.00 3.52 2.50 2.50 下列说法正确的是( ) A.500s内O2的平均生成速率为7.4×l0—4mol·L—1·s—1 B.T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50% C.达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol·L—1 D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 11.有关下列图像的分析错误的是( ) A.图甲可表示对平衡N2(g)+3H2(g)2NH3(g)加压、同时移除部分NH3时的速率变化 B.图乙中a、b曲线可表示反应H2(g)十I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 C.图丙表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 D.图丁表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a Fe3+ C.CrO42-和Fe2+在酸性溶液中可以大量共存 D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 18.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( ) A.a点对应的溶液中大量存在:Fe3+、Na+、SCN-、SO42— B.b点对应的溶液中大量存在:Na+、Fe3+、HCO3-、I- C.c点对应的溶液中大量存在:Na+、Ca2+、Cl-、CO32— D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl- 19.若室温时pH=a的氨水与pH=b的盐酸等体积混合恰好完全中和,则该氨水的电离程度可表示为( ) A. 10(a+b-12) % B. 10(a+b-14) % C. 10(12-a-b) % D. 10(14-a-b) % 20.浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH 随的变化如图所示,下列叙述错误的是( ) A.MOH的碱性强于ROH的碱性 B.ROH的电离程度:b点大于a点 C.若两溶液无限稀释,则它们的c(OH-)相等 D.当lg=2时,若两溶液同时升高温度,则 增大 第II卷(非选择题 共60分) 二、 填空题 21. (共13分)根据题意,完成下列问题。 (1)某温度时,测得0.01mol•L-1的NaOH溶液的pH为11,该溶液与pH=5的HCl溶液等体积混合(混合后溶液体积变化忽略不计),混合后溶液pH= 。(2分) (2)常温下,pH=5的H2SO4溶液中由水电离出的H+的浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+的浓度为c2,溶液中=_____________。(2分) (3)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a :b=___________,(2分)若所得混合溶液pH=12,则a:b=___________。(2分) (4) ①氯化铝水溶液呈酸性的原因是(用离子方程式表示):____________ _____(2分) ②把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用: 请回答下列问题: ③在上图的括号内应填的是在_______________环境中加热。 ④Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)Mg2++2OH-。向体系中加入 _______________有利于Mg(OH)2溶解。 22. (共9分)按要求填写下列问题: (1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2O H3O+ + OH—,则液态NH3电离的方程式是 (2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=10,则该温度下水的KW= ,在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb= (3)25℃时,0.1mol/L的HA溶液中=1010.请回答下列问题: ①HA是 (填“强电解质”或“弱电解质”). ②在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母) A.c(HA) B. C.c(H+)与c(OH-)的乘积 D.c(OH-) (4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3•H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为 (用“V1、V2、V3”和“>、<、=”表示). (5)今有A盐酸、B醋酸、C硫酸 三种酸: ①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 .(填写酸的序号并用符号“>、<、=”连接,下同) ②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是 ,反应所用时间长短关系是 23.(共10分)硫酸及其盐在工农业生产中有着重要的应用。 (1)SO2催化氧化为SO3的反应是工业制硫酸的重要过程,①下左图是反应过程中SO2和SO3的浓度隨时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为 。(2分) ②在一容积可变的密闭容器中充入一定量SO2(g)和O2(g),O2的平衡转化率如上右图所示。则p1与p2的大小关系是p1 p2 (填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 (用Ka、Kb、Kc表示三点对应的平衡常数)。 (2)生产硫酸过程中产生的尾气,可用氨水吸收,溶液中生成(NH4)2SO4、(NH4)2SO3等溶质。 ①(NH4)2SO4溶液呈酸性的原因是 (用离子方程式表示)。(2分) ②己知: NH3·H2O H2SO3 电离平衡常数 1.7×10—5 Ka1=1.54×10—2 Ka2=1.02×10—7 NH4HSO3溶液呈 (填“酸性”、“碱性”、“中性”)。 ③25℃时,相同物质的量的SO2与NH3溶于水,所得溶液中c(H+)—c(OH—)= (填序号)。 A.c(SO32—)—c(H2SO3) B.c(HSO3—)+c(SO32—)—c(NH4+) C.c(SO32—)+c(NH3·H2O)—c(H2SO3) D.(HSO3—)+2c(SO32—)—c(NH4+) (3)己知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2kJ•mo1—1 ②BaS(s)=Ba(s)+S(s) △H=+460kJ•mo1—1 ③2C(s)+O2(g)=2CO(g) △H=—221kJ•mo1—1 则用Ba(s)、S(s)、O2(g)反应生成BaSO4(s)的热化学方程式为 。(2分) 24.(共10分)研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应: 2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ) 2NO(g)+Cl2(g)2ClNO(g) K2 ΔH2<0(Ⅱ) (1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。(2分) (2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。 (3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO)、c(NO)和c(CH3COO-)由大到小的顺序为_______________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)(2分) 可使溶液A和溶液B的pH相等的方法是________。 a.向溶液A中加适量水 b.向溶液A中加适量NaOH c.向溶液B中加适量水 d.向溶液B中加适量NaOH 三、 实验题 25.(共9分)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空: 实验编号 待测盐酸的体积(mL) NaOH溶液的浓度(mol·L-1) 滴定完成时,NaOH溶液滴入的体积(mL) 1 20.00 0.10 24.18 2 20.00 0.10 23.06 3 20.00 0.10 22.96 I、(1)滴定达到终点的标志是是 。 (2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)(2分)。 (3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(2分) A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗 B.锥形瓶水洗后未干燥 C.称量NaOH固体时,有小部分NaOH潮解 D.滴定终点读数时俯视 E.碱式滴定管尖嘴部分有气泡,滴定后消失 II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。(2分) 四、 推断题 26. (共9分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互的转化关系如下图所示。请回答下列问题: (1)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一. ①A中所含化学键类型为___________,(2分)D的电子式为___________;(2分) ②25℃时,0.1mol•L-1 B、C溶液,pH较大的是___________溶液(填溶质的化学式),写出B溶液中显电中性的原因___________,已知,B溶液里的pH=10,则其水电离出来的H+的浓度为________________。 (2)向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有: I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol 请回答下列问题: ①CH4的燃烧热△H________ △H1.(填“>”、“<”或“=”); ②在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII ________EIII(填“>”、“<”或“=”)。查看更多