- 2021-07-02 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省南阳市第一中学高二下学期第四次月考化学试题(Word版)
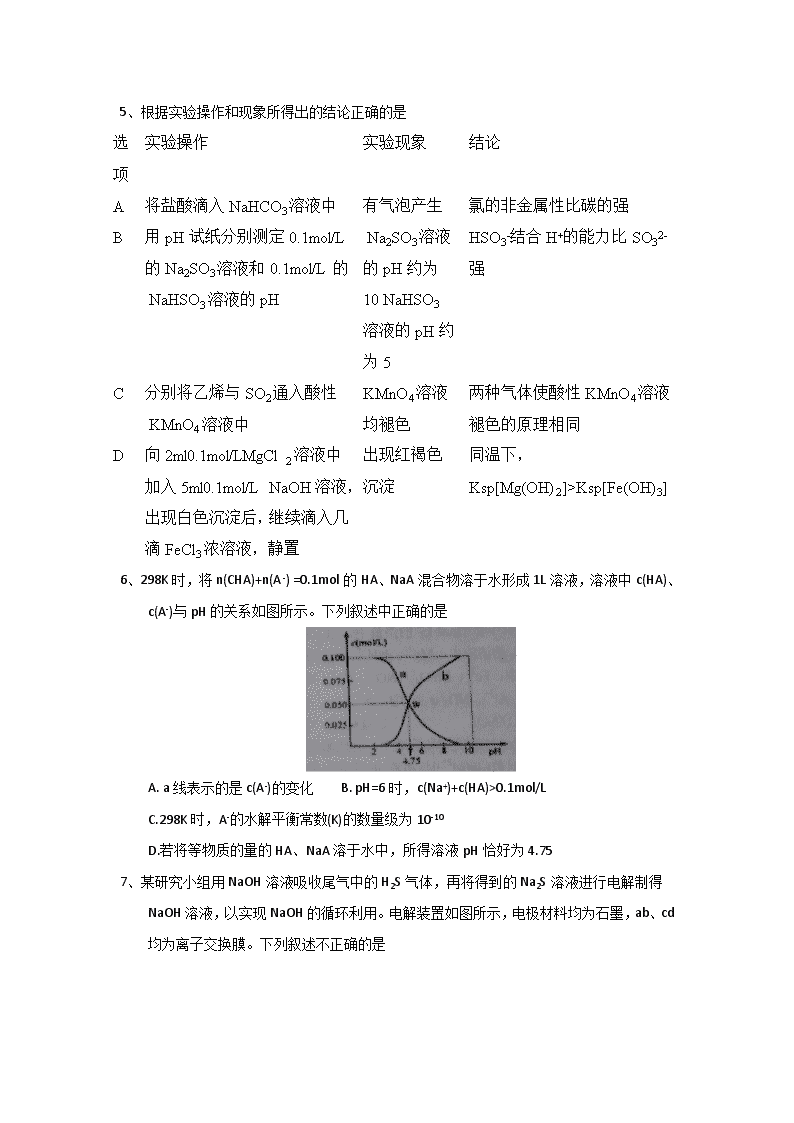
河南省南阳市第一中学2017-2018学年高二下学期第四次月考 化学 第I卷 选择题(共42分) 可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Mg-24 A1-27 S-32 Cl-35.5 Cu-64 Zn-65 一、选择题(每题3分,共42分,每小题只有一个选项符合题意) 1、下列与有机物结构、性质相关的叙述中,正确的是 A.煤的干馏,煤的气化和液化是化学变化 B.肥皂可以通过高分子化合物油脂发生皂化反应制得 C.鸡蛋清中加入CuSO4溶液会产生盐析现象,析出的蛋白质可再溶于水 D.淀粉、纤维素完全水解的产物互为同分异构体,且都可与新制氢氧化铜反应 2、设NA为阿伏加德罗常数,下列说法正确的是 A. 0.1 molFeCl3水解生成的胶粒数Fe (OH) 3为0.1 NA B.标准状况下,2.24L C10H12分子中共价键总数为31 NA C.电解精炼铜时,每转移1mol电子,阳极上溶解的铜原子一定小于0.5 NA D. 25℃,pH=13的Ba (OH) 2溶液中含有的OH-数目为0.1 NA 3、下列说法正确的是 A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 B. SO3与Ba(NO3)2溶液可得到BaSO4, SO2 与Ba(NO3)2 溶液可得到BaSO3 C.室温下,SiO2(s)+ 3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的△H<0 D.反应A(g) B(g) △H, 若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=(Ea-Eb) kJ/mol 4、下列离子方程式书写正确且能合理解释事实的是 A. Na2S2O3 溶液中加入稀硫酸: 2S2O32-+4H+=SO42- +3S↓+2H2O B.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置段时间后,溶液变蓝: 4H++4I-+O2=2I2 +2H2O C.向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀: Mg2++2HCO3-+2OH-=MgCO3↓+2H2O D.向含0.1 mol FeBr2的溶液中通入0.1 mol Cl2: 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- 5、根据实验操作和现象所得出的结论正确的是 选项 实验操作 实验现象 结论 A 将盐酸滴入NaHCO3溶液中 有气泡产生 氯的非金属性比碳的强 B 用pH试纸分别测定0.1mol/L的Na2SO3溶液和0.1mol/L的 NaHSO3溶液的pH Na2SO3溶液的pH约为10 NaHSO3溶液的pH约为5 HSO3-结合H+的能力比SO32-强 C 分别将乙烯与SO2通入酸性 KMnO4溶液中 KMnO4溶液均褪色 两种气体使酸性KMnO4溶液褪色的原理相同 D 向2ml0.1mol/LMgCl2溶液中加入5ml0.1mol/L NaOH溶液,出现白色沉淀后,继续滴入几滴 FeCl3浓溶液,静置 出现红褐色沉淀 同温下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3] 6、298K时,将n(CHA)+n(A-) =0.1mol的HA、NaA混合物溶于水形成1L溶液,溶液中c(HA)、c(A-)与pH的关系如图所示。下列叙述中正确的是 A. a线表示的是c(A-)的变化 B. pH=6 时,c(Na+)+c(HA)>0.1mol/L C.298K 时,A-的水解平衡常数(K)的数量级为10-10 D.若将等物质的量的HA、NaA 溶于水中,所得溶液pH恰好为4.75 7、某研究小组用NaOH溶液吸收尾气中的H2S气体,再将得到的Na2S溶液进行电解制得NaOH溶液,以实现NaOH的循环利用。电解装置如图所示,电极材料均为石墨,ab、cd均为离子交换膜。下列叙述不正确的是 A. ab 表示阳离子交换膜,cd 表示阴离子交换膜 B.阴极的电极反应式为2H2O-4e-==O2↑+4H+,阴极区溶液pH降低 C.阳极的电极反应式为S2--2e-==S↓,阳极区有淡黄色沉淀产生 D. 当电路中转移1mol电子时,会有11.2 L (标准状况)的气体生成 8、一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= -49.0kJ/mol,测得n(H2)随时间的变化如曲线I所示。下列说法正确的是 A.该反应在0~8min内CO2的平均反应速率是mol·L-1·min-1 B.保持温度不变,若起始时向上述容器中充入 4molCO2、2molH2、 2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行 C.保持温度不变,若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的体积分数等于20% D.改变条件得到曲线II、III,则曲线II、III改变的条件分别是升高温度、充入氦气 9、下列各组离子在指定溶液中一定能大量共存的是 ①pH=0的溶液: Na+、Cl-、MnO4-、SO42- ②pH=ll的溶液中: CO32-、Na+、A1O2-、NO3- 、S2-、SO32- ③水电离的H+浓度c(H+)=l0-12mol/L的溶液中,Cl-、CO32-、NO3- 、NH4+、SO32- ④加入Mg能放出H2的溶液中: Mg2+、NH4+、Cl-、K+、SO42- ⑤使石蕊变红的溶液中: Fe2+、 MnO4-、NO3- 、Na+、SO42- ⑥中性溶液中: Fe3+、 Al3+、 NO3- 、I-、Cl-、S2- A.②④ B.①③⑥ C.①②⑤ D.①②⑥ 10、25℃时,Fe(OH)2 和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-1g(M2+)与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]查看更多