- 2021-07-02 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学二轮总复习非选择题专项练(四) Word版含解析
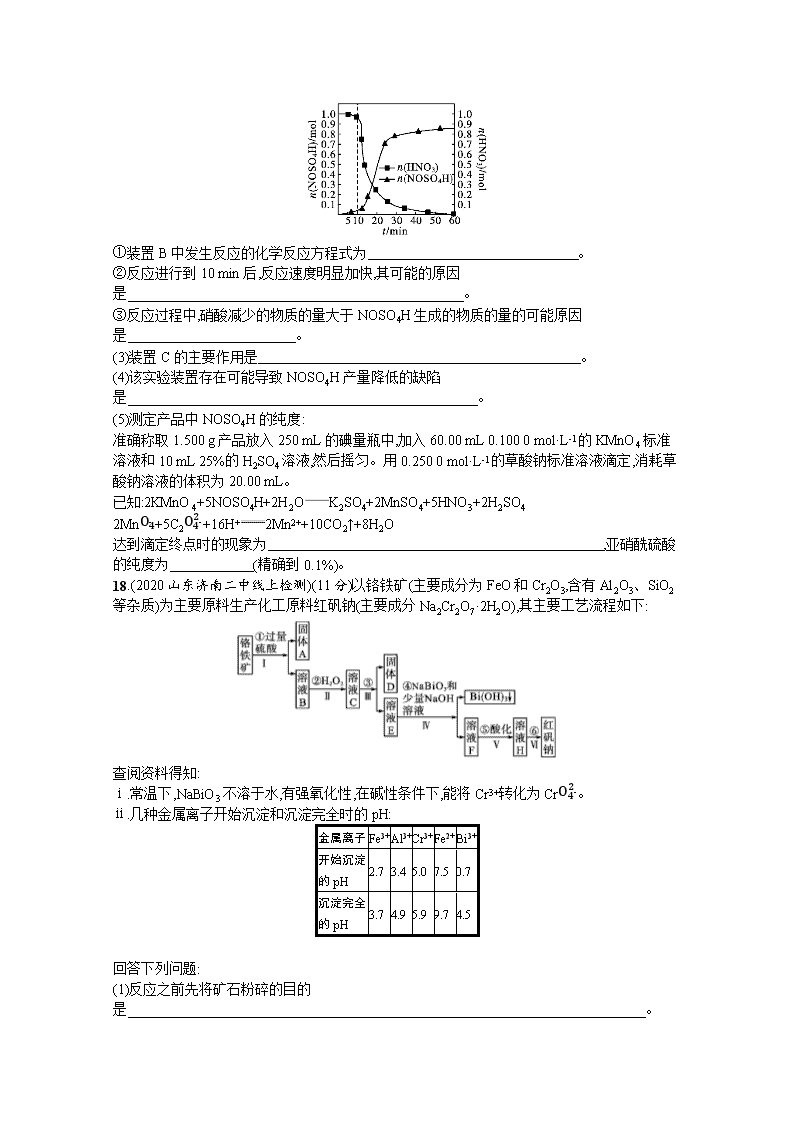
www.ks5u.com 非选择题专项练(四) 三、非选择题:本题共5小题,共60分。 16.(2020山东潍坊二模)(11分)我国采用的Cu2O/TiO2-NaBiO3光催化氧化技术能深度净化工业上含有机物的废水。回答下列问题: (1)钛(Ti)的基态原子M能层中能量不同的电子有 种。 (2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等。 ①H2O、CH3OH、分子中O—H键的极性最强的是 。 ②C、N、O三种元素的电负性由大到小的顺序是 。 (3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,1 mol该离子中所含σ键为 mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是 。 (4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为r pm,则该晶体的密度为 g·cm-3(用含r和NA数学表达式表示)。 17.(2020山东济宁5月模拟)(13分)亚硝酰硫酸[M(NOSO4H)=127 g·mol-1]主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水会分解,但溶于浓硫酸而不分解。 (1)用装置A制取SO2,则A中反应的化学方程式为 ,导管b的作用是 。 (2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20 ℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。 ①装置B中发生反应的化学反应方程式为 。 ②反应进行到10 min后,反应速度明显加快,其可能的原因是 。 ③反应过程中,硝酸减少的物质的量大于NOSO4H生成的物质的量的可能原因是 。 (3)装置C的主要作用是 。 (4)该实验装置存在可能导致NOSO4H产量降低的缺陷是 。 (5)测定产品中NOSO4H的纯度: 准确称取1.500 g产品放入250 mL的碘量瓶中,加入60.00 mL 0.100 0 mol·L-1的KMnO4标准溶液和10 mL 25%的H2SO4溶液,然后摇匀。用0.250 0 mol·L-1的草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。 已知:2KMnO4+5NOSO4H+2H2OK2SO4+2MnSO4+5HNO3+2H2SO4 2MnO4-+5C2O42-+16H+2Mn2++10CO2↑+8H2O 达到滴定终点时的现象为 ,亚硝酰硫酸的纯度为 (精确到0.1%)。 18.(2020山东济南二中线上检测)(11分)以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下: 查阅资料得知: ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。 ⅱ.几种金属离子开始沉淀和沉淀完全时的pH: 金属离子 Fe3+ Al3+ Cr3+ Fe2+ Bi3+ 开始沉淀的pH 2.7 3.4 5.0 7.5 0.7 沉淀完全的pH 3.7 4.9 5.9 9.7 4.5 回答下列问题: (1)反应之前先将矿石粉碎的目的是 。 (2)步骤③加的试剂为 ,此时溶液pH要调到5的目的是 。 (3)写出反应④的离子方程式: 。 (4)⑤中酸化是为了将CrO42-转化为Cr2O72-,写出该反应的离子方程式: 。 (5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即可得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是 (填操作名称)。 19.(2020山东新高考全真模拟)(13分)以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。 Ⅰ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。 (1)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为: 第一步:I2(g)2I(g)(快反应) 第二步:I(g)+N2O(g)N2(g)+IO(g)(慢反应) 第三步:IO(g)+N2O(g)N2(g)+O2(g)+I2(g)(快反应) 实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是 。 A.N2O的分解速率与I2的浓度有关 B.第三步反应对总反应速率起决定作用 C.第二步反应活化能比第三步反应小 D.IO(g)为反应的催化剂 Ⅱ.汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。(反应Ⅰ.2CO+2NON2+2CO2 ΔH1;反应Ⅱ.4CO+2NO2N2+4CO2 ΔH2<0) (2)针对反应Ⅰ: ①已知反应N2(g)+O2(g)2NO(g) ΔH3=+180.0 kJ· mol-1,若CO的燃烧热ΔH=-283.5 kJ· mol-1,则反应Ⅰ的ΔH1= kJ· mol-1。 ②若在恒容的密闭容器中,充入2 mol CO和1 mol NO发生反应Ⅰ,下列选项中不能说明该反应已经达到平衡状态的是 。 A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变 C.混合气体的压强保持不变 D.2v正(N2)=v逆(CO) (3)在2 L密闭容器中充入2 mol CO和1 mol NO2,发生上述反应Ⅱ。 ①若在某温度下,该反应达平衡时CO的转化率为40%,则该反应的平衡常数为 。 ②图1为平衡时CO2的体积分数与温度、压强的关系。则温度:T1 (填“<”或“>”)T2;若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 点。 图1 图2 (4)某研究小组探究催化剂对CO、NO2转化的影响。将NO2和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO2的含量,从而确定尾气脱氮率(脱氮率即NO2的转化率),结果如图2所示。若高于450 ℃,图2中曲线中脱氮率随温度升高而降低的主要原因是 ;a点 (填“是”或“不是”)对应温度下的平衡脱氮率,说明理由: 。 20.(2019山东青岛高三模拟)(12分)蜂胶是蜜蜂从植物芽孢或树干上采集的树脂。在蜂胶众多的功效成分中,咖啡酸苯乙酯(CAPE)已经被鉴定为蜂胶中的主要活性组分之一。 合成咖啡酸苯乙酯的路线设计如下: A C7H7ClBCDEG咖啡酸咖啡酸苯乙酯 已知:①A的核磁共振氢谱有三组峰,红外光谱显示咖啡酸分子中存在碳碳双键。 ②—CHO+ ③ 请回答下列各题: (1)物质A的名称为 。 (2)由B生成C和由C生成D的反应类型分别是 、 。 (3)E的结构简式为 。 (4)咖啡酸生成咖啡酸苯乙酯的化学方程式为 。 (5)芳香化合物X是G(C9H8O3)的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,且与新制Cu(OH)2反应生成砖红色沉淀,其核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2∶2∶2∶1∶1,写出两种符合要求的X的结构简式 。 (6)参照上述合成路线,以丙醛和为原料(其他试剂任选),设计制备的合成路线。 参考答案 非选择题专练(四) 16.答案(1)3 (2)① ②O>N>C (3)22 NH3与Cu2+的配位能力比H2O强 (4)6×209242r3NA×1030 解析(1)钛(Ti)的基态原子核外电子排布式为1s22s22p63s23p63d24s2,M能层即为Ti原子核外第三层,M层中有3个能级,每个能级上的电子能量不同,则能量不同的电子有3种。 (2)①H2O、CH3OH、都是极性分子,根据钠与水和醇的反应剧烈程度可知,水中的氢活性较大更易电离,电离难易程度与极性关系,一般极性越大,越容易电离,则H2O中O—H键的极性大于CH3OH中O—H键的极性,水是中性的,苯酚具有酸性,说明苯酚中羟基上的H比水更易电离,则上述分子中O—H键的极性最强的是。②C、N、O三种元素位于同周期,同周期元素,随核电荷数增大,电负性逐渐增强,三种元素的电负性由大到小的顺序是O>N>C。 (3)配位键和单键都是σ键,根据图示,a为铜离子,b为H2O,c为NH3,铜离子与NH3、H2O形成6个配位键,每个NH3中含有3个σ键,每个H2O中含有2个σ键,则1mol该离子中所含σ键为1mol×(6+3×4+2×2)=22mol;根据相似相溶原理,乙醇为极性溶剂,H2O为极性分子,NH3与Cu2+的配位能力比H2O强,乙醇将H2O夺走,降低蓝色晶体的极性,则蓝色晶体的溶解度降低而析出。 (4)根据图2所示,金属铋原子位于六棱柱的顶点,面心和体内,该晶胞中铋原子的个数为2×12+3+16×12=6。根据图1所示,若铋原子的半径为rpm,则晶胞面的边长为 2rpm,上下面的距离h=463rpm,将六棱柱看作6个三棱柱构成,每个三棱柱的体积为12×2rpm×3rpm×463rpm=42r3pm3=42×10-30r3cm3,则晶胞的体积为6×42×10-30r3cm3=242×10-30r3cm3,则该晶胞的密度为ρ=mV=NMVNA=6×209g·mol-1242×10-30r3cm3×NA=6×209242r3NA×1030g·cm-3。 17.答案(1)Na2SO3+H2SO4Na2SO4+H2O+SO2↑ 平衡压强,使分液漏斗中的液体能顺利流下 (2)①HNO3+SO2NOSO4H ②生成的NOSO4H对该反应有催化作用 ③硝酸会挥发和分解 (3)吸收尾气中的有毒气体,防止污染环境 (4)C装置中的水蒸气会进入B中使NOSO4H分解 (5)溶液恰好由紫红色变为无色,且半分钟内不恢复 84.7% 解析(1)实验室一般利用硫酸和亚硫酸钠反应制取二氧化硫,该反应的化学方程式为Na2SO3+H2SO4Na2SO4+H2O+SO2↑;导管b可以平衡压强,使分液漏斗中的液体能顺利流下。 (2)①装置B中二氧化硫与浓硫酸和浓硝酸的混合液反应制取NOSO4H,根据题干信息可知,浓硫酸主要是用来溶解反应生成的NOSO4H,所以化学方程式为HNO3+SO2NOSO4H。②反应进行到10min后,反应速度明显加快,综合考虑影响反应速率的因素温度(反应过程中维持体系温度不高于20℃)、浓度(反应过程中浓度降低)、催化剂可知,加快反应速率的原因应为生成的NOSO4H对该反应有催化作用。③硝酸具有挥发性,且容易分解,所以硝酸减少的物质的量大于NOSO4H生成的物质的量。 (3)根据分析可知装置C的作用为吸收尾气中的有毒气体,防止污染环境。 (4)C装置中的水蒸气会进入B中使NOSO4H分解,从而导致产量降低。 (5)滴定终点时草酸根与高锰酸根完全反应,所以溶液会显无色,滴定终点现象为溶液恰好由紫红色变为无色,且半分钟内不恢复;消耗草酸钠溶液的体积为20.00mL,浓度为0.2500mol·L-1,根据方程式2MnO4-+5C2O42-+16H+2Mn2++10CO2↑+8H2O可知,剩余的n(MnO4-)=25×0.02L×0.2500mol·L-1=0.002mol,所以NOSO4H消耗的n(MnO4-)=0.06L×0.1000mol·L-1-0.002mol=0.004mol,根据方程式2KMnO4+5NOSO4H+2H2OK2SO4+2MnSO4+5HNO3+2H2SO4可知,n(NOSO4H)=0.004mol×52=0.01mol,所以样品的纯度为0.01mol×127g·mol-11.500g×100%≈84.7%。 18.答案(1)增大反应物的接触面积,加快反应速率,提高铬铁矿的浸取率 (2)NaOH溶液 使Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀而除去 (3)3NaBiO3+2Cr3++7OH-+H2O3Bi(OH)3+2CrO42-+3Na+ (4)2CrO42-+2H+Cr2O72-+H2O (5)重结晶 解析铬铁矿与过量的硫酸混合发生反应生成硫酸亚铁和硫酸铬、硫酸铝,二氧化硅不溶于硫酸,所以固体A为二氧化硅,溶液B中加入过氧化氢,将亚铁离子氧化成铁离子,加入碱调节pH使铁离子和铝离子沉淀,根据表格数据分析,控制pH到5,固体D为氢氧化铁和氢氧化铝,溶液E中加入铋酸钠和少量氢氧化钠溶液,反应生成Na2CrO4,然后酸化将Na2CrO4转化为Na2Cr2O7,最后通过重结晶得到红矾钠。 (1)为了增大反应物的接触面积,加快反应速率,提高铬铁矿的浸取率,反应之前先将矿石粉碎。 (2)根据表格数据分析,步骤③加的试剂为NaOH溶液;将溶液pH调到5的目的是使Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀而除去,而铬离子不沉淀。 (3)反应④中铋酸钠将硫酸铬氧化生成铬酸钠同时生成氢氧化铋,该反应的离子方程式为3NaBiO3+2Cr3++7OH-+H2O3Bi(OH)3+2CrO42-+3Na+。 (4)⑤中酸化是使CrO42-转化为Cr2O72-,该反应的离子方程式为2CrO42-+2H+Cr2O72-+H2O。 (5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即可得红矾钠粗晶体,对红矾钠粗晶体进行重结晶可得精制红矾钠。 19.答案(1)A (2)①-747.0 ②B (3)0.22 < E (4)温度太高,催化剂的活性降低,反应放热,平衡向逆反应方向移动 不是 因为该反应为放热反应,根据线Ⅱ可知,a点对应温度的平衡脱氮率应该更高 解析(1)由含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)可知,N2O的分解速率与I2的浓度有关,A正确;第二步反应是慢反应,则第二步反应对总反应速率起决定作用,B错误;第二步反应是慢反应,则第二步反应活化能比第三步反应大,C错误;IO为反应的中间产物,不是催化剂,D错误。 (2)①CO的燃烧热ΔH=-283.5kJ·mol-1,则2CO(g)+O2(g)2CO2(g) ΔH=-567kJ·mol-1,又因为N2(g)+O2(g)2NO(g) ΔH3=+180.0kJ·mol-1,则两式相减即得到反应Ⅰ的ΔH1=-747.0kJ·mol-1。②起始时CO和NO的物质的量之比不满足化学计量数之比,所以CO和NO的物质的量不变能说明反应达到平衡状态,A不选;密度是混合气的质量和容器容积的比值,在反应过程中质量和容器容积始终是不变的,因此混合气体的密度保持不变不能说明反应达到平衡状态,B可选;正反应体积减小,则混合气体的压强保持不变能说明反应达到平衡状态,C不选;2v正(N2)=v逆(CO)说明正逆反应速率相等,D不选。 (3)① 4CO+2NO2N2+4CO2 起始浓度/(mol·L-1) 1 0.5 0 0 转化浓度/(mol·L-1) 0.4 0.2 0.1 0.4 平衡浓度/(mol·L-1) 0.6 0.3 0.1 0.4 则该反应的平衡常数为0.1×0.440.64×0.32≈0.22。 ②反应Ⅱ正反应放热,升高温度平衡向逆反应方向进行,CO2体积分数减小,所以T1查看更多
相关文章
- 当前文档收益归属上传用户