- 2021-07-02 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习物质结构与性质选考题命题分析学案(全国通用)
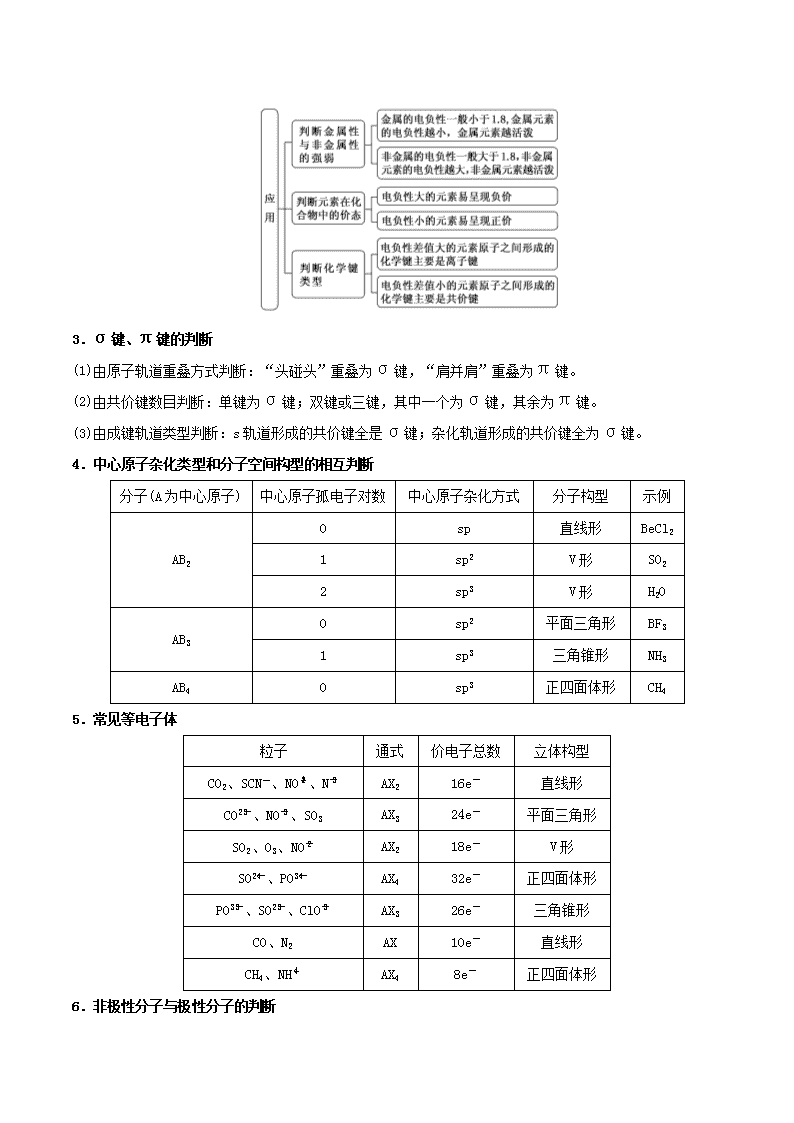
【命题分析】物质结构与性质为选做题,做为“拼盘”命制的题型,各小题之间相对独立,主要考查原子结构与性质、分子结构与性质、晶体结构与性质。在原子结构部分主要命题点有电子排布式或排布图的书写,电离能、电负性大小的比较与判断。在分子结构部分主要命题点有化学键类型的判断,分子构型的判断,中心原子杂化方式的判断。在晶体结构部分主要命题点有晶体类型的判断,晶体结构的计算等。每年几乎都有电子排布、轨道、键型、杂化类型、空间结构,多数有涉及晶胞的计算,偶尔有共面原子数、电负性或电离能等。2017年新增波长、几何形状、离子所处晶胞位置,没有对电子排布、单双键形成原因、密度提问。说明命题组扩大了设问的范围,根据上一年的提问做适当回避。文字性表述内容增加,得分分值不高。在备考时,应多关注理论、概念、在解释中的应用方面下功夫,做到文字清楚、条理清晰,答其所问,拿到该拿得分。 年份 2017 2016 2015 考查内容 以钾和碘的相关化合物在化工、医药、材料等领域的应用为素材,考查元素辐射波长,原子最高能层的符号、电子云轮廓图形状及熔点低的原因,粒子几何构型、杂化轨道类型,晶胞中原子位置及原子间距离计算 以Ge是典型的半导体元素在电子材料领域应用广泛为素材,考查Ge价电子排布式,未成对电子数,解释Ge原子难以形成双键或三键的原因,锗卤化物熔沸点变化规律及原因,电负性比较,杂化轨道类型、微粒间作用力,原子坐标参数,已知晶胞参数算密度 以碳及其化合物广泛存在于自然界中为素材,考查C电子云、自旋相反电子数,解释碳更容易成共价键的原因,共价键类型、杂化轨道类型,晶体类型判断,等电子体,均摊法计算,金刚石结构 【解题策略】 1.基态原子核外电子排布的四方法 表示方法 举例 电子排布式 Cr:1s22s22p63s23p63d54s1 简化表示式 Cu:[Ar]3d104s1 价电子排布式 Fe:3d64s2 电子排布图(或轨道表示式) 2.第一电离能、电负性 (1)元素第一电离能的周期性变化规律: 一般规律 同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势,稀有气体元素的第一电离能最大,碱金属元素的第一电离能最小; 同一主族,随着电子层数的增加,元素的第一电离能逐渐减小 特殊情况 第一电离能的变化与元素原子的核外电子排布有关。通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能 (2)电离能、电负性大小判断: 规律 在周期表中,电离能、电负性从左到右逐渐增大,从上往下逐渐减小 特性 同周期主族元素,第ⅡA族(ns2)全充满、ⅤA族(np3)半充满,比较稳定,所以其第一电离能大于同周期相邻的ⅢA和ⅥA族元素 方法 常常应用化合价及物质类别判断电负性的大小,如O与Cl的电负性比较:①HClO中Cl为+1价、O为-2价,可知O的电负性大于Cl;②Al2O3是离子化合物、AlCl3是共价化合物,可知O的电负性大于Cl (3)电离能、电负性的应用 ①电离能的应用: 判断元素金属性的强弱 电离能越小,金属越容易失去电子,金属性越强;反之越弱 判断元素的化合价 如果某元素的In+1≫In,则该元素的常见化合价为+n,如钠元素I2≫I1,所以钠元素的化合价为+1 ②电负性的应用: 3.σ键、π键的判断 (1)由原子轨道重叠方式判断:“头碰头”重叠为σ键,“肩并肩”重叠为π键。 (2)由共价键数目判断:单键为σ键;双键或三键,其中一个为σ键,其余为π键。 (3)由成键轨道类型判断:s轨道形成的共价键全是σ键;杂化轨道形成的共价键全为σ键。 4.中心原子杂化类型和分子空间构型的相互判断 分子(A为中心原子) 中心原子孤电子对数 中心原子杂化方式 分子构型 示例 AB2 0 sp 直线形 BeCl2 1 sp2 V形 SO2 2 sp3 V形 H2O AB3 0 sp2 平面三角形 BF3 1 sp3 三角锥形 NH3 AB4 0 sp3 正四面体形 CH4 5.常见等电子体 粒子 通式 价电子总数 立体构型 CO2、SCN-、NO、N AX2 16e- 直线形 CO、NO、SO3 AX3 24e- 平面三角形 SO2、O3、NO AX2 18e- V形 SO、PO AX4 32e- 正四面体形 PO、SO、ClO AX3 26e- 三角锥形 CO、N2 AX 10e- 直线形 CH4、NH AX4 8e- 正四面体形 6.非极性分子与极性分子的判断 7.范德华力、氢键、共价键的比较 范德华力 氢键 共价键 作用粒子 分子或原子(稀有气体) 氢原子与氟、氮、氧原子(分子内、分子间) 原子 特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性 强度比较 共价键>氢键>范德华力 影响强度的因素 ①随着分子极性和相对分子质量的增大而增大②组成和结构相似的物质,相对分子质量越大,范德华力越大 对于A—H……B—,A、B的电负性越大,B原子的半径越小,氢键键能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定 对物质性质的影响 ①影响物质的熔沸点、溶解度等物理性质②组成和结构相似的物质,随相对分子质量的增大,物质的熔沸点升高 分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大 ①影响分子的稳定性,共价键键能越大,分子稳定性越强 ②影响原子晶体的熔沸点、硬度 8.物质熔沸点高低比较规律 (1)一般情况下,不同类型晶体的熔沸点高低规律:原子晶体>离子晶体>分子晶体,如:金刚石>NaCl>Cl2;金属晶体>分子晶体,如:Na>Cl2(金属晶体熔沸点有的很高,如钨、铂等,有的则很低,如汞等)。 (2)形成原子晶体的原子半径越小、键长越短,则键能越大,其熔沸点就越高,如:金刚石>石英>碳化硅>晶体硅。 (3)形成离子晶体的阴阳离子的电荷数越多,离子半径越小,则离子键越强,熔沸点就越高,如:MgO>MgCl2,NaCl>CsCl。 (4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔沸点就越高,如Al>Mg>Na。 (5)分子晶体的熔沸点比较规律:①组成和结构相似的分子,相对分子质量越大,其熔沸点就越高,如:HI>HBr>HCl。②组成和结构不相似的分子,分子极性越大,其熔沸点就越高,如:CO>N2。③同分异构体分子中,支链越少,其熔沸点就越高,如:正戊烷>异戊烷>新戊烷。④同分异构体中的芳香烃及其衍生物,邻位取代物>间位取代物>对位取代物,如:邻二甲苯>间二甲苯>对二甲苯。 9.晶胞中微粒数目的计算方法——均摊法 10.晶胞求算 (1)晶体密度的计算: (2)晶体微粒与M、ρ之间的关系:若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对原子质量);又1个晶胞的质量为ρa3 g(a3为晶胞的体积,a为晶胞边长或微粒间距离),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。 【题型归类】 例题1稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。 (1)钪(Sc)为21号元素,位于元素周期表的________区,基态原子价电子排布图为_______。 (2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有________。 (3)Sm(钐)的单质与1,2-二碘乙烷可发生反应:Sm+ICH2CH2I―→SmI2+CH2===CH2。ICH2CH2I中碳原子杂化轨道类型为________,1 mol CH2===CH2中含有的σ键数目为________。常温下,1,2-二碘乙烷为液体而乙烷为气体,其主要原因是____________________________。 (4)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有________个氧原子。 (5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516 pm。晶胞中Ce(铈)原子的配位数为____,列式表示Ce(铈)单质的密度为________________g·cm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。 (5)Ce单质为面心立方晶体,则晶胞中Ce原子的配位数为12;该晶胞中含有的Ce原子的个数为8×+6×=4,故Ce单质的密度为 g÷(516×10-10cm)3= g·cm-3。 【答案】(1)d (2)共价键和配位键(3)sp3 3.01×1024(或5NA) 1,2-二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高(4)8(5)12 或 例题2C、P、Cl、Fe等元素及其化合物有重要的应用,回答下列问题: (1)C原子的价电子排布图为__________________。 (2)CCl4分子的立体构型是______________,其中心原子采取______________杂化,与CCl4互为等电子体的一种离子是____________(填离子符号)。 (3)PCl3属于____________分子(填“极性”或“非极性”)。 (4)FeO、NiO的晶体结构均与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2 nm,则熔点 FeO________NiO (填 “>”“<”或“=”),原因是________。 (5)已知FeCl3的沸点为319 ℃,熔点为306 ℃,则FeCl3的晶体类型为______________。 (6)已知Fe单质有如图所示的两种常见堆积方式: 其中属于体心立方密堆积的是____________(填“a”或“b”);若单质Fe按a方式紧密堆积,原子半径为r pm,NA表示阿伏加德罗常数的值,则单质Fe的密度为______g·cm-3 (列出计算式即可)。 【解析】(1)C的原子序数为6,最外层电子数为4,原子的价电子排布图为(2)CCl4分子中C原子价层电子对数=4+=4,所以采取sp3杂化;立体构型为正四面体;与CCl4 互为等电子体的离子有SO、PO等。(3)PCl3分子中含有的共价键是极性共价键,其结构不对称,属于极性分子。(4)FeO、NiO的晶体结构相同,Fe2+、Ni2+所带电荷相同,但Fe2+的离子半径大于Ni2+的离子半径,则FeO的晶格能小晶胞边长为 cm,晶胞的体积为()3 cm3,故密度为 g·cm-3。 【答案】(1) (2)正四面体 sp3 SO(或PO等) (3)极性 (4)< FeO、NiO的晶体结构相同,Fe2+、Ni2+所带电荷相同,但Fe2+的离子半径大于Ni2+的离子半径,则FeO的晶格能小于NiO的晶格能,因此熔点FeO查看更多