- 2021-07-02 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖南省邵阳市邵东县第十中学2020届高三9月月考(读论班)化学试题
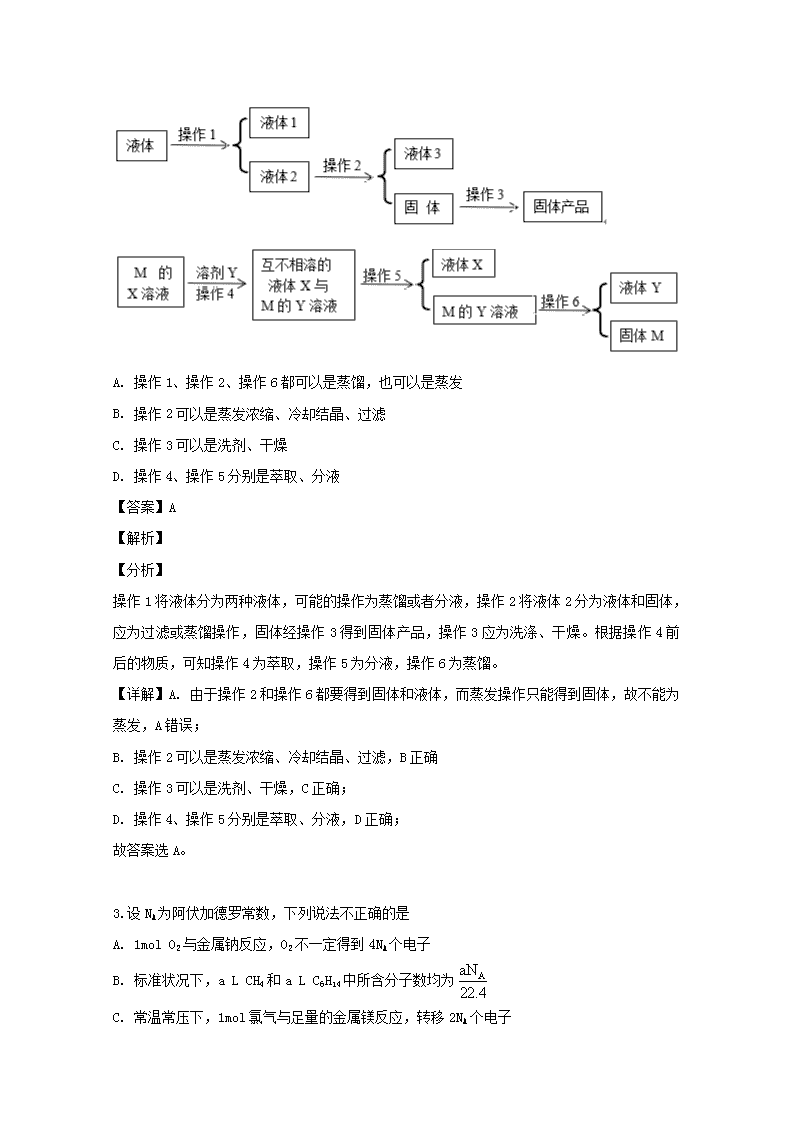
湖南省邵阳市邵东县第十中学2020届高三第一次月考 化学(读论班)试题 1.根据所给的信息和标志,判断下列说法错误的是( ) A B C D 《神农本草经》记载,麻黄能“止咳逆上气” 碳酸氢钠药片 古代中国人已用麻黄治疗咳嗽 该药是抗酸药,服用时喝些醋能提高药效 看到有该标志的丢弃物,应远离并报警 贴有该标志物品是可回收物 A. A B. B C. C D. D 【答案】B 【解析】 A. 麻黄碱具有平喘功能,常常用于治疗气喘咳嗽,A正确;B.醋酸能够与碳酸氢钠反应,降低药效,B错误;C.图示标志为放射性标志,对人体伤害较大,看到有该标志的丢弃物,应远离并报警,C正确;D.该标志为可回收物标志,D正确;答案选B。 点睛:本题考查了物质的性质和用途、化学实验安全等知识点。要熟悉常见的化学标志:如物品回收标志 ;中国节能标志;禁止放易燃物标志;节水标志;禁止吸烟标志:中国环境标志;绿色食品标志;当心火灾--易燃物质标志等。 2.下图六个操作是常见物质的分离提纯操作,则有关这的说法不正确的是 A. 操作1、操作2、操作6都可以是蒸馏,也可以是蒸发 B. 操作2可以是蒸发浓缩、冷却结晶、过滤 C. 操作3可以是洗剂、干燥 D. 操作4、操作5分别是萃取、分液 【答案】A 【解析】 【分析】 操作1将液体分为两种液体,可能的操作为蒸馏或者分液,操作2将液体2分为液体和固体,应为过滤或蒸馏操作,固体经操作3得到固体产品,操作3应为洗涤、干燥。根据操作4前后的物质,可知操作4为萃取,操作5为分液,操作6为蒸馏。 【详解】A. 由于操作2和操作6都要得到固体和液体,而蒸发操作只能得到固体,故不能为蒸发,A错误; B. 操作2可以是蒸发浓缩、冷却结晶、过滤,B正确 C. 操作3可以是洗剂、干燥,C正确; D. 操作4、操作5分别是萃取、分液,D正确; 故答案选A。 3.设NA为阿伏加德罗常数,下列说法不正确的是 A. 1mol O2与金属钠反应,O2不一定得到4NA个电子 B. 标准状况下,a L CH4和a L C6H14中所含分子数均为 C. 常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子 D. 在20℃、1atm时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA 【答案】B 【解析】 【详解】A. 1mol O2与金属钠反应,可能生成氧化钠或者过氧化钠,故O2不一定得到4NA个电子,A正确; B. 标准状况下, C6H14为非气态,故无法计算其分子数,B错误; C. 常温常压下,1mol氯气与足量的金属镁反应,生成氯化镁,转移2NA个电子,C正确; D. 在20℃、1atm时,C2H4和CO的摩尔质量均为28g/mol,故其混合气体的平均摩尔质量也为28g/mol,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA,D正确; 故答案选B。 【点睛】22.4L/mol仅限于标况下气态物质计算体积时使用。 4.NA为阿伏加德罗常数的值。下列说法正确的是 A. 18 g D2O和18 g H2O中含有的质子数均为10NA B. 2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA C. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA D. 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA 【答案】C 【解析】 试题分析:A.18 g D2O和18 g H2O的物质的量不相同,其中含有的质子数不可能相同,A错误;B.亚硫酸是弱电解质,则2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数小于2NA,B错误;C.过氧化钠与水反应时,氧元素化合价从—1价水的0价,则生成0.1 mol氧气转移的电子数为0.2NA,C正确;D.密闭容器中2 mol NO与1 mol O2充分反应生成2molNO2,但NO2与N2O4存在平衡关系,所以产物的分子数小于2NA,D错误,答案选C。 【考点定位】本题考查阿伏加德罗常数的计算。 【名师点睛】阿伏伽德罗常数与微粒数目关系涉及的知识面广,涉及到核素、弱电解质电离、氧化还原反应、化学平衡、胶体、化学键等知识点。与微粒数的关系需要弄清楚微粒中相关粒子数(质子数、中子数、电子数)及离子数、电荷数、化学键之间的关系,计算氧化还原反应中的转移电子数目时一定要抓住氧化剂或还原剂的化合价的改变以及物质的量,还原剂失去的电子数或氧化剂得到的电子数就是反应过程中转移的电子数。 5. 分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是( )。 A. HClO、HNO3、浓H2SO4都具强氧化性,都是氧化性酸 B. H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 C. HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质 D. HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 【答案】A 【解析】 试题分析:本题需要理解、掌握化学基本概念,对特殊物质需要特别注意,A项这三种酸都具有强氧化性所以是氧化性酸,正确;氧化物只含有两种元素且含有氧元素,HCOOH、Cu2(OH)2CO3含有的元素超过了2种,不属于氧化物,故B项错误;C项CH3CH2OH为非电解质;二元酸一个分子能电离出2个氢离子,HCOOH只能电离1个氢离子,为一元酸,故D项错误。 考点:本题考察物质的分类。 6. 下列反应的离子方程式书写正确的是( ) A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO===CaCO3↓+H2O C. 碳酸钙溶于醋酸:CaCO3+2H+===Ca2++CO2↑+H2O D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2===2Fe3++2Cl- 【答案】D 【解析】 A中过量氨水不能使生成的氢氧化铝沉淀溶解,故A错;B的离子方程式为:Ca2+ + 2OH-+ 2HCO3- CaCO3↓+ CO32-+ 2H2O;C中醋酸为弱电解质,应写成分子式 7.下列化工生产过程中,未涉及氧化还原反应的是( ) A. 海带提碘 B. 氯碱工业 C. 氨碱法制碱 D. 海水提溴 【答案】C 【解析】 试题分析:A.海带提碘是将KI变为I2,有元素化合价的变化,属于氧化还原反应,错误;B.氯碱工业是由NaCl的水溶液在通电时反应产生NaOH、Cl2、H2,有元素化合价的变化,属于氧化还原反应,错误;C.氨碱法制取碱的过程中没有元素化合价的变化,是非氧化还原反应,正确;D.海水提溴是由溴元素的化合物变为溴元素的单质,有元素化合价的变化,属于氧化还原反应,错误。故选项C正确。 考点:考查氧化还原反应概念。 8.a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有 A. HCHO B. CH3COOCH2CH3 C. HOOCCOOH D. HCOOH 【答案】B 【解析】 9. 有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法不正确的是( ) A. 高纯度单质硅被广泛用于制作计算机芯片 B. 硅可由二氧化硅还原制得 C. 常温时硅与水、空气和酸不反应,但能与氢氟酸反应 D. 自然界硅元素的贮量丰富,并存在大量的单质硅 【答案】D 【解析】 【详解】A.Si是重要的半导体材料,可用于生产制造计算机中的芯片,A正确; B.硅可由二氧化硅和焦炭经还原制得:2C+SiO2Si+2CO↑,B正确; C.低温时,硅与水、空气和酸不反应,但能与氢氟酸反应,产生SiF4和水,C正确; D.自然界中硅的储量丰富,但硅是亲氧元素,自然界中Si以SiO2和硅酸盐的形式存在,自然界中不存在单质硅,D错误。 答案选D。 10.硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,溴水褪色,乙变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是 A. SO3、H2SO4、H2SO3、H2S、S B. SO2、H2SO3、H2SO4、SO2、SO3 C. SO3 、H2SO4、H2SO3、SO2、Na2S2O3 D. SO2、H2SO3、H2SO4、H2S、S 【答案】D 【解析】 【详解】甲、乙、丙、丁、戊均含有硫元素。 硫磺在空气中燃烧生成气体甲,发生的反应为,甲是; 甲溶于水得溶液乙,发生的反应为,乙是; 向乙溶液中滴加溴水,溴水褪色,乙变成丙,发生的反应为,丙是; 在丙溶液里加入生成气体丁,发生的反应为,丁是; 把丁通入乙得到沉淀戊,发生的反应为,戊是S, 故D项正确。 11.氢化铵(NH4H)与氯化铵的结构相似,又知 NH4H与水反应有 H2生成,则下列叙述正确的是 A. NH4H 共价化合物,含有共价键,可能还含有离子键 B. NH4H 固体投入少量的水中,有两种气体生成 C. NH4H 与水反应时,NH4H 是氧化剂 D. NH4H 溶于水,所形成的溶液显酸性 【答案】B 【解析】 【分析】 氢化铵(NH4H)与氯化铵的结构相似,故氢化铵应当由铵根离子和氢负离子组成,又知 NH4 H与水反应有 H2生成,推测氢气应为负一价的氢和水中正一价的氢归中形成。 【详解】A. NH4H 为离子化合物,含有离子键,也含有共价键,A错误; B. NH4H 固体投入少量的水中,有氢气和氨气两种气体生成,B正确; C. NH4H 与水反应时,NH4H中-1价的H被氧化为0价,为还原剂,C错误; D. NH4H 溶于水, 负一价的氢和水中正一价的氢发生归中反应,则溶液应当显碱性,D错误; 故答案选B。 【点睛】离子化合物中可能含有共价键,而共价化合物中一定没有离子键。 12.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( ) A. X的简单氢化物的热稳定性比W强 B. Y的简单离子与X的具有相同的电子层结构 C. Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红 D. Z与X属于同一主族,与Y属于同一周期 【答案】C 【解析】 氨可作制冷剂,所以W是氮;钠是短周期元素中原子半径最大的,所以Y是钠;硫代硫酸钠与稀盐酸反应生成黄色沉淀硫单质和刺激性气味的气体二氧化硫,所以X、Z分别是氧、硫。A.非金属性X强于W,所以X的简单氢化物的热稳定性强于W的,A正确;B.Y、X的简单离子都具有与氖原子相同的电子层结构,均是10电子微粒,B正确;C.硫化钠水解使溶液呈碱性,该溶液使石蕊试纸变蓝,C错误;D.S、O属于ⅥA,S、Na属于第三周期,D正确。答案选C。 13.短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( ) A. 原子半径的大小W查看更多
相关文章
- 当前文档收益归属上传用户