2019-2020学年高二人教版化学选修三练习:模块综合测试2含答案
模块综合测试(二)
(时间:90分钟 满分:100分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.下列各项叙述中正确的是( )
A.电子层序数越大,s原子轨道的形状相同,半径越大
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
解析:s原子轨道是球形的,电子层序数越大,其半径越大,A项正确;根据洪特规则,对于基态原子,电子在同一能级的不同轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同,B项错误;由于3s轨道的能量低于3p轨道的能量,基态镁原子应是吸收能量,C项错误;杂化轨道成键能力更强,可用于形成σ键和容纳未参与成键的孤电子对,不能形成π键,D错。
答案:A
2.下列原子的价电子排布中,对应第一电离能最大的是( )
A.ns2np1 B.ns2np2
C.ns2np3 D.ns2np4
解析:当原子轨道处于全满、半满时,具有的能量较低,原子比较稳定,第一电离能较大。
答案:C
3.短周期Y元素的p轨道上有3个未成对电子,则该元素的最高价氧化物的水化物的化学式可能是( )
A.H3YO4 B.H4YO4
C.HYO2 D.H2YO4
解析:从电子排布可知Y元素为第ⅤA族元素,其最高化合价为+5价。A、B、C、D四个选项中Y的化合价分别为+5、+4、+3和+6价。
答案:A
4.下列分子中,含有两个π键的是( )
①HCN(H—C≡N) ②H2O ③N2 ④H2O2 ⑤C2H4
⑥C2H2
A.①②③⑥ B.③④⑤⑥
C.①③⑥ D.③⑤⑥
解析:含有两个π键的分子一般要求有一个三键或两个双键。
答案:C
5.下列各原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
解析:A中1s2结构的原子为He,1s22s2结构的原子为Be,两者性质不同;B项X原子为Mg,Y原子N层上有2个电子的有多种元素,如第四周期中Ca、Fe等都符合,化学性质不一定相同;C项为同主族元素(C和Si),化学性质一定相似;D项最外层只有一个电子的ⅠA族元素可以,过渡族元素中也有很多最外层只有1个电子的,故性质不一定相同。
答案:C
6.O、S、As三种元素比较,正确的是( )
A.电负性O>S>As,原子半径O
S>As
D.电负性O>S>As,原子半径O>S>As
解析:同主族元素的电负性从上到下逐渐减小,同周期元素的电负性从左到右逐渐增大,故电负性O>S>As,元素的原子半径同周期从左到右逐渐减小,同主族从上到下逐渐增大,原子半径As>S>O。
答案:A
7.下列说法正确的是( )
A.电离能大的元素,不易失电子,易得到电子,表现非金属性
B.电离能大的元素其电负性也大
C.电负性最大的非金属元素形成的含氧酸的酸性最强
D.电离能最小的元素形成的氧化物的水化物的碱性最强
解析:电离能是衡量原子失去电子的难易,电负性是衡量元素得到电子后对键合电子作用的大小,因此电离能大的元素,其电负性不一定大,如He电离能很大,它的电负性却很小,因为它不易与外来电子键合,故A、B两项均不正确;F电负性最大,但通常不能形成含氧酸,C项不正确;电离能小的元素其金属性强,故其氧化物的水化物碱性也强,D项正确。
答案:D
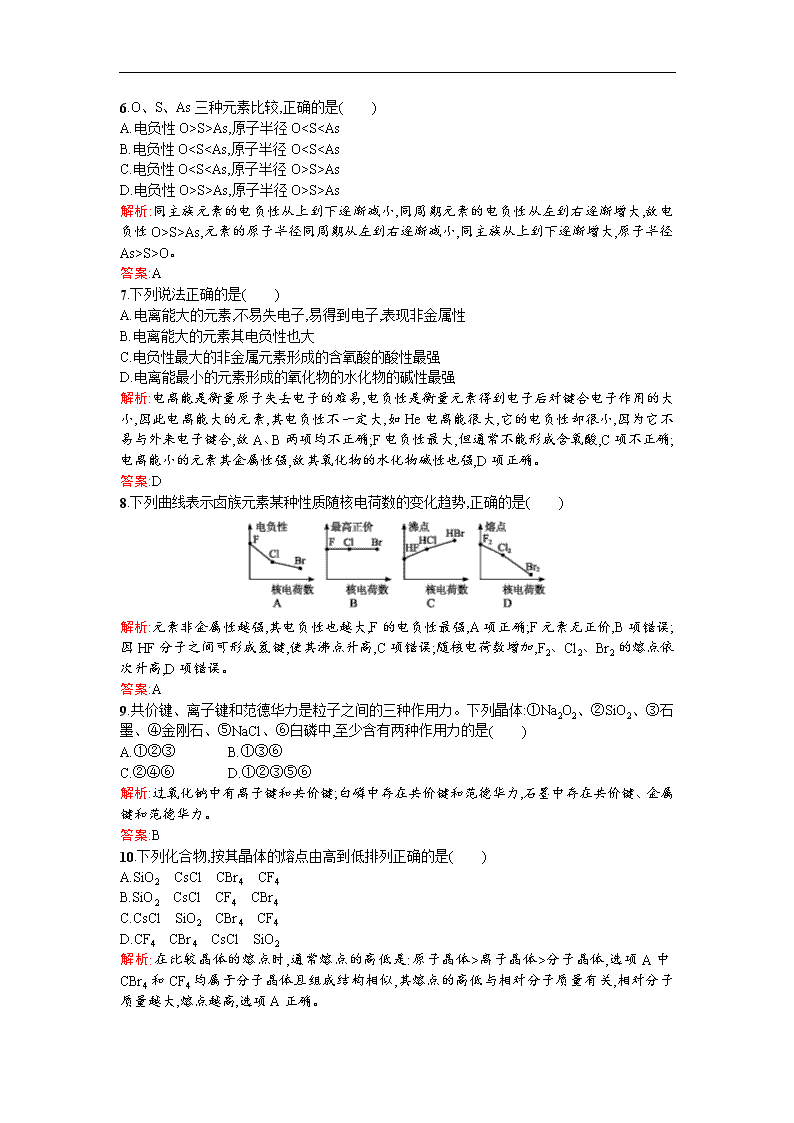
8.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是( )
解析:元素非金属性越强,其电负性也越大,F的电负性最强,A项正确;F元素无正价,B项错误;因HF分子之间可形成氢键,使其沸点升高,C项错误;随核电荷数增加,F2、Cl2、Br2的熔点依次升高,D项错误。
答案:A
9.共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体:①Na2O2、②SiO2、③石墨、④金刚石、⑤NaCl、⑥白磷中,至少含有两种作用力的是( )
A.①②③ B.①③⑥[来源:学.科.网]
C.②④⑥ D.①②③⑤⑥
解析:过氧化钠中有离子键和共价键;白磷中存在共价键和范德华力,石墨中存在共价键、金属键和范德华力。
答案:B
10.下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CsCl CBr4 CF4
B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4
D.CF4 CBr4 CsCl SiO2
解析:在比较晶体的熔点时,通常熔点的高低是:原子晶体>离子晶体>分子晶体,选项A中CBr4和CF4均属于分子晶体且组成结构相似,其熔点的高低与相对分子质量有关,相对分子质量越大,熔点越高,选项A正确。
答案:A
11.下列对一些实验事实的理论解释正确的是( )
选项
实验事实
理论解释
A
氮原子的第一电离能大于氧原子
氮原子2p能级半充满
B
CO2为直线形分子
CO2分子中之间的夹角为180°
C
金刚石的熔点低于石墨
金刚石是分子晶体,石墨是原子晶体
D
HF的沸点高于HCl
HF的相对分子质量小于HCl
解析:选项B因果关系颠倒;选项C的理论解释错误,原因是石墨中碳碳键键能大于金刚石中碳碳键键能;选项D的理论解释错误,原因是HF分子间可以形成氢键。
答案:A
12.硫化羰(OCS)存在于许多种植物中,杀虫效果显著。它与CO2、CS2互为等电子体,已知CO键的键能为745 kJ·mol-1,有关硫化羰的说法正确的是( )
A.分子中有2个σ键和1个π键
B.可推测CS键的键能大于745 kJ·mol-1
C.OCS中碳原子是采用sp2杂化方式成键的
D.分解温度CS2、OCS、CO2依次由低到高
解析:OCS分子中有2个σ键和2个π键;S半径大些,可推测CS键的键能小于745 kJ·mol-1;OCS中碳原子是采用sp杂化方式成键的。
答案:D
13.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列实验一定能说明CaF2是离子晶体的是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
解析:难溶于水,其水溶液的导电性极弱,不能说明CaF2一定是离子晶体;熔点较高,硬度较大,也可能是原子晶体的性质,B不能说明CaF2一定是离子晶体;熔融状态下可以导电,一定有自由移动的离子生成,C说明CaF2一定是离子晶体;CaF2在有机溶剂(如苯)中的溶解度极小,只能说明CaF2是极性分子,不能说明CaF2一定是离子晶体。
答案:C
14.根据表中给出物质的熔点数据(AlCl3沸点为260 ℃),判断下列说法错误的是( )
晶体
NaCl
MgO
SiCl4
AlCl3
晶体硼
熔点/℃
801
2 800
-70
180
2 500
A.MgO中的离子键比NaCl中的离子键强
B.SiCl4晶体是分子晶体
C.AlCl3晶体是离子晶体
D.晶体硼是原子晶体
解析:根据表中各物质的熔点,判断晶体类型。NaCl和MgO是离子化合物,形成离子晶体,故熔点越高,说明晶格能越大,离子键越强,A项正确;SiCl4是共价化合物,熔点较低,为分子晶体;硼为非金属单质,熔点很高,是原子晶体,B、D项正确;AlCl3虽是由活泼金属和活泼非金属形成的化合物,但其晶体熔点较低,应属于分子晶体。
答案:C
15.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
A.该晶体属于离子晶体
B.该晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有8个
解析:该晶体由阴阳离子构成,故为离子晶体,A项正确;经计算可知该晶体的化学式为BaO2,B项错误;该晶体结构应与NaCl相似,C项错误;由图知与每个Ba2+距离相等且最近的Ba2+共有12个,D项错误。
答案:A
16.在气相中,关于BeF2和SF2的说法错误的是( )
A.BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2
B.BeF2分子的立体结构为直线形
C.SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子
D.在气相中,BeF2是直线形而SF2是V形
解析:SF2分子中,中心原子S的价层电子对数等于4,其VSEPR模型为四面体,成键电子对数等于2,另有两对孤电子对,因此SF2分子的立体结构为V形。
答案:C
二、非选择题(本题包括6小题,共52分)
17.(8分)请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能
I1
I2
I3
I4[来源:Zxxk.Com]
……
Ia/(kJ·mol-1)
578
1 817
2 745
11 578
……
则该元素是 (填写元素符号)。
(2)基态锗(Ge)原子的电子排布式是 。Ge的最高价氯化物分子式是 。该元素可能的性质或应用有 。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物,下列叙述正确的有 。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 B的熔点(填“>”“=”或“<”),其原因是
。 [来源:学科网]
解析:(1)由图中数据,I4≫I3,说明该元素的原子最外层有3个电子,则该元素是Al。
(2)Ge位于第四周期第ⅣA族,其电子排布式为1s22s22p63s23p63d104s24p2。由C的最高价氯化物为CCl4,则Ge的最高价氯化物为GeCl4。Ge位于金属元素与非金属元素分界线的附近,其金属性较弱,电负性应小于硫,单质可作为半导体材料;GeCl4与GeBr4均属于分子晶体,由其相对分子质量可知GeCl4的沸点低于GeBr4,故正确的为C、D两项。
(3)分子中既有极性键又有非极性键,该分子中含有一个碳碳双键、两个碳氧双键,所以含有3个π键。
(4)由题意知两种物质均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此后者熔点较低。
答案:(1)Al
(2)1s22s22p63s23p63d104s24p2 GeCl4 CD[来源:学_科_网]
(3)BD
(4)> 两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低
18.(7分)氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(2)N≡N的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlC可形成离子液体。离子液体由阴、阳离子组成,熔点低于100 ℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
A.助燃剂
B.“绿色”溶剂
C.复合材料
D.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-
形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
解析:(2)在N≡N中有一个σ键,2个π键。
π键键能==347.5 kJ·mol-1,所以在N≡N中,π键比σ键稳定。
(3)离子液体中的作用力是离子键,尽管微弱但强于氢键和分子间作用力,所以其挥发性就小,不会污染环境,是“绿色”溶剂。
(4)X+所含电子=2+8+18=28,所以X为29号Cu元素。
从图上看○少●多,结合X3N知,○为N3-,以顶角上的○为中心,距离最近的X+有3个。构成一个完整的三维空间需8个这样的立方体,则每个N3-周围有X+:8×3×=6个(棱上原子为4个晶胞所共用,所以每个原子在此晶胞中为份)。
答案:(1)1s22s22p6
(2)π σ
(3)小 b
(4)Cu 6
19.(12分)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键、又含有非极性共价键的化合物是 (填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。
图1
图2
该化合物中,阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是
。
解析:根据“a的核外电子总数与其周期数相同”可知a为H元素;根据“c的最外层电子数为其内层电子数的3倍”可知c为O元素;根据“b的价电子层中的未成对电子有3个”
且原子序数:aS;由于N的2p轨道处于半充满的较稳定状态,故其第一电离能大于O,故N、O、S三种元素中,第一电离能最大的是N元素;Cu的价层电子轨道示意图为。
(2)H元素可以和N元素形成三角锥形分子NH3,在NH3中,中心原子N原子的杂化方式为sp3杂化;H元素与N元素形成的N2H4,H元素与O元素形成的H2O2,都是既含有极性键又含有非极性键的化合物。
(3)这些元素形成的含氧酸中,分子的中心原子价层电子对数为3的是HNO2、HNO3;酸根呈三角锥结构的是H2SO3。
(4)由图1可知该晶体结构中Cu的个数为4,O的个数为8×+1=2,化学式为Cu2O即Cu的化合价为+1价。
(5)根据阴离子呈四面体结构可知阴离子是S;阳离子中存在的化学键有共价键和配位键;该化合物加热时首先失去的组分是H2O;因为H2O与Cu2+形成的配位键比NH3与Cu2+形成的配位键弱。
答案:(1)N
(2)sp3 H2O2、N2H4
(3)HNO2、HNO3 H2SO3
(4)+1
(5)S 共价键和配位键 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱
20.(8分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn的核外电子排布式 。
(2)根据等电子原理,写出CO分子的结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
②甲醛分子的空间构型是 ;1 mol甲醛分子中σ键的数目为 。 [来源:学*科*网]
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
解析:(2)CO与N2是等电子体,等电子体具有相同的空间构型,C、O之间共用3对共用电子对。
(3)①CH3OH中含有—OH,能形成氢键。②甲醛结构为,平面三角形,C采取sp2杂化方式成键,结构中含有3个σ键,1个π键。③晶胞中含白球为8×+1=2个,黑球为4个,
原子个数比为1∶2,则包含4个Cu,2个O。
(4)NaCl晶体的结构如图所示:
。将其中的Na换为Ca,Cl换为O进行计算。选定图示的一个晶胞来进行计算。利用“均摊法”可知一个晶胞含有的Ca2+—O2-离子对数为4。一个晶胞的质量:m(晶胞)=×4。一个晶胞的体积:V(晶胞)= cm3。
答案:(1)1s22s22p63s23p63d104s2或[Ar]3d104s2
(2)C≡O
(3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA ③4
(4)
21.(7分)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式: 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,粒子间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键: 。
解析:(1)C、Si和O的电负性大小顺序为O>C>Si。
(2)晶体硅中一个硅原子周围与四个硅原子相连,呈正四面体结构,所以杂化方式是sp3杂化。
(3)晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,所以熔点高。
答案:(1)1s22s22p63s23p2 O>C>Si (2)sp3杂化 共价键 (3)Mg Mg2+半径比Ca2+小,MgO晶格能大 (4)C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成较稳定的π键;而Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
22.(10分)X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的。W是同周期元素中离子半径最小的元素。M原子的最外能层上有两个运动状态不同的电子。
N是一种“太空金属”,广泛应用于航天、军事等工业领域。请回答下列问题:
(1)X、Y两种元素的元素符号是 、 。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的立体结构是 ;中心原子的杂化方式是 。
(2)X的氢化物易溶于水的原因是 。
(3)N的电子排布式是 。
(4)X和Y两元素的第一电离能大小关系: 小于 (填元素符号)。
(5)M与Y形成的化合物的晶体类型属于 ;其晶胞如图所示,其中M离子的配位数是 。
解析:钛被誉为“太空金属”,广泛应用于航天、军事等工业领域;W是第三周期的铝元素;M的原子序数大于W,且最外能层上有两个运动状态不同的电子,则M为钙元素。(1)N、O、F元素的氢化物分子间存在氢键,熔、沸点在同族元素的氢化物中最高,水的沸点在同周期的氢化物中也属最高,故排除氧元素,可推知X为氮元素。Y为氟元素。X、Y形成的共价化合物NF3中两种元素最外层电子数都达到8,分子的立体结构是三角锥形;中心原子的杂化方式为sp3杂化。(2)氨气能与水反应;氨气可以与水形成氢键;氨气是极性分子,易溶于极性分子水。(3)钛元素原子序数为22,核外电子排布式为1s22s22p63s23p63d24s2。(4)氟元素得电子能力强于氮元素,第一电离能N小于F。(5)根据晶体结构得出,该化合物化学式为CaF2,属于离子晶体,每个钙离子周围与之紧邻等距的氟离子有8个,配位数为8。
答案:(1)N F 三角锥形 sp3杂化 (2)氨气与水反应,氨气可以与水形成氢键,氨气是极性分子 (3)1s22s22p63s23p63d24s2 (4)N F (5)离子晶体 8