2019-2020高中化学(人教版 选修4)练习:第2章 第1节
第二章 第一节
一、选择题
1.(2014·经典习题选萃)下列关于化学反应速率的说法中,正确的是( )
A.化学反应速率是指某一时刻、某种反应物的瞬时反应速率
B.化学反应速率为0.8 mol·L-1·s-1是指反应1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以推知化学反应的快慢
D.对于一个化学反应来说,其反应速率越大,反应现象就越明显
解析:A项中,化学反应速率是指一段时间内某种反应物或生成物的平均反应速率;B项中0.8 mol·L-1·s-1不是指反应1 s时某物质的浓度为0.8 mol·L-1,而是指1 s内该物质的浓度变化量为0.8 mol·L-1;D项中反应速率与反应现象无必然联系。
答案:C
2.(2014·辽宁实验中学月考)在四种不同条件下测得反应2SO2+O22SO3的反应速率如下表所示:
编号
(1)
(2)
(3)
(4)
反应速率[mol/(L·min)]
v(SO2)
v(O2)
v(SO3)
v(O2)
0.4
0.25
0.5
0.3
其中反应速率最快的是( )
A.(1) B.(2)
C.(3) D.(4)
解析:由反应速率之比等于相应物质的化学计量数之比可得:v(SO2)=v(O2)=v(SO3),将所得数据作如下换算:(1)v(SO2)=0.2 mol/(L·min);
(2)v(O2)=0.25 mol/(L·min);(3)v(SO3)=0.25 mol/(L·min);(4)v(O2)=0.3 mol/(L·min),单位相同,数值大者反应速率快。
答案:D
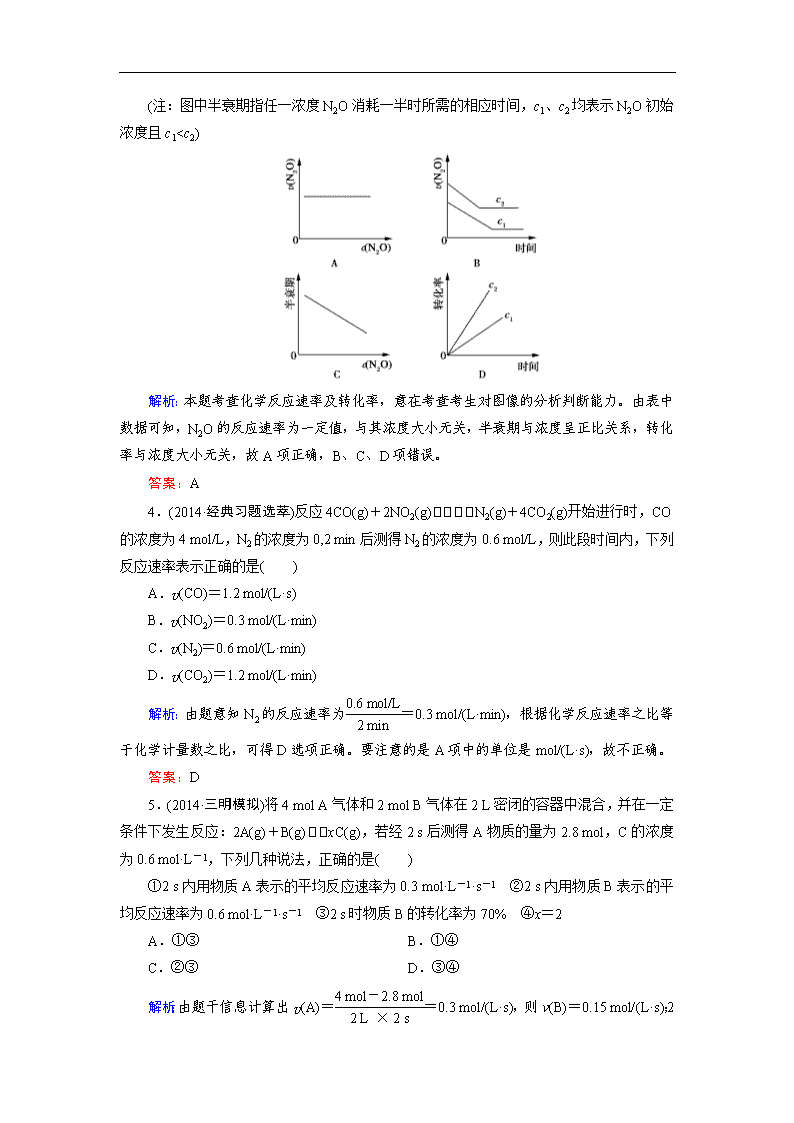
3.(2014·高考福建卷)在一定条件下,N2O分解的部分实验数据如下:
反应时间/min
0
10
20
30
40
50
60
70
80
90
100
c(N2O)/
mol·L-1
0.100
0.090
0.080
0.070
0.060
0.050
0.040
0.030
0.020
0.010
0.000
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2
O初始浓度且c1
甲>丙。
答案:(1)0.05 mol·L-1·s-1
(2)3A(g)+B(g)2C(g)
(3)见解析
(4)乙>甲>丙
点评:
本题主要考查了有关化学反应速率的计算和应用。对于简单的化学反应速率的计算可以直接利用公式v=,带入数据时需要注意图像中坐标的含义,部分考生会由于没有注意到这一点,同时又受题干中2 L的干扰而出错。在一个具体的化学反应中,用不同物质的物质的量浓度变化来表示化学反应速率时,数值往往不同,数值之比等于对应的化学计量数之比,这一点是十分重要的,如该题中v(A)∶v(B)∶v(C)=a∶b∶c=3∶1∶2。在比较反应速率的快慢时不能只看数值的大小,应该先转化成相同的单位,然后比较、和的大小,若>,则A表示的反应速率比B表示的大,如果只看数值的大小此题一定会出错。
14.下列数据是高温下金属镁和镍分别与氧气进行氧化反应时,在金属表面生成氧化膜的实验记录:
反应时间t/h
1
4
9
16
25
MgO层厚y/nm
0.05a
0.2a
0.45a
0.80a
1.25a
NiO层厚y′/nm
b
2b
3b
4b
5b
a、b均为与温度无关的常数。请回答:
(1)金属高温氧化的腐蚀速率可用金属氧化膜的生长速率来表示,理由是
________________________________________________________________________
________________________________________________________________________。
(2)金属氧化膜的膜厚y与时间t所呈现的关系是:MgO氧化膜的膜厚y属于______型(填“直线”或“抛物线”,下同) ;NiO氧化膜的膜厚y′属于____型。
(3)Mg和Ni比较,金属______更耐腐蚀,原因是
________________________________________________________________________
________________________________________________________________________。
解析:(1)金属因高温发生氧化反应,遭到破坏是常见的一种腐蚀现象。然而,不同的金属因其形成的氧化膜致密程度不同,它们的耐腐蚀性也不同。化学反应速率既可由反应物的消耗速率表示,也可由生成物的生成速率表示。显然金属的腐蚀速率可用其氧化膜的生长速率表示。
(2)根据题给数据不难推导出以下数学关系:MgO膜厚y与时间t的关系为y=0.05at;NiO膜厚y′与时间t的关系为y′=bt。由函数的表达式知:前者为直线型,后者为抛物线型。
(3)据此可知y′随时间增大要比y随时间增大的慢,故镍的耐高温氧化腐蚀性要比镁的好。
答案:(1)化学反应速率可用反应物的消耗速率表示,也可用生成物的生成速率表示
(2)直线 抛物线
(3)Ni 它的腐蚀速率随时间的增大比镁慢
15.一密闭容器内装有SO2和O2,反应开始时,SO2浓度为2 mol/L ,O2浓度为2 mol/L,两分钟后,测得SO2浓度为1.8 mol/L,则两分钟内SO2的平均反应速率是多少?O2和SO3的平均反应速率又分别是多少?通过计算,比较三者速率有何联系?
解析: 2SO2+O22SO3
起始浓度(mol/L) 2 2 0
变化浓度(mol/L) 0.2 0.1 0.2
2 min后浓度(mol/L) 1.8 1.9 0.2
所以:v(SO2)==0.1 mol/(L·min)
v(O2)==0.05 mol/(L·min)
v(SO3)==0.1mol/(L·min)
v(SO2)∶v(O2)∶v(SO3)=2∶1∶2,其比值等于化学方程式中相应的化学计量数之比。
答案:v(SO2)=0.1 mol/(L·min)
v(O2)=0.05 mol/(L·min)
v(SO3)=0.1mol/(L·min)
三者的速率之比为2∶1∶2,比值等于化学方程式中相应的化学计量数之比。