- 2021-07-02 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学反应速率化学平衡作业(全国通用)
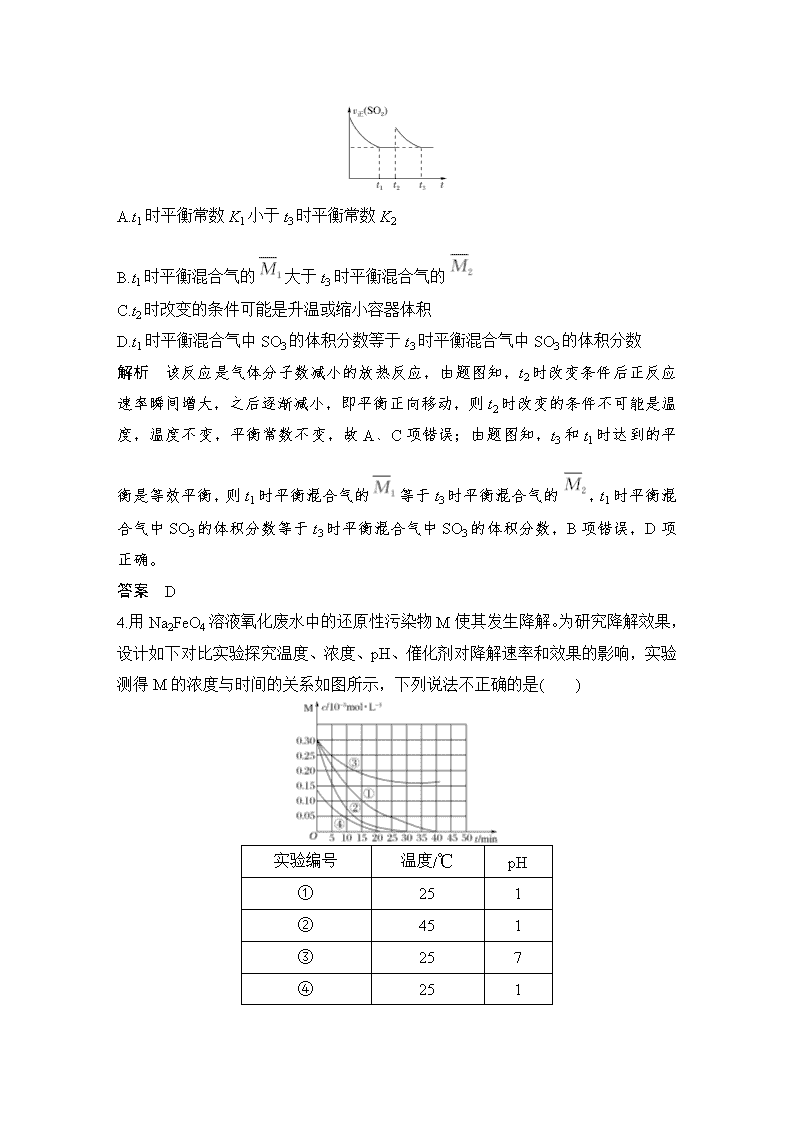
专题强化练 化学反应速率 化学平衡 1.某温度下,体积一定的密闭容器中发生如下可逆反应X(g)+mY(s)3Z(g) ΔH,下列说法正确的是( ) A.气体的平均密度不变时,说明达到了平衡状态 B.加入少量的X,ΔH变大 C.加入一定量的惰性气体,平衡向左移动 D.加入少量的Y,正反应速率加快 解析 混合气体的质量是变化的,容器容积不变,则气体的平均密度不变时,说明达到了平衡状态,A正确;B.加入少量的X,平衡向正反应方向进行,但ΔH不变,B错误;C.加入一定量的惰性气体,容器容积不变,速率不变,平衡不移动,C错误;D.Y是固体,加入少量的Y反应速率不变,D错误。 答案 A 2.已知某密闭容器中发生反应:X(g)+Y(g)mZ(g) ΔH<0。反应过程中,X、Y、Z的物质的量随时间的变化如图所示,则t1时刻改变的条件可能是( ) A.升高温度 B.加入更高效的催化剂 C.增大压强 D.加入一定量的Z 解析 正反应方向是放热反应,升高温度,平衡向逆反应方向进行,Z的物质的量减少,X或Y的物质的量增大,符合图像,A项正确;使用催化剂不影响化学平衡,B项错误;相同容器和时间,物质的量变化的比等于化学计量数之比,即m=2,反应前后气体化学计量数之和相等,增大压强,化学平衡不移动,C项错误;加入一定量的Z,Z的量增大,D项错误。 答案 A 3.(2019·湖南长沙一模)一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。测得v正(SO2)随反应时间(t)的变化如图所示,其中在t2时改变了某个条件。下列有关说法正确的是( ) A.t1时平衡常数K1小于t3时平衡常数K2 B.t1时平衡混合气的大于t3时平衡混合气的 C.t2时改变的条件可能是升温或缩小容器体积 D.t1时平衡混合气中SO3的体积分数等于t3时平衡混合气中SO3的体积分数 解析 该反应是气体分子数减小的放热反应,由题图知,t2时改变条件后正反应速率瞬间增大,之后逐渐减小,即平衡正向移动,则t2时改变的条件不可能是温度,温度不变,平衡常数不变,故A、C项错误;由题图知,t3和t1时达到的平衡是等效平衡,则t1时平衡混合气的等于t3时平衡混合气的,t1时平衡混合气中SO3的体积分数等于t3时平衡混合气中SO3的体积分数,B项错误,D项正确。 答案 D 4.用Na2FeO4溶液氧化废水中的还原性污染物M使其发生降解。为研究降解效果,设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间的关系如图所示,下列说法不正确的是( ) 实验编号 温度/℃ pH ① 25 1 ② 45 1 ③ 25 7 ④ 25 1 A.实验①在15 min内M的降解速率为1.33×10-5 mol·L-1·min-1 B.若其他条件相同,实验①②说明升高温度,M降解速率增大 C.若其他条件相同,实验①③证明pH越高,越不利于M的降解 D.实验④说明M的浓度越小,降解的速率越快 解析 根据化学反应速率的数学表达式,v(M)=mol·L-1·min-1=1.33×10-5 mol·L-1·min-1,A项正确;实验①②不同的是温度,②的温度高于①,在相同的时间段内,②中M的浓度变化大于①,说明②中M的降解速率大,故B项正确;实验①③温度相同, ③的pH大于①,在相同的时间段内,①中M浓度变化大于③,说明①的降解速率大于③,故C项正确;实验①④中M的浓度不同,0~15 min时间段内,④中M浓度变化小于①,说明M的浓度越小,降解速率越小,故D项错误。 答案 D 5.(2019·湖南湘东六校联考)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的材料。在密闭容器中按n(CH3OH)∶n(CO2)=2∶1投料直接合成DMC:2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)。一定条件下,平衡时CO2的转化率如图所示。下列说法不正确的是( ) A.该反应的正反应为放热反应 B.压强:p2>p1 C.X点对应的平衡常数为0.5 D.X、Y、Z三点对应的初始反应速率的关系为Z>Y>X 解析 在同一压强下,升高温度,二氧化碳的平衡转化率减小,说明平衡逆向移动,因此该反应属于放热反应,A正确。对该反应,增大压强,平衡正向移动,二氧化碳的平衡转化率增大,对比X、Y两点可知,压强:p2>p1,B正确。因为该反应在反应前后气体分子数不相等,容器的体积未知,所以无法计算反应的平衡常数, C错误。X、Y、Z三点中,Z点的温度最高、压强最大,所以Z点初始反应速率最快;X、Y两点的温度相同,但Y点的压强大于X点,所以Y点的初始速率大于X点,综上可知X、Y、Z三点对应的初始反应速率关系为Z>Y>X,D正确。 答案 C 6.(2019·重庆七校联考)将H2和CO2按物质的量之比为2∶1通入一密闭容器中,在一定条件下合成乙烯:6H2(g)+2CO2(g)CH2===CH2(g)+4H2O(g)。温度对CO2的平衡转化率和催化剂的催化效率的影响如图所示。 下列说法不正确的是( ) A.M点H2的体积分数为11.1% B.生成乙烯的速率:v(M)>v(N) C.250 ℃左右催化剂的催化效率最高 D.温度越高,CO2的体积分数越高 解析 M点CO2的平衡转化率为50%,设通入的CO2为a mol,则通入的H2为2a mol,反应的CO2为0.5a mol,反应的H2为1.5a mol,生成乙烯0.25a mol,生成H2O a mol,故M点H2的体积分数为×100%=22.2%,A项错误;M点的温度比N点高,且M点对应温度下催化剂的催化效率最高,故生成乙烯的速率v(M)>v(N),B项正确,由题给图像可知250 ℃时,催化剂的催化效率最高,C项正确;温度越高,CO2的转化率越低,CO2的体积分数越高,D项正确。 答案 A 7.将一定量的氨基甲酸铵固体置于特制的密闭真空容器中(容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表: 温度/℃ 15.0 20.0 25.0 30.0 35.0 平衡总压强/kPa 5.7 p1 12.0 p2 24.0 平衡气体总浓度/(10-3mol·L-1) 2.4 3.4 4.8 6.8 9.4 下列说法中正确的是( ) A.混合气体的平均相对分子质量不再随时间变化时反应达平衡状态 B.15.0 ℃时NH2COONH4(s)分解的平衡常数为2.0×10-9 C.该反应ΔH>0,p2=2p1 D.若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大 解析 A.只有产物是气体,故反应过程中混合气体的平均相对分子质量不随时间变化,故不能作为平衡与否的标志,A项错误;B.需将15.0 ℃时平衡气体的总浓度转化为NH3和CO2的浓度:c(NH3)=×2.4×10-3mol·L-1=1.6×10-3 mol·L-1,c(CO2)=×2.4×10-3 mol·L-1=0.8×10-3mol·L-1,K=(1.6×10-3)2×0.8×10-3≈2.0×10-9,B项正确;C.温度升高K增大,故为吸热反应,平衡总浓度后者是前者的2倍,若温度相同,则p2=2p1,但温度后者大于前者,故p2>2p1,C项错误;D.若在恒温下将平衡体系体积减半,相当于压强增大到原来的两倍,产物浓度增大,平衡逆向移动,但温度不变,K不变,故再达平衡后,c(NH3)和c(CO2)均与原来平衡一样,D项错误。 答案 B 8.(2019·东北育才中学月考)由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如下表所示: 实验 起始时 平衡时 n(CO)/mol n(H2S)/ mol n(COS)/ mol n(H2)/ mol n(CO)/ mol 1 150 10.0 10.0 0 0 7.0 2 150 7.0 8.0 2.0 4.5 a 3 400 20.0 20.0 0 0 16.0 下列说法正确的是( ) A.上述反应是吸热反应 B.实验1达平衡时,CO的转化率为70% C.实验2达平衡时,a<7.0 D.实验3达平衡时,再充入1.0 mol H2,平衡逆向移动,平衡常数值增大 解析 相同温度时实验3中开始通入20.0 mol CO和20.0 mol H2S建立的平衡与实验1中开始通入10.0 mol CO和10.0 mol H2S建立的平衡互为等效平衡。若在150 ℃时通入20.0 mol CO和20.0 mol H2S达到平衡,CO物质的量应为(20-20×) mol=14 mol,实验3中温度为400 ℃,平衡时CO的物质的量为16 mol,说明升高温度,平衡向逆反应方向移动,即正反应是放热反应,故A项错误;实验1中消耗CO的物质的量为(10.0-7.0) mol=3.0 mol,即CO的转化率为×1 00%=30%,故B项错误;根据“三段式”: 此温度下,K==。实验2中开始时浓度商Q==<K,说明开始时反应正向进行,则达到平衡时CO的物质的量小于7 mol,即a<7.0,故C项正确;平衡常数只受温度的影响,因此再充入1.0 mol H2,平衡逆向移动,但化学平衡常数不变,故D项错误。 答案 C 9.(2019·山东济宁质检)汽车尾气(用N2O表示)是空气污染源之一。回答下列问题: (1)用CO还原N2O的能量变化如下图所示,则该反应的热化学方程式为____________________________________________________________ ____________________________________________________________。 在相同温度和压强下,1 mol N2O和1 mol CO经过相同反应时间测得如下实验数据: 实验 温度/℃ 催化剂 N2 O转化率/% 实验1 400 催化剂1 9.5 400 催化剂2 10.6 实验2 500 催化剂1 12.3 500 催化剂2 13.5 试分析在相同温度时,催化剂2催化下N2O转化率更高的原因是____________________________________________________________ ____________________________________________________________。 (2)在体积均为1 L的密闭容器A(500 ℃,恒温)、B(起始500 ℃,绝热)中分别加入0.1 mol N2O、0.4 mol CO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图所示。 ①B容器中N2O的转化率随时间的变化关系是上图中的________曲线。 ②要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是________(答出1项即可)。 ③500 ℃该反应的化学平衡常数K=________(用分数表示)。 ④实验测定该反应的反应速率v正=k正·c(N2O)·c(CO),v逆=k逆·c(N2)·c(CO2)。k正、k逆分别是正、逆反应速率常数,c为物质的量浓度。计算M处的=________(保留两位小数)。 解析 (1)由图示可知该反应的ΔH=-362.8 kJ·mol-1,该反应的热化学方程式为N2O(g)+CO(g)===N2(g)+CO2(g) ΔH=-362.8 kJ·mol-1。由图示可知催化剂2对活化能降低幅度更大,活化分子百分数更大,反应速率更快,相同反应时间内转化量更大,转化率更高。 (2)①B为绝热容器,反应放热,反应过程中B的温度高于A,B的平衡状态应该在A的平衡状态的基础上向逆反应方向移动,N2O的转化率降低,故应选a。 ②不改变N2 O的平衡转化率即不改变平衡状态,缩短达到平衡状态所需时间应加压或加入N2O、CO(物质的量之比为1∶4)等。 ③达到平衡时αN2O=25%。 K===。 ④M处N2O的转化率αN2O=0.2 v正=k正·c(N2O)·c(CO)=k正×0.08×0.38 又=K v逆=k逆·c(N2)·c(CO2)=k逆×0.02×0.02 ==76×=76×=1.69。 答案 (1)N2O(g)+CO(g)N2(g)+CO2(g) ΔH=-362.8 kJ·mol-1 催化剂2对活化能降低幅度大,反应速率快,相同时间内消耗N2O多,故N2O转化率高 (2)①a ②加压或加入N2O、CO(物质的量之比为1∶4) ③ ④1.69 10.(2019·衡水中学一模)(1)一定温度下,在1 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气,发生反应:2H2O(g)2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时段产生O2的物质的量见下表: 时间/min 15 30 45 60 75 n(O2)/mol 0.020 0.030 0.036 0.040 0.040 ①前30 min的反应速率v(H2O)=________;该温度下,反应的平衡常数K=________ mol·L-1。 ②当下列物理量不发生变化时,能说明该反应已达到平衡状态的是________(填字母)。 a.混合气体的密度 b.容器内气体的压强 c.H2的物质的量浓度 d.该反应的化学平衡常数 (2)一定条件下,以Cu2O为催化剂,向密闭容器中充入一定量的氯苯和水蒸气能发生以下反应: ΔH<0 起始时,氯苯与水蒸气的物质的量之比为w,平衡时H2O(g)的体积分数(φ)与温度(T)、w的关系如图甲所示。w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。 ①图甲中,w2________(填“>”“<”或“=”)1;图乙中,表示正反应平衡常数的曲线为________(填“A”或“B”)。 ②若起始时向某恒容绝热容器中充入1 mol氯苯和1 mol水蒸气,达到平衡时,容器内气体压强________(填“增大”“减小”或“不变”),原因是____________________________________________________________。 解析 (1)①由表中数据可知前30 min vH2O=×2=2×10-3 mol·L-1·min-1 平衡时c(O2)=0.04 mol·L-1,故c(H2)=0.08 mol·L-1,c(H2O)=0.02 mol·L-1 K===0.64 ②温度一定,K为定值,d错误;恒容容器,反应中全部为气体,ρ为定值,a错误;p、c(H2)为变量,不变时可说明已达平衡。 (2)①由图分析知w2时,φH2O小,说明反应向正反应方向移动,故w2>1。该反应ΔH<0,温度升高,K值减小,故表示正反应平衡常数的曲线应为B。②恒容绝热容器充入反应物,结合ΔH<0可知体系温度升高,反应为体积不变的反应,物质的量不变,压强增大。 答案 (1)①2×10-3 mol·L-1·min-1 0.64 ②b、c (2)①> B ②增大 该反应为等体积反应,反应放热,温度升高,压强增大 11.(2019·山东日照一模)二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提纯,合理利用,意义重大。 (1)在空间站中常利用CO2(g)+2H2(g)C(s)+2H2O(g),再电解水实现O2的循环利用。350 ℃时,向体积为2 L的恒容密闭容器中通入8 mol H2和4 mol CO2发生以上反应。 ①若反应起始和平衡时温度相同(均为350 ℃),测得反应过程中压强(p)随时间(t)的变化如图Ⅰ中a所示,则上述反应的ΔH________0(填“>”或“<”);其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图Ⅰ中曲线b所示,则改变的条件是________________________________。 ②图Ⅱ是反应平衡常数的对数值与温度的变化关系图,m的值为________。 (2)CO2在Cu-ZnO催化下,同时发生如下反应Ⅰ、Ⅱ,是解决温室效应和能源短缺的重要手段。 Ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1<0 Ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2>0 保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表: CO2 H2 CH3OH(g) CO H2O(g) 总压强/kPa 起始/mol 0.5 0.9 0 0 0 p0 平衡/mol n 0.3 p 若反应Ⅰ、Ⅱ均达平衡时,p0=1.4p,则表中n=________;反应Ⅰ的平衡常数Kp=________(kPa)-2。(用含p的式子表示) 解析 (1)①由图1知反应过程中压强先增大后减小,据CO2(g)+2H2(g)C(s)+2H2O(g)压强应减小,故该反应为放热反应,ΔH<0。由图1知反应速率加快,平衡状态不变,又该反应为非等体反应,故改变条件为加入催化剂。 故= x=2 mol K===1 m=lg K=lg 1=0 (2)由=可知=,n平=1 分析反应Ⅰ、Ⅱ知Ⅱ为等体反应,压强变化与Ⅱ无关,故 n=0.2 由平衡时n(H2O)(g)=0.3 mol可知反应Ⅱ中生成了0.1 mol H2O(g), 平衡时n(CO2)=0.5 mol-0.2 mol-0.1 mol=0.2 mol,n(H2)=0.9 mol-0.6 mol-0.1 mol=0.2 mol n(CH3OH)=0.2 mol,n(H2O)=0.3 mol,n(CO)=0.1 mol n总=0.2 mol+0.2 mol+0.2 mol+0.3 mol+0.1 mol=1 mol Kp=== (kPa)-2 答案 (1)①< 加入催化剂 ②0 (2)0.2 12.(1)(2019·山东德州二模)一定温度下,分别向A、B容器中充入5 mol NO和2.5 mol O2,A保持恒容,B保持恒压。发生反应2NO(g)+O2(g)2NO2(g)[不考虑2NO2(g)N2O4(g)],起始时A、B的体积均为2 L。 ①下列能说明A、B容器均达到平衡状态的是________。 a.A、B容器的压强均不发生变化 b.A、B容器中气体的颜色均不发生变化 c.A、B容器中气体的密度不再发生变化 d.A、B容器中气体的平均摩尔质量不再发生变化 ②T ℃时,A、B容器均达到平衡状态时,A中O2的浓度为0.5 mol·L-1,则NO的转化率为________,B中反应的平衡常数KB=________。 解析 ①a项,容器A中压强为变量而容器B中压强为恒量,压强不变,B容器中不能说明反应已达平衡状态;b项,气体颜色不变说明c(NO2)不变,可说明反应已达平衡状态;c项,A容器为恒容容器,而反应中的物质全部为气体,总质量不变,由ρ=可知ρ为恒量,不能说明反应达到平衡状态;d项,M=,由于反应前后均为气体mT不变,反应前后气体物质的计量系数不同,故M为变量,M不变可说明反应已达平衡状态。 c(O2)=-=0.5 mol/L,x=1.5 则NO的转化率为×100%=60%。 平衡时c(NO)=1 mol·L-1,c(O2)=0.5 mol·L-1,c(NO2)=1.5 mol·L-1 KB=KA===4.5 答案 ①b、d ②60% 4.5 (2)(2019·山东济宁二模)容积均为1 L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器,相同条件下,分别充入0.2 mol的NO2,发生反应:2NO2(g)N2O4(g) ΔH<0,甲中的NO2的相关量随时间变化如图所示。 ①0~3 s内,甲容器中NO2的反应速率增大的原因是____________________________________________________________ ____________________________________________________________。 ②甲达平衡时,温度若为T ℃,此温度下的平衡常数K=________。 ③平衡时,K甲________K乙,p甲________p乙(填“>”、“<”或“=”)。 解析 ①随反应的进行,反应物浓度减小,反应速率应减慢,而0~3 s内,甲容器中反应速率加快是因为该反应ΔH<0,甲为绝热容器,随反应进行温度升高,反应速率加快。②T ℃时,达到平衡时c(NO2)=0.02 mol·L-1,则c(N2O4)==0.09 mol·L-1 K===225 ③达到平衡时,甲的温度高于乙的温度,温度越高,放热反应的平衡常数减小,故K甲<K乙,温度越高,压强越大,p甲>p乙。 答案 ①反应放热,温度升高,反应速率加快 ②225 ③< > (3)[2019·北京理综,27(1)③④]氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。 (1)甲烷水蒸气催化重整是制高纯氢的方法之一。 ①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1。 ②已知甲烷与水蒸气反应的化学方程式为CH4+2H2O===4H2+CO2。 反应器中还存在如下反应: ⅰ.CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1 ⅱ.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2 ⅲ.CH4(g)===C(s)+2H2(g) ΔH3 …… ③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是________(选填字母序号)。 a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成 ④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。 从t1时开始,H2体积分数显著降低,单位时间CaO消耗率________(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:________________________________________________。 解析 ③反应物的投料比n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,H2O(g)的物质的量增加,有利于促进CH4转化,促进CO转化为CO2,防止CH4分解生成C(s),从而减少积炭生成。④根据题图可知,从t1时开始,CaO消耗率曲线的斜率逐渐减小,单位时间内CaO消耗率逐渐降低。CaO与CO2反应生成CaCO3,CaCO3会覆盖在CaO表面,减少了CO2与CaO的接触面积,从而失效。 答案 ③abc ④降低 CaO+CO2===CaCO3,CaCO3覆盖在CaO表面,减少了CO2与CaO的接触面积 13.(2019·课标全国Ⅰ,28)水煤气变换[CO(g)+H2O(g)===CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题: (1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.025 0。 ②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.019 2。 根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO________H2(填“大于”或“小于”)。 (2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2 O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为________(填标号)。 A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50 (3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。 可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式____________________________________________________________。 (4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。 计算曲线a的反应在30~90 min内的平均速率v(a)=________ kPa·min-1。467 ℃时pH2和pCO随时间变化关系的曲线分别是________、________。489 ℃时pH2和pCO随时间变化关系的曲线分别是________、________。 解析 (1)由题给信息①可知,H2(g)+CoO(s)Co(s)+H2O(g)(ⅰ) K1===39,由题给信息②可知,CO(g)+CoO(s)Co(s)+CO 2(g)(ⅱ) K2==≈51.08。相同温度下,平衡常数越大,反应倾向越大,故CO还原氧化钴的倾向大于H2。(2)第(1)问和第(2)问的温度相同,利用盖斯定律,由(ⅱ)-(ⅰ)得CO(g)+H2O(g)CO2(g)+H2(g) K==≈1.31。设起始时CO(g)、H2O(g)的物质的量都为1 mol,容器体积为1 L,在721 ℃下,反应达平衡时H2的物质的量为x mol。 K==1.31,若K取1,则x=0.5,φ(H2)=0.25;若K取4,则x≈0.67,φ(H2)≈0.33。氢气的物质的量分数介于0.25至0.33之间,故选C。(3)观察起始态物质的相对能量与终态物质的相对能量知,终态物质相对能量低于始态物质相对能量,说明该反应是放热反应,ΔH小于0。过渡态物质相对能量与起始态物质相对能量相差越大,活化能越大,由题图知,最大活化能E正=1.86 eV-(-0.16 eV)=2.02 eV,该步起始物质为COOH*+H*+H2O*,产物为COOH*+2H*+OH*。(4)由题图可知,30~90 min内v(a)==0.004 7 kPa·min-1。水煤气变换中CO是反应物,H2是产物,又该反应是放热反应,升高温度,平衡向左移动,重新达到平衡时,H2的压强减小,CO的压强增大。故a曲线代表489 ℃时,pH2随时间变化关系的曲线,d曲线代表489 ℃时pCO随时间变化关系的曲线,b曲线代表467 ℃时pH2随时间变化关系的曲线,c曲线代表467 ℃时pCO随时间变化关系的曲线。 答案 (1)大于 (2)C (3)小于 2.02 COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*) (4)0.004 7 b c a d查看更多