- 2021-07-02 发布 |
- 37.5 KB |
- 15页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版难溶电解质的溶解平衡学案(2)
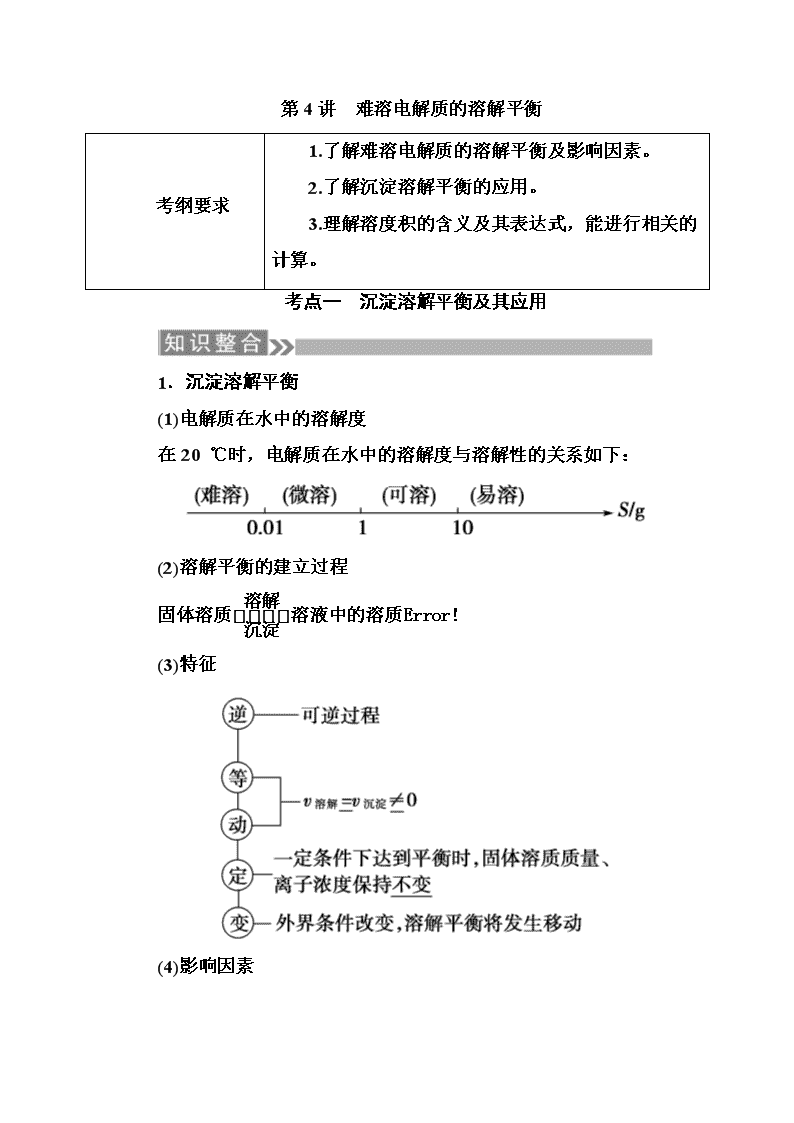
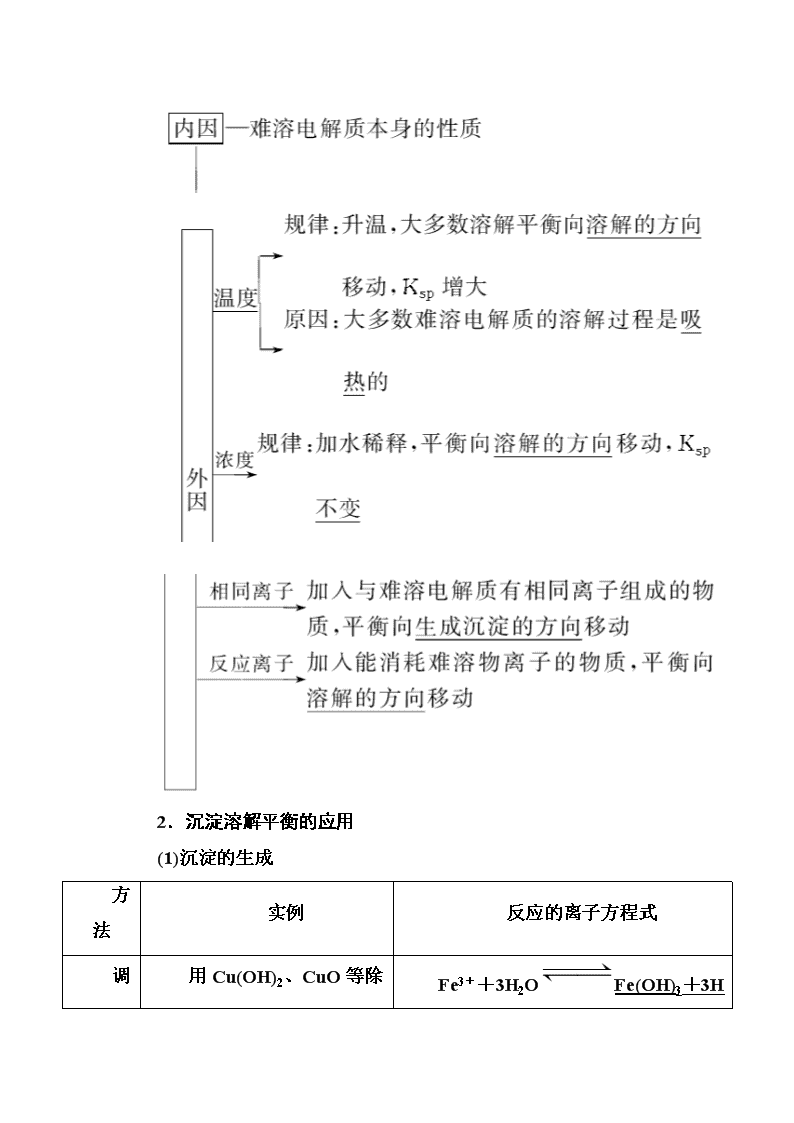
第4讲 难溶电解质的溶解平衡 考纲要求 1.了解难溶电解质的溶解平衡及影响因素。 2.了解沉淀溶解平衡的应用。 3.理解溶度积的含义及其表达式,能进行相关的计算。 考点一 沉淀溶解平衡及其应用 1.沉淀溶解平衡 (1)电解质在水中的溶解度 在20 ℃时,电解质在水中的溶解度与溶解性的关系如下: (2)溶解平衡的建立过程 固体溶质溶液中的溶质 (3)特征 (4)影响因素 2.沉淀溶解平衡的应用 (1)沉淀的生成 方法 实例 反应的离子方程式 用Cu(OH)2、CuO Fe3++3H2OFe(OH)3+3H 调节pH法 等除去CuCl2中的FeCl3 +、Cu(OH)2+2H+===Cu2++2H2O 沉淀剂法 以Na2S、H2S等作沉淀剂除去污水中的重金属离子(Cu2+、Hg2+等) H2S+Cu2+===CuS↓+2H+ (2)沉淀的溶解 ①酸溶解法:如CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。 ②盐溶解法:如Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH===Mg2++2NH3·H2O。 (3)沉淀的转化 ①实质:沉淀溶解平衡的移动。 ②特征: a.一般说来,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。 b.沉淀的溶解度差别越大,越容易转化。 ③应用: a.锅炉除垢:将CaSO4转化为CaCO3,离子方程式为:CaSO4+CO===CaCO3+SO。 b.矿物转化:CuSO4溶液遇ZnS(闪锌矿)转化为CuS(铜蓝)的离子方程式为:Cu2+(aq)+ZnS(s)===CuS(s)+Zn2+(aq)。 【感悟测评】 判断正误(正确的打“√”,错误的打“×”) (1)向0.1 mol/L的AgNO3溶液中加入过量的盐酸完全反应后溶液中无Ag+。( ) (2)沉淀溶解平衡也属于化学平衡,属于动态平衡,即[v(溶解)=v(沉淀)≠0]。( ) (3)在一定条件下,难溶物达到溶解平衡时,固体质量、离子浓度不再随时间改变而改变。( ) (4)外界条件改变,溶解平衡一定发生移动。( ) (5)CaCO3===Ca2++CO与CaCO3(s)Ca2+(aq)+CO(aq) 所表达的意义分别是CaCO3的电离方程式和沉淀溶解平衡式。( ) 答案:(1)× (2)√ (3)√ (4)× (5)√ 1.沉淀溶解平衡的影响因素 以AgCl(s) Ag+(aq)+Cl-(aq) ΔH>0为例分析外界条件改变对沉淀溶解平衡的影响 外界条件 移动方向 平衡后c(Ag+) 平衡后c(Cl-) Ksp 升高温度 正向 增大 增大 增大 加水稀释 正向 不变 不变 不变 加入少量AgNO3 逆向 增大 减小 不变 通入HCl 逆向 减小 增大 不变 通入H2S 正向 减小 增大 不变 2.难溶电解质的溶解平衡中的易错点 (1)沉淀溶解平衡是化学平衡的一种,沉淀溶解平衡移动分析时也同样遵循勒夏特列原理。 (2)溶解平衡一般是吸热的,温度升高平衡右移,Ksp增大,但Ca(OH)2相反。 (3)溶度积大的难溶电解质的溶解度不一定大,只有组成相似的难溶电解质才有可比性。 (4)复分解反应总是向着某些离子浓度减小的方向进行,若生成难溶电解质,则向着生成溶度积较小的难溶电解质的方向进行。 (5)与平衡常数一样,Ksp与温度有关。不过温度改变不大时,Ksp变化也不大,常温下的计算可不考虑温度的影响。 考向一 沉淀溶解平衡及其影响因素 1.(2018·闵行区二模)常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,以下叙述错误的是( ) A.有溶质析出 B.溶液中Ca2+的数目不变 C.溶剂的质量减小 D.溶液的pH不变 解析:氧化钙溶于水,结合水生成氢氧化钙,水的质量减少,有溶质析出,A正确;由于溶剂减少,温度不变,溶解度不变,故钙离子的物质的量减小,即溶液中Ca2+的数目减少,B错误;水与氧化钙反应生成氢氧化钙,溶剂质量减小,C正确;温度不变,氢氧化钙的溶度积常数不变,氢氧根浓度不变,pH不变,D正确。 答案:B 2.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量 CaO粉末,下列说法正确的是( ) ①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)·c(OH-)的积不变 ⑤c(H+)一定增大 A.① B.①⑤ C.①②④ D.①③ 解析:由于绝热容器中热量不损失,向Ca(OH)2中加入CaO,氧化钙溶于水放热,温度升高,导致氢氧化钙的溶解度减小,溶液中溶质的浓度减小,同时水的离子积增大,①由于溶液温度升高,氢氧化钙溶解度减小,溶液中有氢氧化钙晶体析出,①正确;②溶液中Ca(OH)2的溶解度减小,氢氧化钙的浓度会减小,②错误;③溶液中Ca(OH)2的溶解度减小,溶液中的OH-的浓度减小,H+的浓度增大,③错误;④由于反应后温度升高,水的离子积增大,④错误;⑤由于 Ca(OH)2的溶解度减小,溶液中的OH-浓度减小,H+的浓度增大,⑤正确。 答案:B 考向二 沉淀溶解平衡在生产生活中的应用 3.(2018·闸北区模拟)可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:某温度下,Ksp(BaCO3)=5.1×10-9,Ksp(BaSO4)=1.1×10-10,下列推断正确的是( ) A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 C.若误饮c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒 D.可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃 解析:因胃酸可与CO反应生成水和二氧化碳,使CO浓度降低,从而使平衡BaCO3(s)Ba2+(aq)+CO(aq)向溶解方向移动,使Ba2+浓度增大,Ba2+有毒,与Ksp大小无关,A错误;BaCO3溶于胃酸,起不到解毒的作用,B错误;c(Ba2+)=1.0×10-5 mol·L-1的溶液钡离子浓度很小,不会引起钡离子中毒,C错误;用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃,反应后c(Ba2+)= mol/L,浓度很小,可起到解毒的作用,D正确。 答案:D 4.(2018·重庆一中月考)Cu(OH)2在水中存在如下溶解平衡:Cu(OH)2(s)Cu2+(aq)+2OH-(aq),常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于( ) A.2 B.3 C.4 D.5 解析:氢氧化铜的溶度积:Ksp=c(Cu2+)·c2(OH-)=2×10-20,c(Cu2+)=0.02 mol/L,如果生成Cu(OH)2沉淀,则氢氧根离子的物质的量浓度至少为:c(OH-)= mol/L=1×10-9 mol/L,所以溶液中氢离子浓度为:c(H+)= mol/L=10-5 mol/L,所以若要生成 Cu(OH)2沉淀,应调整溶液pH>5。 答案:D 【题后悟道】 沉淀完全的理解 用沉淀法除杂不可能将杂质离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已经完全。 考点二 溶度积常数及其应用 1.溶度积和离子积 以AmBn(s)mAn+(aq)+nBm-(aq)为例: 溶度积 离子积 概念 沉淀溶解的平衡常数 溶液中有关离子浓度幂的乘积 符号 Ksp Qc 表达式 Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度为平衡浓度 Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度是任意浓度 应用 判断在一定条件下沉淀能否生成或溶解 2.Ksp的影响因素 (1)内因:难溶物质本身的性质,是主要决定因素。 (2)外因 ①浓度:加水稀释,平衡向溶解方向移动,Ksp不变。 ②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp增大。 ③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,Ksp不变。 【感悟测评】 判断正误(正确的打“√”,错误的打“×”) (1)两难溶电解质作比较时,Ksp小的溶解度一定小。( ) (2)升高温度,难溶电解质的Ksp一定增大。( ) (3)常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明Ksp(BaCO3)查看更多
相关文章
- 当前文档收益归属上传用户