- 2021-07-02 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年江苏省启东中学高二学业水平模拟(最后一考)化学试题 Word版
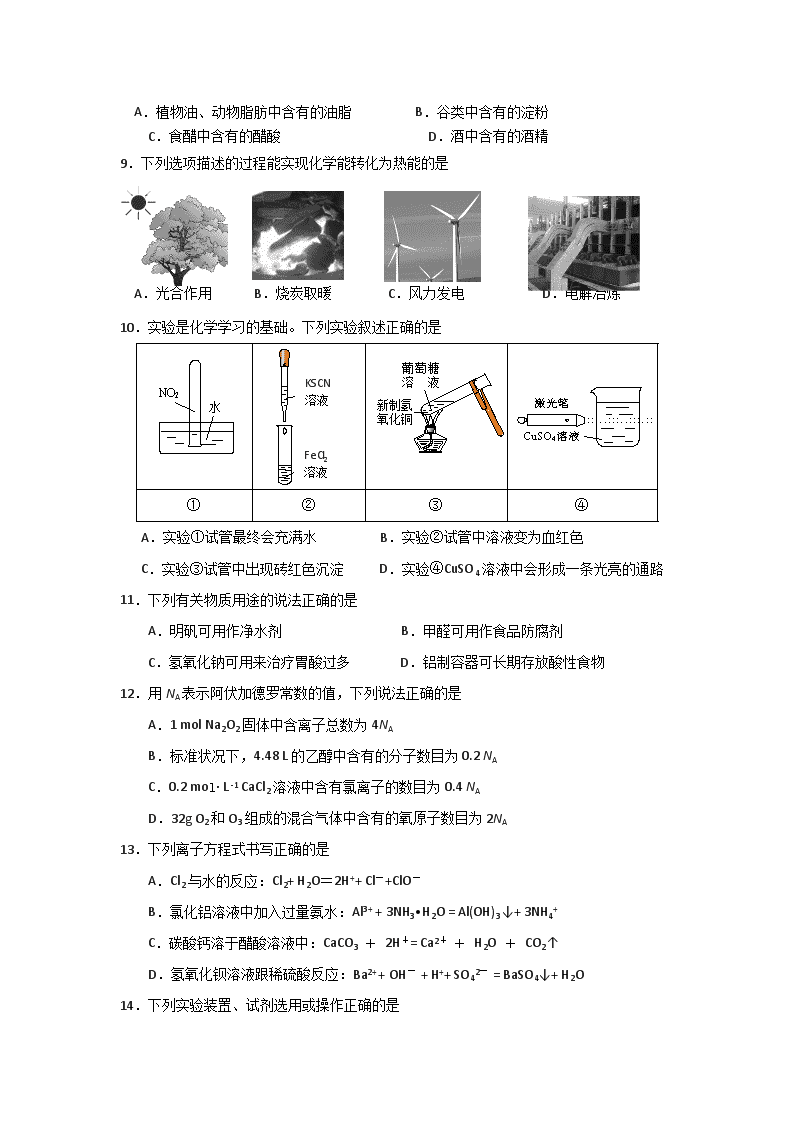
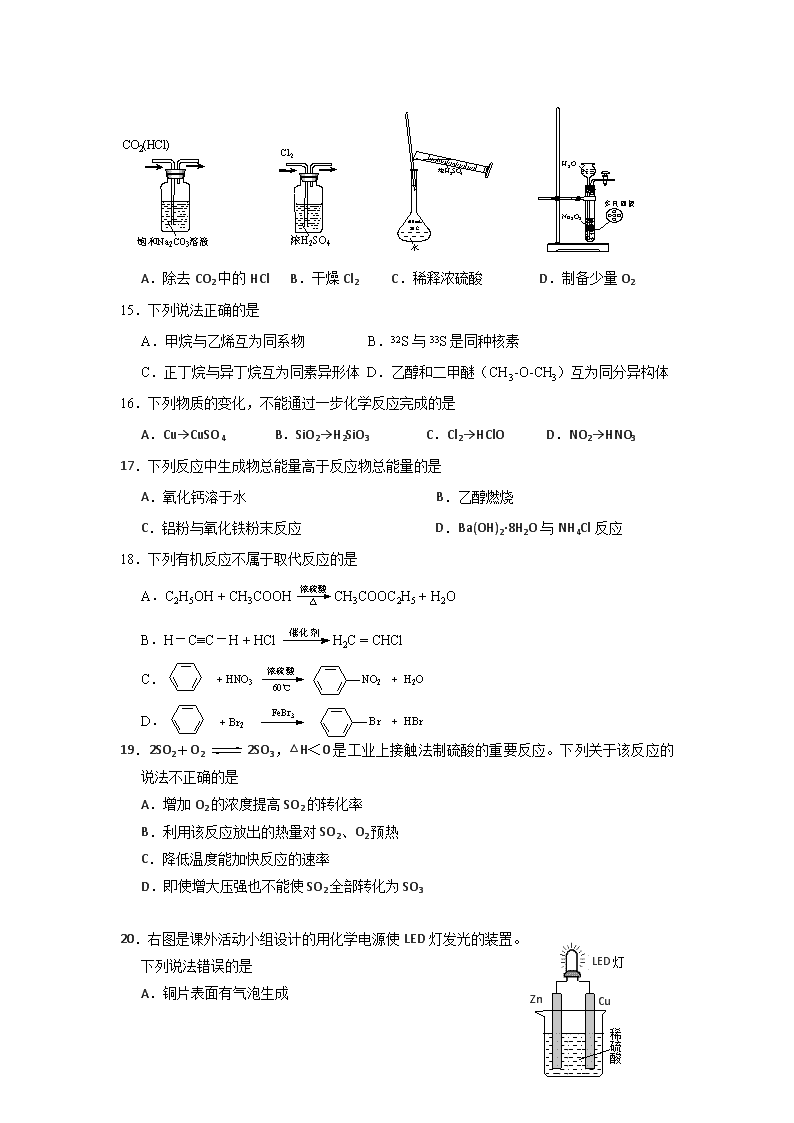
江苏省启东中学2017~2018学年度第二学期学测模拟测试 高二化学(2018.3.10) 本试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分,共100分。考试时间75分钟。 可能用到的相对原子质量:H-1 N-14 O-16 Cl-35.5 Mg-24 Al-27 Cu-64 Ag-108 Mn-55 I-127 Na-23 S-32 第Ⅰ卷(选择题 共69分) 单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)。 1.“保护环境”是我国的基本国策。下列做法不应该提倡的是 A.对生活废弃物进行分类处置 B.过度开发资源促进经济发展 C.煤炭燃烧时安装“固硫”装置 D.宣传“低碳”出行 2.下列化学用语的表达正确的是 A.H2O2的电子式: B.乙酸的结构简式:C2H4O2 C.中子数为20的氯原子: D.CH4的球棍模型: 3.下列变化属于物理变化的是 A.用石油分馏炼制汽油 B.用煤干馏制备焦炭 C.电解饱和食盐水制烧碱 D.用海带提取碘单质 4.工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是:Fe2O3+3CO =2Fe+3CO2 ,对 于该反应,下列说法正确的是 A.反应中转移3个电子 B.Fe2O3发生还原反应 C.CO被还原 D.CO为氧化剂 5.某溶液中存在大量的K+、OHˉ、CO32ˉ,该溶液中还可能大量存在的离子是 A. Al3+ B.NH4+ C.Fe3+ D.SO42ˉ 6.乙醇和乙酸是生活中两种常见的有机物。下列说法正确的是 A.乙醇、乙酸互为同分异构体 B.乙醇、乙酸都能与钠反应 C.乙醇、乙酸都能与NaOH溶液反应 D.乙醇、乙酸都能使紫色石蕊试液变红色 7.下列物质均可用于漂白,漂白原理不同于其它的是 A.次氯酸钙 B.次氯酸钠 C.氯水 D.活性炭 8.以下食品中的有机成分属于高分子化合物的是 A.植物油、动物脂肪中含有的油脂 B.谷类中含有的淀粉 C.食醋中含有的醋酸 D.酒中含有的酒精 9.下列选项描述的过程能实现化学能转化为热能的是 A.光合作用 B.烧炭取暖 C.风力发电 D.电解冶炼 10.实验是化学学习的基础。下列实验叙述正确的是 FeCl2 溶液 KSCN 溶液 ① ② ③ ④ A.实验①试管最终会充满水 B.实验②试管中溶液变为血红色 C.实验③试管中出现砖红色沉淀 D.实验④CuSO4溶液中会形成一条光亮的通路 11.下列有关物质用途的说法正确的是 A.明矾可用作净水剂 B.甲醛可用作食品防腐剂 C.氢氧化钠可用来治疗胃酸过多 D.铝制容器可长期存放酸性食物 12.用NA表示阿伏加德罗常数的值,下列说法正确的是 A.1 mol Na2O2固体中含离子总数为4NA B.标准状况下,4.48 L的乙醇中含有的分子数目为0.2 NA C.0.2 mol· L -1 CaCl2溶液中含有氯离子的数目为0.4 NA D.32g O2和O3组成的混合气体中含有的氧原子数目为2NA 13.下列离子方程式书写正确的是 A.Cl2与水的反应:Cl2+ H2O=2H++ Cl-+ClO- B.氯化铝溶液中加入过量氨水:Al3+ + 3NH3•H2O = Al(OH)3↓+ 3NH4+ C.碳酸钙溶于醋酸溶液中:CaCO3 + 2H+= Ca2+ + H2O + CO2↑ D.氢氧化钡溶液跟稀硫酸反应:Ba2+ + OH- + H++ SO42- = BaSO4↓+ H2O 14.下列实验装置、试剂选用或操作正确的是 A.除去CO2中的HCl B.干燥Cl2 C.稀释浓硫酸 D.制备少量O2[ 15.下列说法正确的是 A.甲烷与乙烯互为同系物 B.32S与33S是同种核素 C.正丁烷与异丁烷互为同素异形体 D.乙醇和二甲醚(CH3-O-CH3)互为同分异构体 16.下列物质的变化,不能通过一步化学反应完成的是 A.Cu→CuSO4 B.SiO2→H2SiO3 C.Cl2→HClO D.NO2→HNO3 17.下列反应中生成物总能量高于反应物总能量的是 A.氧化钙溶于水 B.乙醇燃烧 C.铝粉与氧化铁粉末反应 D.Ba(OH)2·8H2O与NH4Cl反应 18.下列有机反应不属于取代反应的是 A.C2H5OH + CH3COOHCH3COOC2H5 + H2O B.H-C≡C-H + HClH2C = CHCl C. D. 19.2SO2+O22SO3,△H<0是工业上接触法制硫酸的重要反应。下列关于该反应的说法不正确的是 A.增加O2的浓度提高SO2的转化率 B.利用该反应放出的热量对SO2、O2预热 C.降低温度能加快反应的速率 D.即使增大压强也不能使SO2全部转化为SO3 Zn Cu LED灯 稀硫酸 20.右图是课外活动小组设计的用化学电源使LED灯发光的装置。 下列说法错误的是 A.铜片表面有气泡生成 B.装置中存在“化学能→电能→光能”的转换 C.如果将硫酸换成柠檬汁,导线中不会有电子流动 D.如果将锌片换成铁片,电路中的电流方向不变 21.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是 X Y Z ① NaOH溶液 Al(OH)3 稀硫酸 ② KOH溶液 SiO2 稀盐酸 ③ O2 N2 H2 ④ FeCl3溶液 Cu 浓硝酸 A.①③ B.①④ C.②④ D.②③ 22.短周期元素A、B、C、D、E,原子序数依次增大。已知元素A的气态氢化物和A的 最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子 数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈 的金属元素。下列叙述不正确的是 A.元素A的氧化物常温下一般均为无色无味气体 B.元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 C.原子半径:C>D>B D.元素B的气态氢化物的沸点比元素E气态氢化物的沸点高 23.某溶液中可能含有下列5种离子中的几种:Na+、NH4+、Mg2+、Al3+、Cl-。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入32.5 mL 4.00 mol•L-1 NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成.过滤、洗涤、干燥,得沉淀2.03 g。再将滤液稀释至100mL,测得滤液中c(OH-)=0.2 mol•L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀14.35 g。关于原溶液组成结论正确的是 A.一定含有Mg2+、Al3+、Cl-,不含有Na+、NH4+ B.一定含有Na+、Mg2+、Cl-,不含有NH4+、可能含有Al3+ C.c(Mg2+)为1.75 mol•L-1,c(Na+)为1.50 mol•L-1 D.c(Cl-)为5.00 mol•L-1,c(Al3+)为1.00 mol•L-1 第Ⅱ卷(非选择题 共31分) 二、非选择题(本部分4题,共31分) 24.(15分)《化学与生活》 (1)(3分)食物是人类赖以生存的物质基础。 ① 食物中含有的蛋白质、油脂、淀粉都是人体所需的营养素。蛋白质在人体中完全水解的产物是____________(填名称),淀粉在人体内水解的最终产物是葡萄糖,葡萄糖的结构简式为_______________________________。 ② 市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是________(填字母)。 a.加锌盐 b.加碘盐 c.加钙盐 (2)(5分)为加强南海建设,我国对南海多个岛屿进行了“吹埋扩建”。 ① 海岛生态环境十分脆弱,下列做法不利于海岛环境保护的是________(填字母)。 a.在海岛上植树造林,加强绿化 b.建设海水淡化厂,减少对海岛地下水的开采 c.在海岛上开展风力发电,减少燃油发电机的使用 d.将生活垃圾运离海岛,就近抛入大海 ② 建设岛屿时需用大量水泥、玻璃,它们属于________(填字母)。 a.金属材料 b.无机非金属材料 c.有机高分子材料 ③ 建设岛屿的工程机械易生锈受损,下列措施中不能减缓工程机械生锈受损的是________(填字母) a.对机械配件进行发蓝处理 b.机械停用后及时擦干涂油 c.在机械表面刷上油漆 d.在机械表面上附着多块铜板 ④ 海岛上往往缺少新鲜蔬菜,建岛工人需服用含______(填字母)的营养剂,以防止患上“坏血病”。 a.维生素A b.维生素B c.维生素C d.维生素D ⑤ 海岛上生存环境恶劣,工人需准备一些常用药物,可选用_____(填字母)进行解热镇痛。 a.阿司匹林 b.青霉素 c.胃舒平 d.吗啡 (3)(7分)受经济结构转型以及大气环保压力的抑制,2017年我国对煤炭需求明显减少。 ① 煤炭直接燃烧会引起多种环境问题。正常雨水的pH______7(填>、=或<),燃煤产生的SO2增加了________型酸雨形成的可能;在燃煤中加入石灰石,可减少SO2的排放,写出相关反应方程式:________________________________________。 ② 治理被酸雨侵蚀过的酸性土壤,可以加入适量的_____________(填字母)。 a.Ca(OH)2 b.KNO3 c.SiO2 d.NaCl ③ 处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,发生反应的化学方程式为______________________________________________。 25.(6分)下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是 常见的气体单质。气体B与气体C相遇产生大量的白烟,D是日常生活中常见的盐(部 分反应物和生成物及溶剂水已略去)。请回答下列问题: (1)甲元素在周期表中的位置 ▲ 。 (2)B的电子式为 ▲ 。 (3)写出A溶液和甲反应的离子方程式 ▲ 。 (4)写出A和E反应的化学方程式 ▲ 。 26.(10分)工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下: 已知: ①浸出过程中发生的主要反应化学方程式为:MnO2+SO2 = MnSO4 ②浸出液中阳离子主要有Mn2+、Fe2+、Al3+等 回答下列问题: (1)物质X最好选用 ▲ 。 a.盐酸 b.硫酸 c.硝酸 (2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 ▲ 。 (3)流程中“氧化”步骤主要反应的离子方程式是 ▲ 。 (4)加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 ▲ 。 (5)用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下: ① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快); ② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O; ③ I2+2S2O32-=S4O62-+2I-。 计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。 ▲ 江苏省启东中学2017-2018学年度学测最后一考 参考答案 一、选择题 题号 1 2 3 4 5 6 7 8 9 10 11 12 答案 B A A B D B D B B C A D 题号 13 14 15 16 17 18 19 20 21 22 23 答案 B B D B D B C C B A A 二、非选择题 24.(15分)《化学与生活》 (1)(3分)① 氨基酸(1分), CH2OH(CHOH)4CHO(1分)。 ② c(1分) (2)(5分)① d ② b ③d ④ c ⑤ a(各1分) (3)(7分) ① <(1分) , 硫酸(1分); 2CaCO3+2SO2+O22CaSO4+2CO2(2分) ② a(1分) ③ 2CO+SO22CO2+S (2分)。 25.(6分) (1)第三周期ⅢA族 (1分) (2) (1分) (3)2Al + 2OHˉ+ 2H2O = 2AlO2ˉ+ 3 H2 (2分) (4)NaOH+NH4Cl NaCl+NH3↑+H2O (2分) 26.(10分)(1) b ( 1分) (2)pH控制在3左右,温度控制在40℃左右。( 2分) (3) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O ( 2分) (4)取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽。 ( 2分) (5) n(S2O32-)= 5.00×10-3mol·L-1 × 12.0 mL× 10-3L/mL= 6.00×10-5 mol ( 1分) O2 ~ 4 S2O32- 1 mol 4 mol n(O2) 6.00×10-5 mol n(O2)=1.50×10-5 mol ( 1分) 水样中溶解氧的浓度=1.50×10-5 mol × 32 g·mol-1×1000mg/g÷0.1L=4.80 mg·L-1 ( 1分)查看更多