- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学(人教版)选修6课时作业:第3单元课题2-物质含量的测定第1课时(含答案)
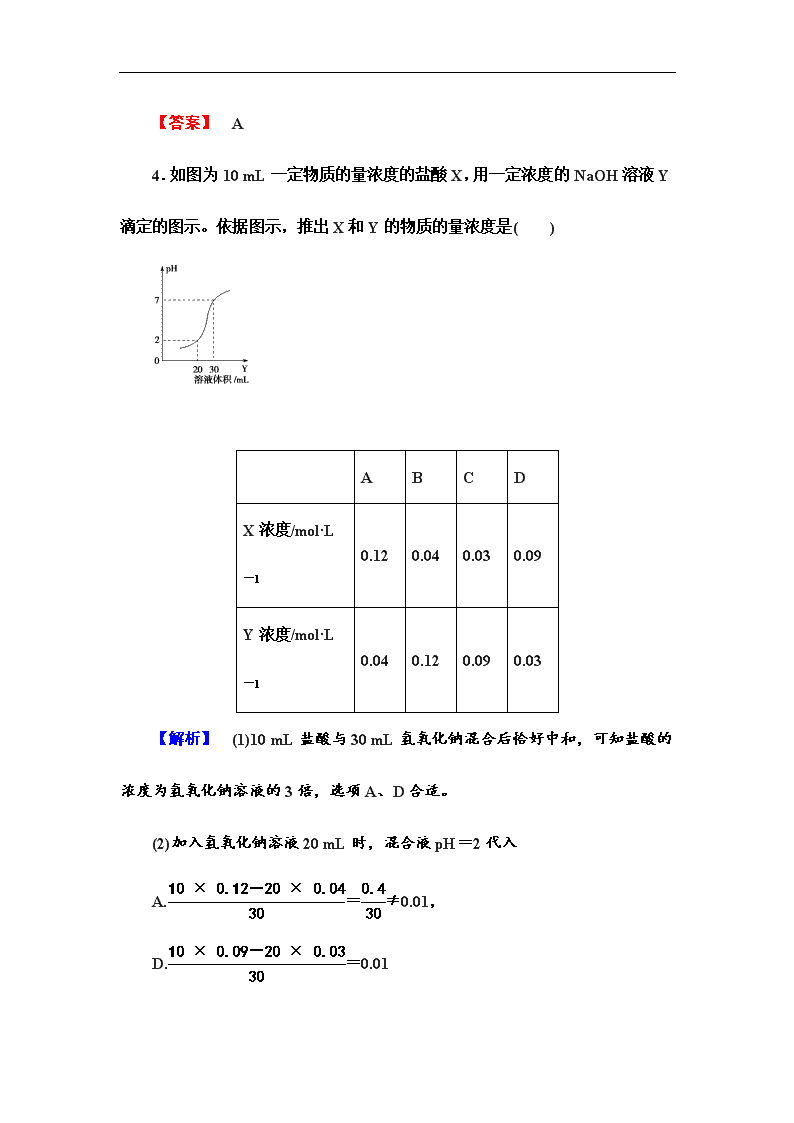
1.(2011·海南高考)用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( ) A.22.30 mL B.22.35 mL C.23.65 mL D.23.70 mL 【解析】 由题给滴定管液面示意图可知,图中每一小格代表0.10 mL,滴定管液面读数介于22.30~22.40之间,只有B项符合。 【答案】 B 2.用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的醋酸,下列判断滴定终点的方法正确的是( ) A.用酚酞作指示剂,滴定至溶液由无色变为红色,并在半分钟内不褪色 B.用甲基橙作指示剂,滴定至溶液由红色开始变为橙色 C.用石蕊作指示剂,滴定至溶液由红色开始变为紫色 D.在滴定过程中,用玻璃棒蘸取试液,涂抹在pH试纸上,至混合液pH为8 【解析】 滴定终点的判断直接取决于指示剂的选择。中学中和滴定的定量实验的指示剂及指示剂的变色范围有:甲基橙(3.1~4.4),石蕊(5~8),酚酞(8~10),由于此实验是用标准碱滴定弱酸,到达滴定终点时,强碱弱酸盐呈弱碱性,故用酚酞作指示剂最好。即当滴有酚酞的醋酸用标准强碱NaOH滴定时,溶液由无色转变为红色,且半分钟内不褪色,说明到达滴定终点。 【答案】 A 3.(2013·昆山高二检测)下列实验操作都可能引起实验误差,其中说法正确的是( ) A.常温下测定的气体摩尔体积大于22.4 L·mol-1 B.100 mL 0.1 mol·L-1 NaOH溶液和100 mL 0.1 mol·L-1CH3COOH溶液反应放出的热量等于573 J C.配制1.0 mol·L-1 NaCl溶液定容时仰视容量瓶的刻度线导致所配溶液浓度偏高 D.中和滴定时,锥形瓶含有水就注入待测液,所测待测液浓度减小 【解析】 选项A,常温下的温度大于0 ℃,在压强和气体的物质的量一定时,温度越高测出的体积越大。选项B,CH3COOH是弱酸,电离需要吸热,测出的值应小于573 J。选项C,定容时仰视容量瓶的刻度线时,所加水的量增大,导致所配溶液浓度偏低。选项D,锥形瓶中是否有水对测定结果没有影响。 【答案】 A 4.如图为10 mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是( ) A B C D X浓度/mol·L-1 0.12 0.04 0.03 0.09 Y浓度/mol·L-1 0.04 0.12 0.09 0.03 【解析】 (1)10 mL盐酸与30 mL氢氧化钠混合后恰好中和,可知盐酸的浓度为氢氧化钠溶液的3倍,选项A、D合适。 (2)加入氢氧化钠溶液20 mL时,混合液pH=2代入 A.=≠0.01, D.=0.01 因此D选项正确。 【答案】 D 5.(2013·金华高二检测)用已知浓度的盐酸滴定用NaOH固体配成的碱溶液时,下列操作使滴定结果偏高的是( ) A.NaOH固体称量时间过长 B.盛标准盐酸的滴定管用碱液润洗 C.用酚酞作指示剂 D.固体NaOH中含KOH杂质 【解析】 待测的NaOH溶液浓度计算式为:c(NaOH)=c(HCl)×V(HCl)/V(NaOH),A项NaOH固体称量时间过长,会有部分NaOH与空气中的CO2反应生成Na2CO3,得到NaOH和Na2CO3的混合物,等质量的Na2CO3消耗的盐酸比NaOH少,所以使滴定结果偏低。B项盛放标准盐酸的滴定管用碱液润洗,实际使盐酸变稀,这样会使消耗盐酸的体积变大,所以使测得的结果偏高。C项是正确操作。D中固体NaOH含有KOH时,会使消耗的盐酸变少,所以使测得结果偏低。 【答案】 B 6.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项( ) 锥形瓶中的溶液 滴定管中的溶液 选用指示剂 选用滴定管 A 碱 酸 石蕊 乙 B 酸 碱 酚酞 甲 C 碱 酸 甲基橙 甲 D 酸 碱 酚酞 乙 【解析】 酸式滴定管(图甲)盛放酸液,碱式滴定管(图乙)盛放碱液,为便于观察,所选取的指示剂在滴定过程中的颜色一般由浅色向深色过渡,且要求半分钟内不褪色。用已知浓度的NaOH溶液测定某H2SO4溶液的浓度时,若将已知浓度的NaOH溶液盛放在碱式滴定管中,则未知浓度的H2SO4溶液放入锥形瓶中,选用酚酞为指示剂, 滴定到终点时颜色由无色变为红色;若将已知浓度的NaOH溶液盛放在锥形瓶中,则未知浓度的H2SO4溶液放入酸式滴定管中,选用甲基橙为指示剂,滴定到终点时颜色由黄色变为橙色。 【答案】 CD 7.某学习小组利用DIS系统探究强碱和不同酸的中和反应,实验过程如下: ①分别配制0.100 0 mol·L-1的NaOH、HCl、CH3COOH溶液备用。 ②用0.100 0 mol·L-1的NaOH溶液分别滴定10.00 mL 0.100 0 mol·L-1的HCl和CH3COOH溶液,连接数据采集器和pH传感器。 ③由计算机绘制的滴定曲线如下: 两曲线图起点不同的原因是________________________________________________; 两曲线图中V1________V2(填“>”、“=”或“<”)。 【解析】 盐酸是强酸,完全电离,0.100 0 mol·L-1的HCl溶液pH=1,而醋酸是弱酸,不能完全电离,故0.100 0 mol·L-1的CH3COOH溶液pH大于1。V1=10.00 mL,V2<10.00 mL,所以V1>V2。 【答案】 CH3COOH不完全电离,HCl完全电离,使0.1 mol·L-1的 CH3COOH溶液中c(H+)比同浓度的HCl溶液中c(H+)小,pH大 > 8.甲、乙两个同学同时设计了一份表格,用于酸碱中和滴定实验的数据记录和处理。甲同学设计的表格和实验记录结果如下: 次数 V(NaOH)/mL 耗V(HCl)/mL 1 20.48 22.46 2 25.00 21.98 3 25.00 22.36 乙同学设计的表格和实验记录结果如下: 次数 V(NaOH)/mL 耗V(NaOH) /mL V(HCl)/mL 耗V(HCl) /mL 始读数 终读数 始读数 终读数 1 0.10 25.00 0.00 24.80 2 0.00 24.80 0.10 22.32 3 0.00 24.80 0.00 24.70 请回答下列问题: (1)认真比较甲、乙两表和记录,你觉得两同学的表格和实验记录有无不妥之处?原因是_____________________________________________。 (2)分析乙同学的实验数据,若c(HCl)=0.10 mol·L-1,则测得的c(NaOH)=________ mol·L-1。 【解析】 (1)甲设计表格中无“始读数”和“终读数”,不符合中和滴定实验报告要求;其二甲表中记录实验的3组数据误差过大,如果实验操作规范则可能是读数有误。而乙表设计则较规范。(2)乙表中第二组因数据误差过大应采用第一和第三组数据进行计算。V(NaOH)=24.85 mL、V(HCl)=24.75 mL、c(NaOH)=0.10 mol·L-1。 【答案】 (1)有,甲不符合中和滴定实验报告要求 (2)0.10 查看更多