2018-2019学年广西南宁市第三中学高一下学期期中考试理科化学试题
2018-2019学年广西南宁市第三中学高一下学期期中考试理科化学试题
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 S—32 Cl—35.5 Fe—56 Cu—64 Ag—108
一、选择题(每小题只有一个正确答案,每小题3分,共48分)
1.下列做法或说法错误的是( )
A.风能和太阳能属于一次能源,电能属于二次能源
B.自然界硅元素贮量丰富,并存在大量的单质硅
C.酸雨的形成主要是由于含硫化石燃料的大量燃烧
D.用自来水养鱼,在将水注入鱼缸之前需把水在阳光下曝晒一段时间
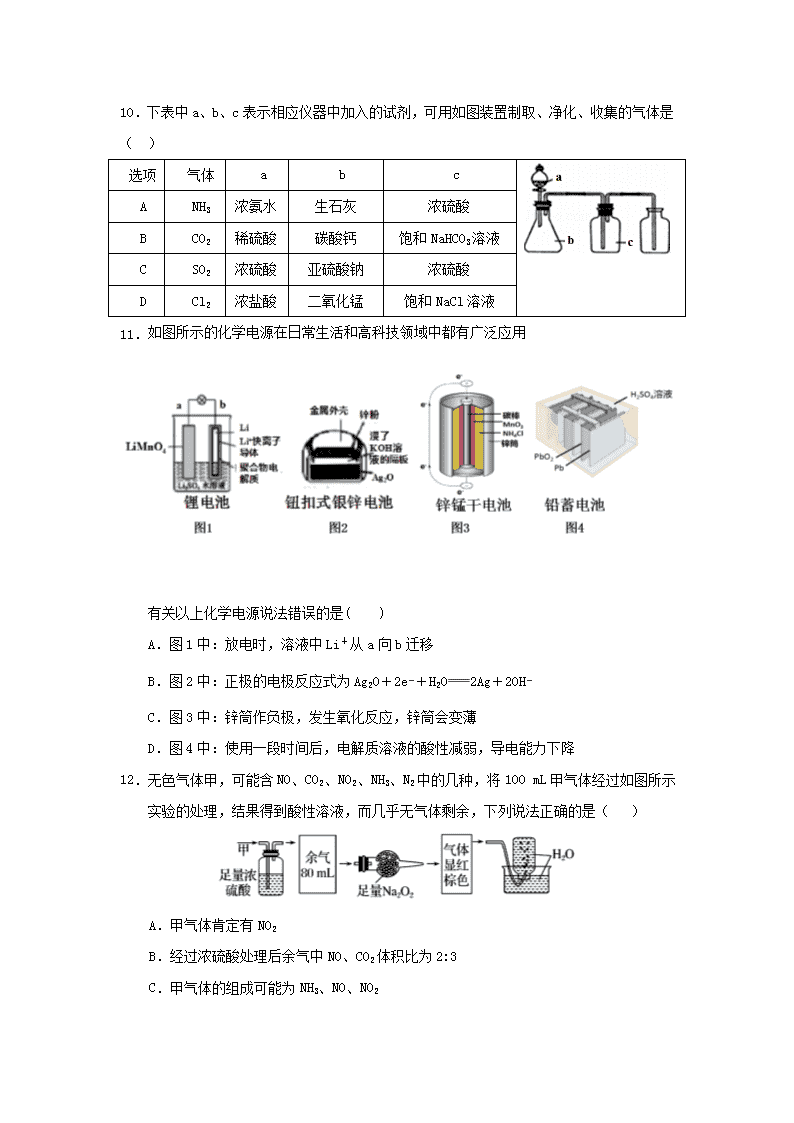
2.下列化学用语表达正确的是( )
A.HF的电子式为:
B.HClO的结构式:H-Cl-O
C.Cl-的结构示意图:
D.核内质子数为117,核内中子数为174的核素Ts可表示为:
3.113号元素Nh有质量数从282到287的全部核素,下列说法正确的是( )
A.Nh是第七周期第ⅢB族元素 B.Nh元素相对原子质量可能为287
C.与第七周期第IIA族元素序数相差1 D.Nh的同位素原子具有相同的电子数
4.化学在生活中有着广泛的应用,下列对应关系正确的是( )
化学性质
实际应用
A
次氯酸具有氧化性
漂白粉漂白织物
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
硅透光性好,且折射率合适,能够发生全反射
硅可做光导纤维
D
明矾溶于水可生成Al(OH)3胶体
可用于自来水消毒
5. 根据右图,下列判断中正确的是( )
A.H+向负极移动
B.原电池负极上发生的反应是Zn-2e-===Zn2+
C.当有2 mol e-通过时,产生H2的体积在标况下为11.2L
D.电流从负极Zn流出,流向正极Cu
6.下列说法正确的是( )
A.元素周期表中共有7个周期,18个族
B.Na2O2、H2SO4、(NH4)2SO4 中均有离子键和共价键
C.酸性:H2SO4>H3PO4>H2CO3>HClO
D.由于HF分子间存在氢键,所以稳定性:HF>HCl
7.短周期元素A、B、C、D、E的原子序数依次增大,已知元素A的气态氢化物和A的最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子数是次外层的3倍;D是地壳中含量最多的金属元素;C元素的单质是短周期中与水反应最剧烈的金属。下列叙述正确的是( )
A.元素C、D、E的最高价氧化物对应的水化物两两之间能反应
B.离子半径:E
Br2,但不能证明氧化性:Br2>I2
C
向某溶液中加入硝酸银溶液
产生白色沉淀
则溶液有氯离子
D
浓HNO3加热
有红棕色气体产生
HNO3有不稳定性
14.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能:P-P:198kJ/mol,P-O: 360kJ/mol,O=O:498kJ/mol,则反应P4(白磷)+3O2=P4O6
的能量变化为( )
A. 放出热量1 638kJ
B. 吸收热量1 638kJ
C. 放出热量126 kJ
D. 吸收热量126 kJ
15.已知Cu、Ag都能溶解在硝酸中,某同学设计如下实验测量m g铜银合金样品中铜的质量分数
下列说法中正确的是( )
A. 被还原的硝酸为V/22.4 mol B.操作I所用到的玻璃仪器是烧杯、蒸发皿、玻璃棒
C.操作Ⅱ为蒸发 D.铜的质量分数为 (143.5m-108w)/143.5m×100%
16.向一定量Fe、FeO和Fe2O3的混合物中加入150 mL一定浓度的稀硝酸恰好使混合物完全溶解,同时可得到标准状况下1.12 L
NO气体。向所得到的溶液中再加入KSCN溶液,无红色出现。若用足量的CO在加热条件下还原相同质量的混合物得到11.2 g铁单质。下列说法正确的是( )
A.往所得溶液中加入KSCN溶液,无红色出现,则溶液中无Fe2+
B.原稀硝酸的物质的量浓度为3mol/L
C.能确定铁和三氧化二铁的物质的量之比
D.混合物中铁单质为0.075mol
二、填空题(共52分)
17.(9 分)下表是元素周期表短周期的一部分:
请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序: _____________________;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________,若将其溶于水,破坏了其中的__________(填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4 :1反应的离子方程式________。
18.(10 分)Ⅰ.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。
(1)若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为 ,
当有1.6 g负极材料溶解时,转移的电子为____mol;
(2)若a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,
则电子的流向为 → (填电极材料,下同),
溶液中的NO3-向________极移动;
(3)氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2 ═ 2H2O,则正极的电极方程式为________________。
Ⅱ.已知H—H 键、N—H 键、N≡N 键的键能分别为 436 kJ/mol、391 kJ/mol、946 kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
(4) 若有 1 mol NH3生成 ,可 (填“吸收”或“放出”)热量 kJ;该反应的能量变化可用图__________表示。(填“甲“或“乙”)
19.(10分)有关物质的转化关系如下图所示(部分条件已略去),在通常状况下,B是黑色的金属氧化物,D、E、F是气体单质,C是一种水溶液显碱性的气体,I为红棕色气体,G为紫红色的金属。
(1)B的化学式为 ;A的结构式为 ;
(2)写出反应①的化学方程式: ;
(3)写出反应②的离子方程式: ,该反应是 (填“放热”或“吸热”)反应;
(4) 实验室制备C时,检验是否收集满C的方法是 。
20.(11分)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电脑显示屏生产过程中有大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)产生。某课题组以此粉末为原料回收铈,设计实验流程如下:
(1)滤渣A的主要成分是_____________;洗涤滤渣A除去的阳离子主要是________(填离子符号),检验该离子是否洗净的操作是 ;
(2)步骤②中反应的离子方程式是 ;
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等;
(4)步骤④中反应化学方程式为 ___。
21.(12分)一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:
①室温下,2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2-都能与MnO4—反应生成NO3-。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:
(1)A中反应的化学方程式_____________;
(2)装置B中观察到的主要现象______________;
(3)仪器D的名称是___________________;
(4)A中滴入浓硝酸之前,应先通入N2一段时间,原因是____________;
(5)写出NO被酸性KMnO4氧化的离子反应方程式______________;
(6)若无装置D,则E中产物除NaNO2外,还有_______(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
步骤1:提出假设
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
步骤2:设计实验
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选)
预期的实验现象及结论
取适量的白色固体置于试管中,加蒸馏水溶解,
①__________________________________________
②___________________________
______________________
南宁三中2018~2019学年度下学期高一段考
理科化学参考答案
1-16:BCDAB CABAC ABCAD B
17、 (9分)(除标注外其余每空 1 分)
(1) Cl- >O2->Mg2+ (2) CH4<NH3<H2O
(3)(2 分)
(连接号写成等号扣1分)
(4) 第四周期第 ⅣA 族 (5);离子键
(6)4H2O2+H2S=SO42-+2H++4H2O (2分)
18.(10 分)(除标注外其余每空 1 分)
(1) Fe3++e-=Fe2+ (2分) ; 0.05 (2)铜(Cu)→铁(Fe);铜(Cu)
(3) 2H2O+O2+4e-═4OH- (2分) (4) 放出; 46; 甲
19.(10分)(除标注外其余每空 2 分)(1)CuO (1分) ;
(2)4NH3+5O24NO+6H2O
(3)Cu+4H++2NO3﹣═Cu2++2NO2↑+2H2O;放热 (1分)
(4)用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝说明氨气收集满。
(或用玻璃棒蘸取浓盐酸靠近集气瓶口,若产生白烟说明氨气收集满)
20.(11分)(除标注外其余每空1 分)
(1) SiO2、CeO2(2分) ; Fe3+;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;反之,未洗净 。(2分)
(2)2CeO2+H2O2+6H+===2Ce3++O2↑+4H2O;(2分)
(3) 不能;分液漏斗 (4)4Ce(OH)3+O2+2H2O=4Ce(OH)4 (2分)
21. (12分) (除标注外其余每空1 分)
(1) C+4HNO3(浓)CO2↑+4NO2↑+2H2O (2分)
(2)溶液变蓝,铜片溶解,有无色气体冒出 (3)(球形)干燥管
(4)排尽装置中的空气,防止对后续实验有干扰
(5)5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O (2分)
(6)Na2CO3(或Na2CO3、NaOH )
Ⅱ. NO2能被Na2O2还原 (1)一
(2) 再滴加稀硫酸酸化,最后滴加高锰酸钾溶液 若高锰酸钾溶液不褪色,则假设二成立;若高锰酸钾溶液褪色,则假设二不成立(或再滴加稀硫酸酸化,最后加铜粉,若铜粉溶解且溶液变蓝色,则假设二成立,若铜粉不溶解,则假设二不成立,其他合理答案也可)(2分)