- 2021-07-02 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版四大平衡常数学案
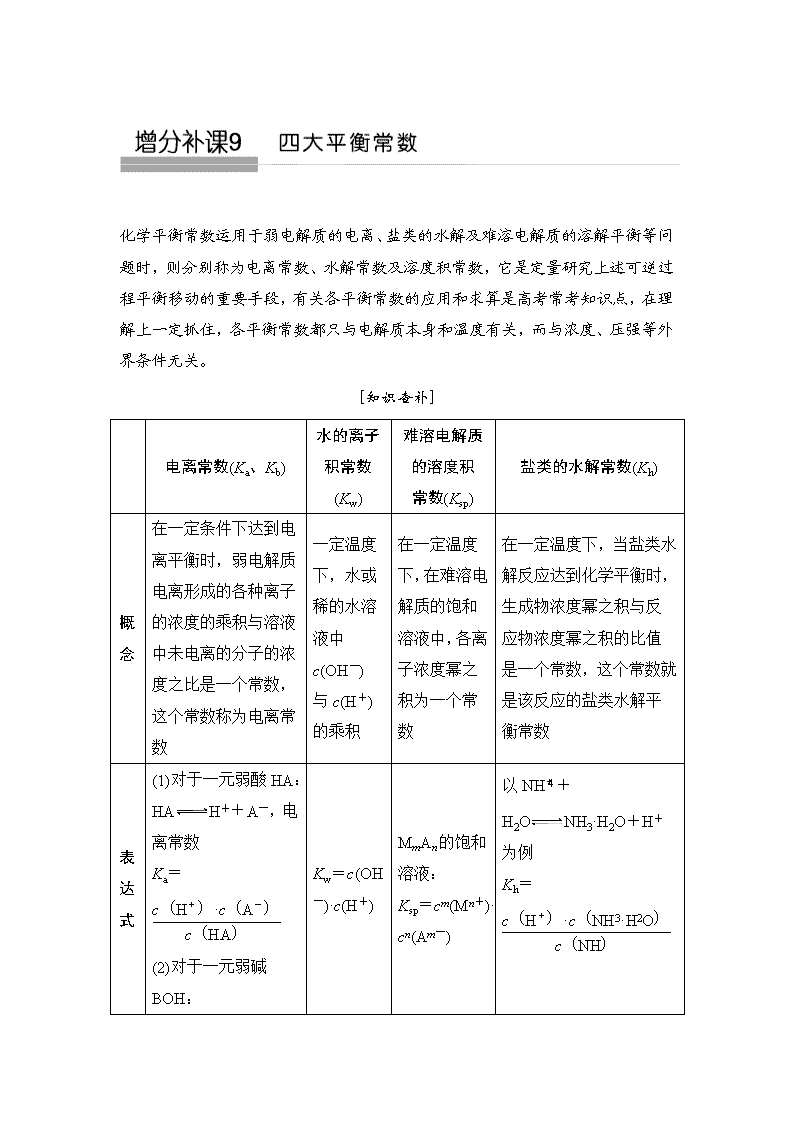
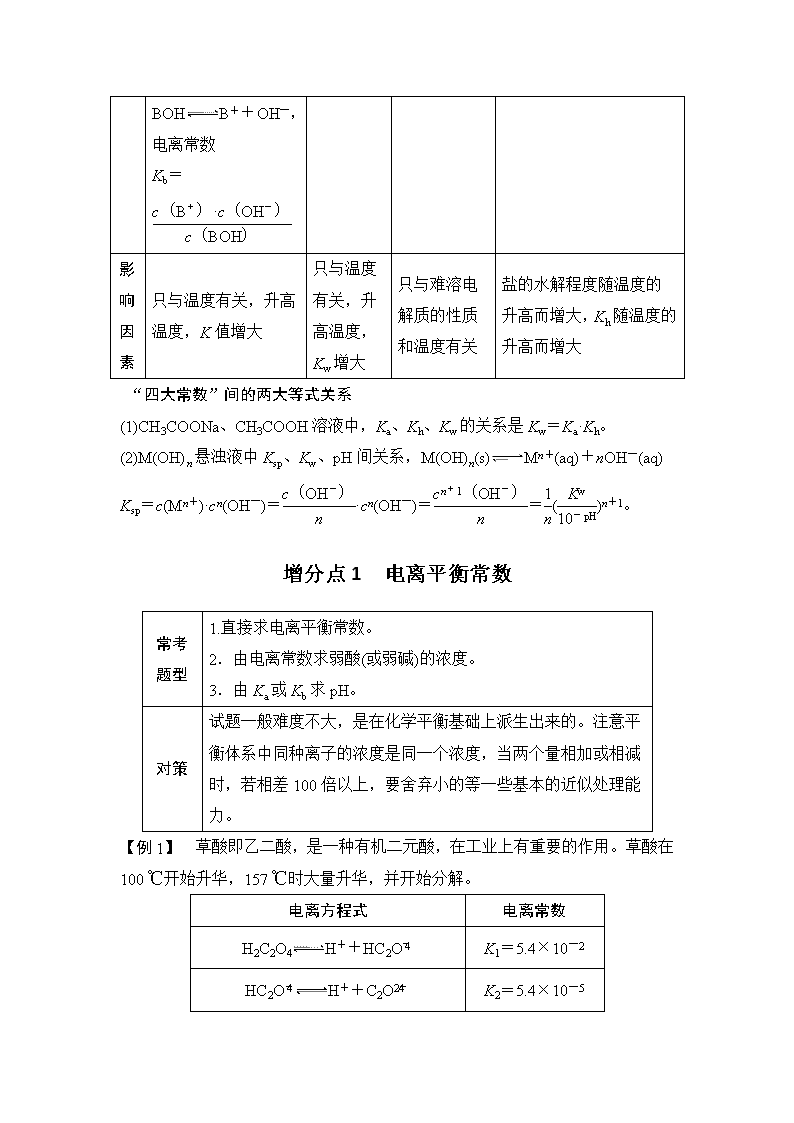
化学平衡常数运用于弱电解质的电离、盐类的水解及难溶电解质的溶解平衡等问题时,则分别称为电离常数、水解常数及溶度积常数,它是定量研究上述可逆过程平衡移动的重要手段,有关各平衡常数的应用和求算是高考常考知识点,在理解上一定抓住,各平衡常数都只与电解质本身和温度有关,而与浓度、压强等外界条件无关。 [知识查补] 电离常数(Ka、Kb) 水的离子积常数(Kw) 难溶电解质的溶度积 常数(Ksp) 盐类的水解常数(Kh) 概 念 在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离常数 一定温度下,水或稀的水溶液中c(OH-)与c(H+)的乘积 在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一个常数 在一定温度下,当盐类水解反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的盐类水解平衡常数 表 达 式 (1)对于一元弱酸HA: HAH++A-,电离常数 Ka= (2)对于一元弱碱BOH: BOHB++OH- Kw=c(OH-)·c(H+) MmAn的饱和溶液: Ksp=cm(Mn+)· cn(Am-) 以NH+H2ONH3·H2O+H+为例 Kh= ,电离常数 Kb= 影响 因素 只与温度有关,升高温度,K值增大 只与温度有关,升高温度,Kw增大 只与难溶电解质的性质和温度有关 盐的水解程度随温度的升高而增大,Kh随温度的升高而增大 “四大常数”间的两大等式关系 (1)CH3COONa、CH3COOH溶液中,Ka、Kh、Kw的关系是Kw=Ka·Kh。 (2)M(OH)n悬浊液中Ksp、Kw、pH间关系,M(OH)n(s)Mn+(aq)+nOH-(aq) Ksp=c(Mn+)·cn(OH-)=·cn(OH-)==()n+1。 增分点1 电离平衡常数 常考题型 1.直接求电离平衡常数。 2.由电离常数求弱酸(或弱碱)的浓度。 3.由Ka或Kb求pH。 对策 试题一般难度不大,是在化学平衡基础上派生出来的。注意平衡体系中同种离子的浓度是同一个浓度,当两个量相加或相减时,若相差100倍以上,要舍弃小的等一些基本的近似处理能力。 【例1】 草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用。草酸在100 ℃开始升华,157 ℃时大量升华,并开始分解。 电离方程式 电离常数 H2C2O4H++HC2O K1=5.4×10-2 HC2OH++C2O K2=5.4×10-5 NH3·H2ONH+OH- K=1.8×10-5 (1)(NH4)2C2O4溶液的pH________7(填“>”“<”或“=”)。 (2)用惰性电极电解饱和草酸溶液可制得乙醛酸(OHC—COOH)。阴极的电极反应式为_________________________________________________________ ______________________________________________________________。 (3)草酸钠是一种重要的还原剂。合成草酸钠的操作如下: 草酸草酸钠晶体 ①75%酒精的作用是___________________________________________。 ②当草酸与碳酸钠的物质的量按2∶1充分混合后,溶液中pH<7。请将该溶液中离子浓度按由大到小的顺序排列_______________________________________ _______________________________________________________________。 解析 (1)由题中表格可知,H2C2O4、HC2O、NH3·H2O的电离常数大小为H2C2O4>HC2O>NH3·H2O,故草酸铵溶液显酸性。(2)阴极得电子发生还原反应:2H++HOOC—COOH+2e-===HOOC—CHO+H2O。(3)①加入酒精是为了降低草酸钠的溶解度,便于晶体析出。②二者反应后溶质为草酸氢钠,因为溶液显酸性,所以HC2O的电离程度大于其水解程度,则离子浓度大小顺序为c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-)。 答案 (1)< (2)2H++HOOC—COOH+2e-===HOOC—CHO+H2O (3)①降低草酸钠的溶解度,便于晶体析出 ②c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-) 增分点2 水的离子积常数 常考题型 1.计算温度高于室温时的Kw。 2.通过KW的大小比较相应温度的高低。 3.溶液中c(H+)与c(OH-)相互换算。 4.酸、碱、能水解的盐溶液中水电离出的c(H+)或c(OH-)的计算。 对 策 Kw只与温度有关,升高温度,Kw增大;在稀溶液中,c(H+)·c(OH-)=Kw,其中c(H+)、c(OH-)是溶液中的H+、OH- 浓度;水电离出的H+数目与OH-数目相等。 【例2】 下表是不同温度下水的离子积常数: 温度/℃ 25 t1 t2 水的离子积常数(mol2·L-2) 1×10-14 a 1×10-12 试回答以下问题: (1)若25<t1<t2,则a________1×10-14 mol2·L-2(填“>”、“<”或“=”),做此判断的理由是_______________________________________________ _______________________________________________________________。 (2)25 ℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。 (3)t2 ℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是________。 解析 (1)25<t1<t2,温度升高,促进水的电离,c(H+)=c(OH-)>1×10-7 mol/L,所以KW>1×10-14 mol2·L-2。 (2)Na2SO4溶液中c(Na+)=2×5×10-4 mol/L=1×10-3 mol/L,稀释10倍后,c(Na+)=1×10-4 mol/L,此时溶液为中性,c(OH-)=1×10-7 mol/L,所以c(Na+)∶c(OH-)=10-4 mol/L∶10-7 mol/L=1 000。 (3)根据酸、碱中和原理及pH计算式:=10-2 mol/L,解得V1∶V2=9∶11,根据Na2SO4的化学组成及反应后溶液呈酸性,推知该溶液中各种离子浓度由大到小的顺序为c(Na+)>c(SO)>c(H+)>c(OH-)。 答案 (1)> 温度升高,水的电离程度增大,所以水的离子积增大 (2)1 000∶1 (3)9∶11 c(Na+)>c(SO)>c(H+)>c(OH-) 增分点3 Ka(Kb)与Kw的结合——盐类的水解常数Kh 说明:Kh在做题过程中往往通过Ka(Kb)、Kw的数据通过转换完成解答。 【例3】 室温下,H2SO3的电离平衡常数Ka1=1.0×10-2、Ka2=1.0×10-7。 (1)该温度下NaHSO3的水解平衡常数Kh=________,NaHSO3 溶液的pH________(填“>”、“<”或“=”)7;若向NaHSO3溶液中加入少量I2,则溶液中将________(填“增大”、“减小”或“不变”)。 (2)0.1 mol/L Na2SO3溶液的pH=________,从平衡移动的角度解释SO的Kh1>Kh2。_____________________________________________________。 解析 (1)Ka1=,由HSO+H2OH2SO3+OH-,Kh====1.0×10-12<Ka2,这说明HSO的电离能力强于水解能力,故溶液显酸性,pH<7;当加入少量I2时,+4价的硫元素被氧化,溶液中有硫酸(强酸)生成,导致溶液的酸性增强,c(H+)增大,c(OH-)减小,但因温度不变,故Kh不变,则增大。(2)同理可求出Kh1==1.0×10-7,Na2SO3溶液的碱性主要由SO的一级水解决定,设溶液中c(OH-)=x mol/L,则c(HSO)≈x mol/L、c(SO)=0.1 mol/L-x mol/L≈0.1 mol/L,利用水解平衡常数易求出x=1.0×10-4 mol/L,pH=10。一级水解产生的OH-对二级水解有抑制作用,导致二级水解程度降低。 答案 (1)1.0×10-12 < 增大 (2)10 一级水解产生的OH-对二级水解有抑制作用 增分点4 难溶电解质的溶度积常数 常考 题型 1.溶解度与Ksp的相关转化与比较。 2.沉淀先后的计算与判断。 3.沉淀转化相关计算。 4.金属阳离子沉淀完全的pH及沉淀分离的相关计算。 5.与其他平衡(如氧化还原平衡、配位平衡)综合的计算。 6.数形结合的相关计算等。 对 策 应用Kap数值大小比较物质的溶解度大小时,一定是在组成上属于同一类型的难溶电解质才能进行比较,否则,不能比较;在判断沉淀的生成或转化时,把离子浓度数值代入Ksp表达式,若数值大于 Ksp,沉淀可生成或转化为相应难溶物质;利用Ksp可计算某些沉淀转化反应的化学平衡常数。 【例4】 (2018·南阳模拟)①已知t ℃时AgCl的Ksp=2×10-10;②在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( ) A.在t ℃时,Ag2CrO4的Ksp为1×10-9 B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 C.在t ℃时,以0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液,CrO先沉淀 D.在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数K=2.5×107 解析 依据图像曲线上的数据,结合溶度积常数概念计算即可得到,曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶解平衡为Ag2CrO4(s)2Ag+(aq)+CrO(aq);Ksp=c2(Ag+)·c(CrO)=(10-3)2×10-6=10-12,故A错误;在饱和溶液中加入K2CrO4可使沉淀溶解平衡左移,溶度积常数不变,还是饱和溶液,点应在曲线上,故B错误;依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=1×10-12,Ksp(AgCl)=c(Ag+)·c(Cl-)=2×10-10,以0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液,c(CrO)=0.01 mol·L-1,得到c(Ag+)= mol·L-1=1×10-5 mol·L-1,0.01 mol·L-1 KCl溶液中,c(Cl-)=0.01 mol·L-1,依据溶度积计算得c(Ag+)= mol·L-1=2×10-8 mol·L-1,所以先析出氯化银沉淀,故C错误;在t ℃时,Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq),离子浓度相同时,依据氯化银的溶度积和Ag2CrO4 的溶度积计算,K====2.5×107,故D正确。 答案 D 【解题建模】 基于“平衡观”视角建构电解质溶液知识体系查看更多