- 2021-07-02 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习电化学作业(全国通用)(3)
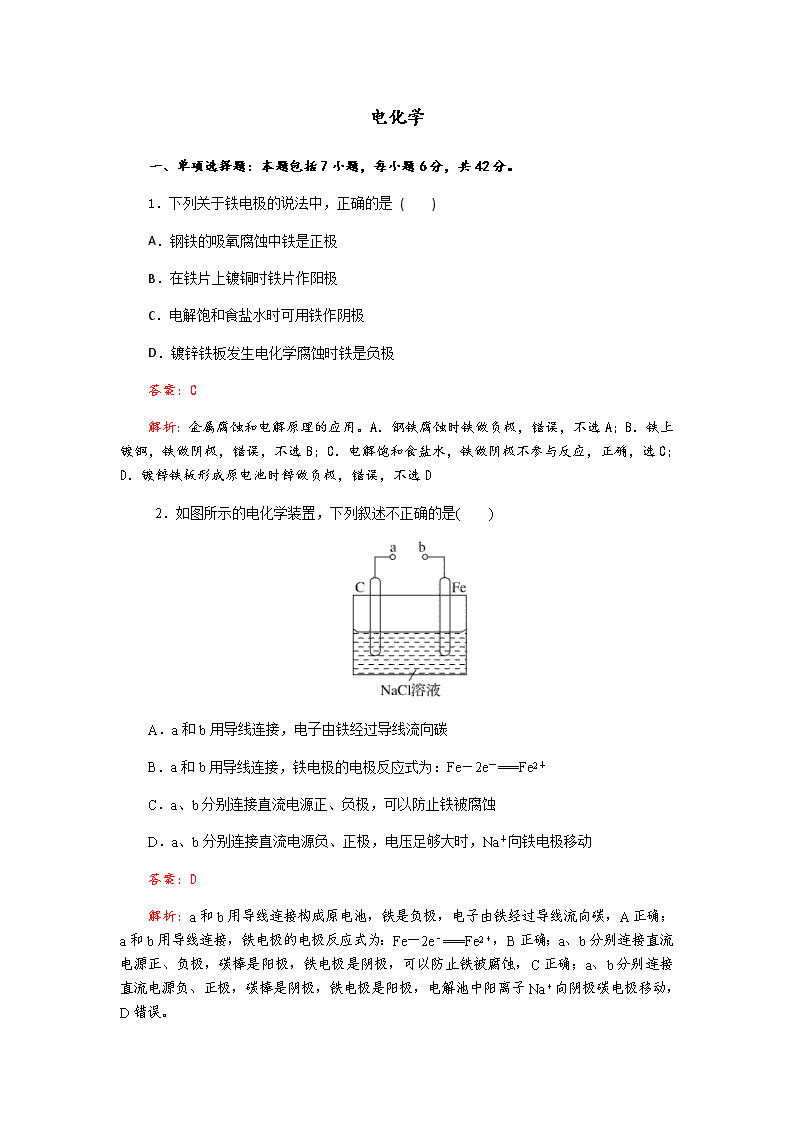
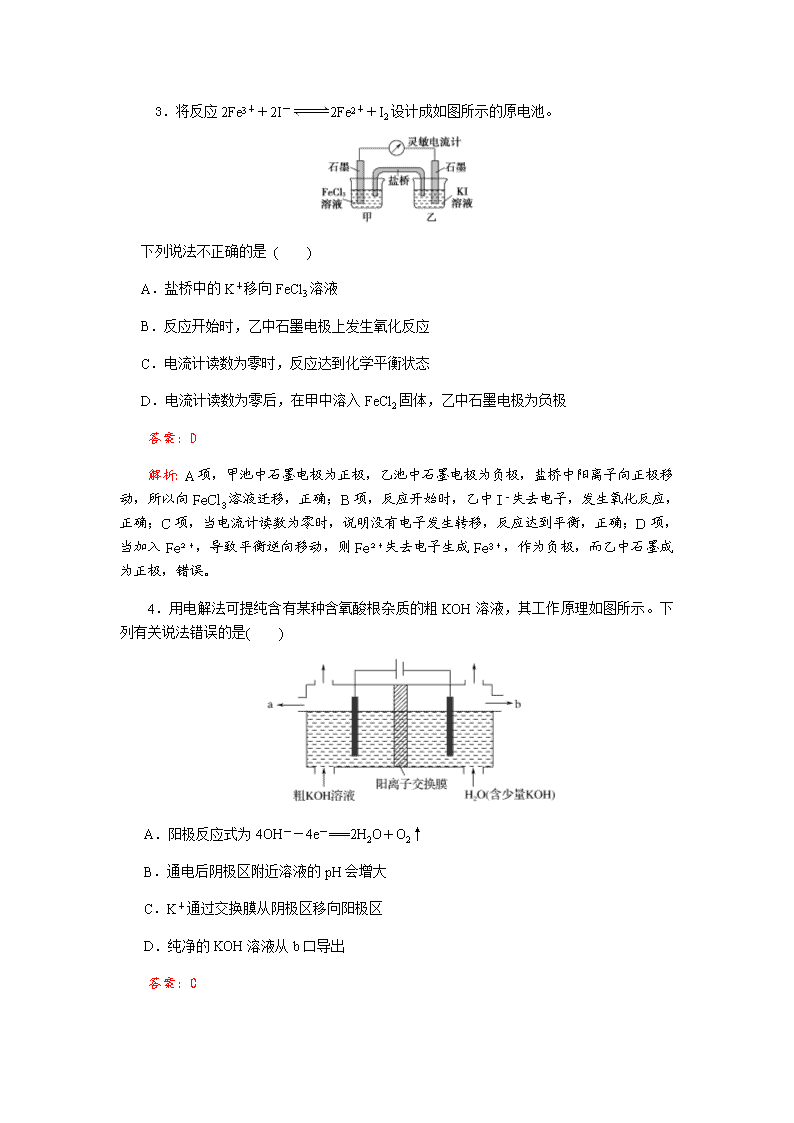
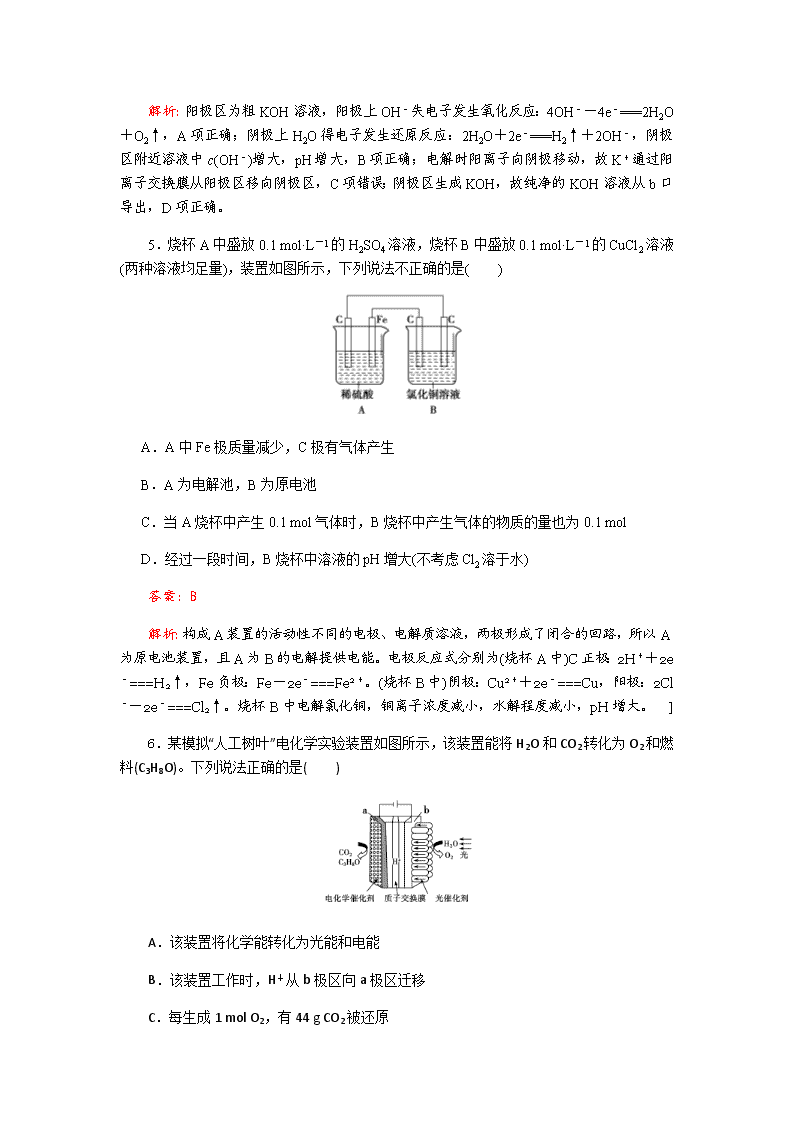
电化学 一、单项选择题:本题包括7小题,每小题6分,共42分。 1.下列关于铁电极的说法中,正确的是 ( ) A.钢铁的吸氧腐蚀中铁是正极 B.在铁片上镀铜时铁片作阳极 C.电解饱和食盐水时可用铁作阴极 D.镀锌铁板发生电化学腐蚀时铁是负极 答案:C 解析:金属腐蚀和电解原理的应用。A.钢铁腐蚀时铁做负极,错误,不选A;B.铁上镀铜,铁做阴极,错误,不选B;C.电解饱和食盐水,铁做阴极不参与反应,正确,选C;D.镀锌铁板形成原电池时锌做负极,错误,不选D 2.如图所示的电化学装置,下列叙述不正确的是( ) A.a和b用导线连接,电子由铁经过导线流向碳 B.a和b用导线连接,铁电极的电极反应式为:Fe-2e-===Fe2+ C.a、b分别连接直流电源正、负极,可以防止铁被腐蚀 D.a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动 答案:D 解析:a和b用导线连接构成原电池,铁是负极,电子由铁经过导线流向碳,A正确;a和b用导线连接,铁电极的电极反应式为:Fe-2e-===Fe2+,B正确;a、b分别连接直流电源正、负极,碳棒是阳极,铁电极是阴极,可以防止铁被腐蚀,C正确;a、b分别连接直流电源负、正极,碳棒是阴极,铁电极是阳极,电解池中阳离子Na+向阴极碳电极移动,D错误。 3.将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。 下列说法不正确的是 ( ) A.盐桥中的K+移向FeCl3溶液 B.反应开始时,乙中石墨电极上发生氧化反应 C.电流计读数为零时,反应达到化学平衡状态 D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 答案:D 解析:A项,甲池中石墨电极为正极,乙池中石墨电极为负极,盐桥中阳离子向正极移动,所以向FeCl3溶液迁移,正确;B项,反应开始时,乙中I-失去电子,发生氧化反应,正确;C项,当电流计读数为零时,说明没有电子发生转移,反应达到平衡,正确;D项,当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,错误。 4.用电解法可提纯含有某种含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是( ) A.阳极反应式为4OH--4e-===2H2O+O2↑ B.通电后阴极区附近溶液的pH会增大 C.K+通过交换膜从阴极区移向阳极区 D.纯净的KOH溶液从b口导出 答案:C 解析:阳极区为粗KOH溶液,阳极上OH-失电子发生氧化反应:4OH--4e-===2H2O+O2↑,A项正确;阴极上H2O得电子发生还原反应:2H2O+2e-===H2↑+2OH-,阴极区附近溶液中c(OH-)增大,pH增大,B项正确;电解时阳离子向阴极移动,故K+通过阳离子交换膜从阳极区移向阴极区,C项错误;阴极区生成KOH,故纯净的KOH溶液从b口导出,D项正确。 5.烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( ) A.A中Fe极质量减少,C极有气体产生 B.A为电解池,B为原电池 C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol D.经过一段时间,B烧杯中溶液的pH增大(不考虑Cl2溶于水) 答案:B 解析:构成A装置的活动性不同的电极、电解质溶液,两极形成了闭合的回路,所以A为原电池装置,且A为B的电解提供电能。电极反应式分别为(烧杯A中)C正极:2H++2e-===H2↑,Fe负极:Fe-2e-===Fe2+。(烧杯B中)阴极:Cu2++2e-===Cu,阳极:2Cl--2e-===Cl2↑。烧杯B中电解氯化铜,铜离子浓度减小,水解程度减小,pH增大。 ] 6.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( ) A.该装置将化学能转化为光能和电能 B.该装置工作时,H+从b极区向a极区迁移 C.每生成1 mol O2,有44 g CO2被还原 D.a 电极的反应为:3CO2+18H+-18e-===C3H8O+5H2O 答案:B 解析:A项,该装置是电解池,在电解和光的作用下H2O在光催化剂的表面转化为O2和H+,故该装置是将电能和光能转化为化学能,错误;B项,根据同种电荷相互排斥、异种电荷相互吸引的原则,该装置工作时,H+从阳极b极区向阴极a极区迁移,正确;C项,该电解池的总反应式为:6CO2+8H2O2C3H8O+9O2。根据总反应方程式可知,每生成1 mol O2,有 mol CO2被还原,其质量为 g,错误;D项,a电极为阴极,发生还原反应,电极反应式为:3CO2+18H++18e-===C3H8O+5H2O,错误。 7.常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是( ) A.每生成1 mol NCl3,理论上有4 mol H+经质子交换膜向右侧向左侧迁移 B.可用湿润的淀粉-KI试纸检验气体M C.石墨极的电极反应式为NH+3Cl--6e-===NCl3+4H+ D.电解过程中,质子交换膜右侧溶液的pH会减小 答案:C 解析:A项,由NH→NCl3,根据元素化合价变化知,NH中N由-3价升高至+3价,每生成1 mol NCl3,理论上有6 mol H+由质子交换膜右侧向左侧(阴极区)迁移,错误。B项,M是氢气,不能用湿润的淀粉-KI试纸检验,错误。C项,石墨电极发生氧化反应,电极反应式为NH+3Cl--6e-===NCl3+4H+,正确。D项,电解过程中,质子交换膜右侧溶液中c(H+)减小,溶液pH增大,错误。 二、非选择题:本题包括4小题,共58分。 8.(12分)能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。请回答: (1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2===CH3OH。则H2与CO反应生成CH3OH的热化学方程式为:________________。 (2)如图为某处燃料电池的工作原理示意图,a、b均为惰性电极。①使用时,空气从____口通入(填A或B); ②假设使用的“燃料”是甲醇,a极的电极反应式为:________________。 ③假设使用的“燃料”是水煤气(成分为CO、H2)用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为________。 答案:(1)CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4 kJ/molG (2)①B ②CH3OH-6e-+8OH-===CO+6H2O ③2.24 L 9.(除标注外,每空2分,共16分)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。 请回答下列问题: (1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为___________________________________________________________________。 (2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳极”),总反应式为_________________________________________________________________。 (3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________mL(标准状况),丙池中________极析出________g铜。 (4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不变”),若将丙中溶液复原,需加入________。 解析:(1)甲池为原电池,通入CH3OH的电极为负极,电极反应式为CH3OH-6e-+8OH-===CO+6H2O。 (2)乙池中为用惰性电极电解AgNO3溶液,其中A作阳极,B作阴极,总反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3。 (3)根据各电极上转移的电子相同,则n(Ag)=4n(O2)=2n(Cu),故V(O2)=××22.4 L=0.28 L=280 mL,m(Cu)=××64 g=1.6 g。 (4)若丙池中电极不变,将其溶液换成NaCl溶液,根据丙中总反应式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,溶液pH增大,而甲中总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,溶液pH减小。 答案:(1)原电池(1分) CH3OH-6e-+8OH-===CO+6H2O (2)阳极(1分) 4AgNO3+2H2O4Ag+O2↑+4HNO3 (3)280 D 1.6 (4)减小(1分) 增大(1分) HCl 10.(14分)如图所示,通电5 min后,电极5的质量增加2.16 g,请回答下列问题: (1)a为电源的________(填“正”或“负”)极,C池是________池。A池阳极的电极反应为__________________, C池阴极的电极反应为__________________________________________。 (2)如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。 (3)如果A池溶液是200 mL足量的食盐水(电解过程溶液体积不变),则通电5 min后,溶液的pH为________。 解析:根据已知条件通电5 min后,电极5的质量增加2.16 g,说明电极5作阴极,银离子放电,电极反应为Ag++e-===Ag,转移电子的物质的量为0.02 mol,同时可知电极6作阳极,与电源的正极相连。同时可得a是负极,b是正极,电极1、3、5作阴极,电极 2、4、6作阳极。由此可得(1)中答案。 (2)B槽中电解总反应为2CuSO4+2H2O2Cu+O2↑+2H2SO4,若转移0.02 mol电子时只收集到O2(只电解溶质),则根据关系式2CuSO4~O2~4e-可得n(O2)=0.005 mol,体积为112 mL(标准状况)<224 mL,说明溶质CuSO4已耗完,然后电解水。设整个过程消耗CuSO4 x mol,H2O y mol,则有2x+2y=0.02,x+y=0.01,解得x=y=0.005 mol,则c(CuSO4)=0.025 mol·L-1。 (3)由于A池中电解液足量,A池中只发生反应2NaCl+2H2O2NaOH+H2↑+Cl2↑,根据关系式NaOH~e-,生成的n(NaOH)=0.02 mol,则c(NaOH)==0.1 mol·L-1,即溶液的pH=13。 答案:(1)负(2分) 电解(2分) 2Cl--2e-===Cl2↑(2分)Ag++e-===Ag(2分)(2)0.025 mol·L-1(3分) (3)13(3分) 11.(16分)(1)电化学沉解法可用于治理水中硝酸盐的污染。 电化学降解NO的原理如图,电源正极为________(填“A”或“B”),阴极反应式为________________________。 (2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。 ①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH)________(填“>”“<”或“=”)c(NO)。 ②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为 _______________________________________________________________。 ③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是 ________g。 (3)电解法也可以利用KHCO3使K2CO3溶液再生。其原理如下图所示,KHCO3应进入________(填“阴极”或“阳极”)室。 结合方程式简述再生K2CO3的原理是___________________________________________ ________________________________________________________________。 解析:(1)由题给原理图可知,Ag-Pt电极上NO发生还原反应生成氮气,因此Ag-Pt电极为阴极,电极反应式为2NO+12H++10e-===N2↑+6H2O,则B为负极,A为电源正极。 (2)①溶液呈现电中性,c(NH)+c(H+)=c(NO)+c(OH-),pH约为5呈酸性,即c(H+)>c(OH-),则c(NH)查看更多
相关文章
- 当前文档收益归属上传用户