2020届一轮复习人教版原理实验设计与评价作业
原理实验设计与评价
一、选择题(每题有1—2个选项符合题意)
1.下列叙述I和II均正确且具有因果关系的是( )
编号
叙述I
叙述II
A
Ksp(CaCO3) < Ksp(CaSO4)
用Na2CO3溶液和盐酸除水垢CaSO4
B
金属钠有还原性
用金属钠检验无水乙醇中是否含有少量水
C
金属活动性铜比铁弱
镀铜铁制品表层划损后仍然受到保护
D
Cl2具有漂白性
用氯气制盐酸
2.下述实验不能达到预期实验目的的是( )
序号
实验内容
实验目的
A
向盛有10滴0.1mol/LAgNO3溶液的试管中滴加0.1mol/LNaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol/LNa2S溶液
证明AgCl能转化为溶解度更小的Ag2S
B
向2mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2 mL苯中加入3滴KMnO4酸性溶液,振荡
证明与苯环相连的甲基易被氧化
C
向Na2SiO3溶液中通入CO2
证明碳酸的酸性比硅酸强
D
向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热
验证淀粉已水解
3.下列相关实验不能达到预期目的的是( )
相关实验
预期目的
A
相同温度下,等质量的大理石块、大理石粉末分别与等体积、等浓度的盐酸反应
探究接触面积对化学反应速率的影响
B
把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中
探究温度对化学平衡的影响
C
在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜悬浊液并加热
探究蔗糖水解产物具有还原性
D
两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入CuSO4溶液
探究CuSO4溶液对H2O2分解速率的影响
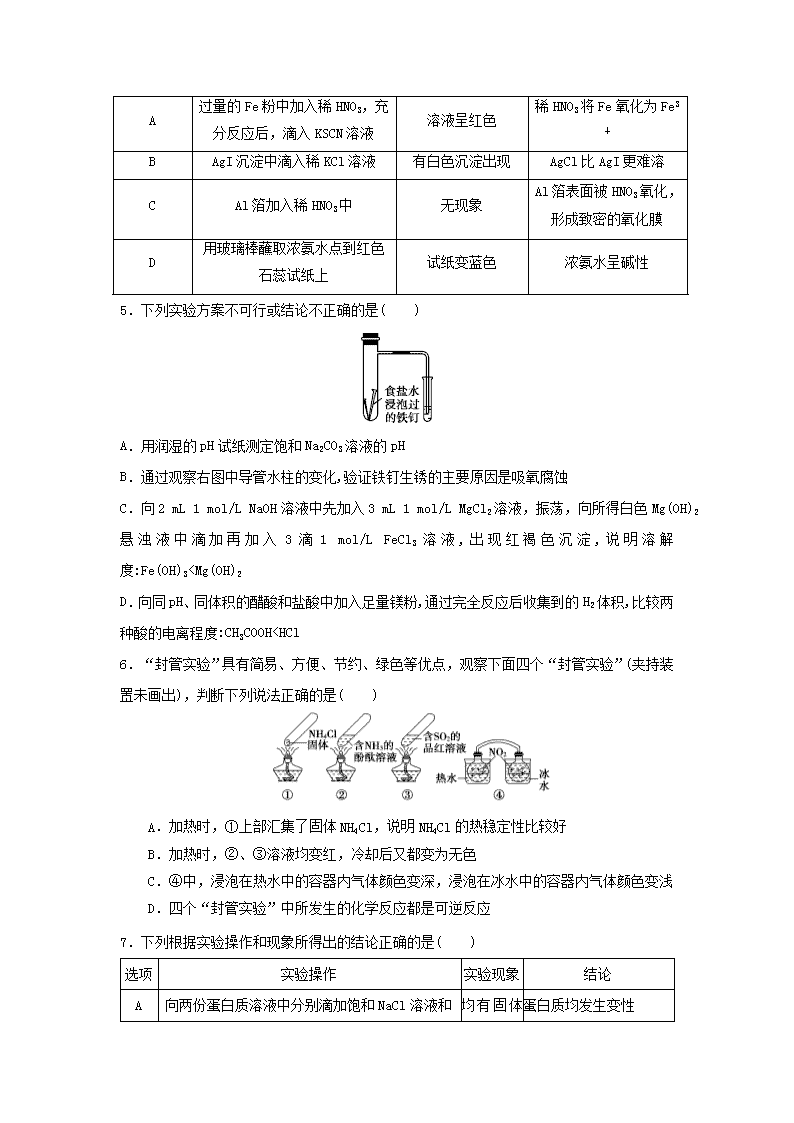
4.下列有关实验操作、现象和解释或结论都正确的是( )
选项
实验操作
现象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈红色
稀HNO3将Fe氧化为Fe3+
B
AgI沉淀中滴入稀KCl溶液
有白色沉淀出现
AgCl比AgI更难溶
C
Al箔加入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
5.下列实验方案不可行或结论不正确的是( )
A.用润湿的pH试纸测定饱和Na2CO3溶液的pH
B.通过观察右图中导管水柱的变化,验证铁钉生锈的主要原因是吸氧腐蚀
C.向2 mL 1 mol/L NaOH溶液中先加入3 mL 1 mol/L MgCl2溶液,振荡,向所得白色Mg(OH)2悬浊液中滴加再加入3滴1 mol/L FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3
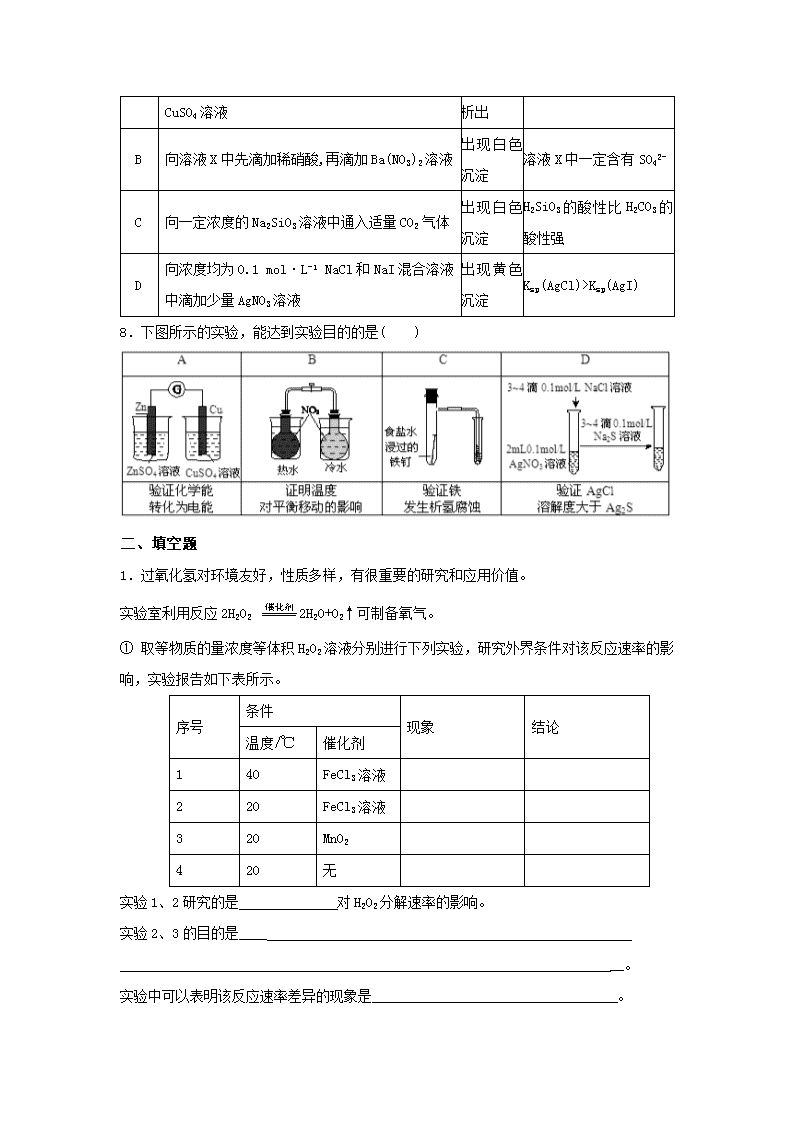
Ksp(AgI)
8.下图所示的实验,能达到实验目的的是( )
二、填空题
1.过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
实验室利用反应2H2O2 2H2O+O2↑可制备氧气。
① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号
条件
现象
结论
温度/℃
催化剂
1
40
FeCl3溶液
2
20
FeCl3溶液
3
20
MnO2
4
20
无
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是____
__。
实验中可以表明该反应速率差异的现象是 。
2.某同学设计了如下图所示装置(部分夹持装置已略去)进行实验研究。
请回答:
(1)用上述装置探究影响化学反应速率的因素。
① 圆底烧瓶中发生反应的离子方程式是 。
② 用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
序号
V(H2SO4)/mL
c(H2SO4)/mol·L-1
t/s
Ⅰ
40
1
t1
Ⅱ
40
4
t2
比较实验Ⅰ和Ⅱ可以得出的实验结论是 。
实验过程中,对量气管的操作是 。
③ 若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
① 圆底烧瓶中的试剂可选用(填序号) 。
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
② 能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
3.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:
S2O82- + 2I- 2SO42- + I2 (1)
平均反应速率的计算式为。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应: (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
实 验 编 号
①
②
③
④
⑤
试剂
用量
(mL)
0.20 mol·L-1 (NH4)2S2O8溶液
20.0
10.0
b
20.0
20.0
0.20 mol·L-1 KI溶液
20.0
20.0
20.0
10.0
5.0
0.010 mol·L-1 Na2S2O3溶液
a
8.0
8.0
8.0
8.0
0.2% 淀粉溶液
2.0
2.0
2.0
2.0
2.0
0.20 mol·L-1KNO3溶液
0
0
0
10.0
c
0.20 mol·L-1(NH4)2SO4溶液
0
10.0
15.0
0
0
20 ℃时,反应时间Δt(s)
32
67
130
66
135
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol· (L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
4.某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气体积的关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中的一种方法 。
5.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4 ==K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号
室温下,试管中所加试剂及其用量 / mL
室温下溶液颜色褪至无色所需时间 / min
0.6 mol/L
H2C2O4溶液
H2O
0.2 mol/L KMnO4溶液
3 mol/L
稀硫酸
1
3.0
2.0
3.0
2.0
4.0
2
3.0
3.0
2.0
2.0
5.2
3
3.0
4.0
1.0
2.0
6.4
请回答:
(1)根据上表中的实验数据,可以得到的结论是
。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:
υ(KMnO4) = 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同
学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
图1
图2
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号
室温下,试管中所加试剂及其用量 / mL
再向试管中加入少量固体
室温下溶液颜色褪至无色所需时间 / min
0.6 mol/L
H2C2O4溶液
H2O
0.2 mol/L KMnO4溶液
3 mol/L
稀硫酸
4
3.0
2.0
3.0
2.0
t
③若该小组同学提出的假设成立,应观察到的现象是
。
【答案与解析】
一、选择题
1.A
2. D
【解析】向淀粉溶液中加入稀硫酸,水浴加热,淀粉水解后生成葡萄糖,葡萄糖与新制的氢氧化铜反应需要在碱性条件下反应,因此应先加碱中和掉硫酸。
3.C
【解析】C项,蔗糖中加入稀H2SO4,水浴加热后应加入NaOH中和过量的稀H2SO4,再加新制的Cu(OH)2悬浊液。
4.D
【解析】过量Fe粉被稀HNO3氧化为Fe2+,加入KSCN溶液不显红色,A错误;在相同条件下,AgI比AgCl更难溶,B错误;Al箔表面不能被稀HNO3氧化形成致密的氧化膜,C错误;红色石蕊试纸遇碱变蓝,D正确。
5. A
【解析】A.用pH试纸测定饱和Na2CO3溶液的pH时不能润湿;C. MgCl2过量,NaOH反应完,加入3滴1 mol/L FeCl3溶液,出现红褐色沉淀, 说明Mg(OH)2的溶解平衡被破坏。
6.C
【解析】加热时NH4Cl分解为NH3和HCl,在封管上部遇冷NH3和HCl又化合成NH4Cl,说明NH4Cl的热稳定性差,故A项错误;加热时②溶液变无色,冷却后变为红色,加热时③溶液变为红色,冷却后变为无色,故B项错误;由于2NO2 N2O4为放热反应,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅,故C项正确;封管①中发生的化学反应不是可逆反应,故D不正确。
7.D
【解析】A项,向蛋白质溶液中滴加饱和NaCl溶液,蛋白质析出,该变化属于蛋白质的盐析,蛋白质并没有发生变性;B项,若溶液X中含有SO32-,滴加稀硝酸后,SO32-被氧化为SO42-,再滴加Ba(NO3)2溶液,也会出现白色沉淀;C项,Na2SiO3+CO2+H2OH2SiO3↓+Na2CO3,说明酸性:H2CO3>H2SiO3;D项,对于相同类型的分子(如AB型),通常Ksp越小,在相同条件下越易形成沉淀。
8.B
二、填空题
1.①温度
比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异
产生气泡的快慢
旋转分液漏斗的活塞,控制滴加H2O2溶液的速率
【解析】实验1、2只有温度不同,所以研究的是温度对反应速率的影响; 实验2、3温度是相同的,而催化剂不同,所以研究的是不同催化剂对反应速率的影响。反应速率快,产生的气体多,气泡就多而快,反应速率慢,产生的气体少,气泡就少而慢。
2.(1)①(2分)Zn+2H+ = Zn2++H2↑
②(2分)在其它条件一定时,化学反应速率随反应物浓度的增大而增大
(2分)调整量气管,使其左右管中水面始终持平
③(2分)abc
(2)①(2分)ac
②(2分)量气管左管的水面上升,右管的水面下降
3.(1)a 8.0;b 5.0;c 15.0
(2)搅拌
(3)
(4)反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关(只答浓度对化学反应速率有影响给1分)。
【解析】为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后总体积为50ml,所以a、b、c分别为8.0、5.0、15.0。
从整个反应看,是的2倍,
,=.
根据上表得出,由①②得出反应时间与的起始浓度成比例关系,由①④得出反应时间与KI的起始浓度成比例关系,由此得出,反应速率与物质浓度成反比,而与化学方程式中的系数无关。
4.(1)Mg+2H+=Mg2++H2↑
(2)没有说明两种酸的浓度相等
(3)盐酸的快,醋酸的慢 相等
(4)反应放热,过量镁与水反应
(5)盐酸酸性比醋酸强
(6)测定同浓度盐酸和醋酸的pH(其它合理答案均可)
【解析】要比较盐酸和醋酸的酸性,所用的酸物质的量浓度必须是相等的;物质的量浓度相等的盐酸和醋酸中氢离子的浓度是不一样的,因为盐酸是强酸,氢离子全部电离,醋酸是弱酸,只能部分电离,但是随着反应的进行,氢离子会全部电离出来。镁和冷水反应不明显,但与热水还是要反应的,生成氢氧化镁和氢气。
比较盐酸与醋酸的酸性强弱可以测定同浓度盐酸和醋酸的pH,也可以把体积和pH相同的盐酸和醋酸用水稀释相同的倍数,盐酸的pH值变化比较大,醋酸的pH值变化比较小,因为弱酸越稀电离程度越大。
5.(1)其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大
(2)1.5 × 10-2 mol / (L·min)
(3) ①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②MnSO4
③与实验1比较,溶液褪色所需时间短。 或:所用时间(t)小于4min(或其他合理答案)