- 2021-07-02 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年湖南省湘西自治州四校高二上学期12月联考化学试题(Word版)
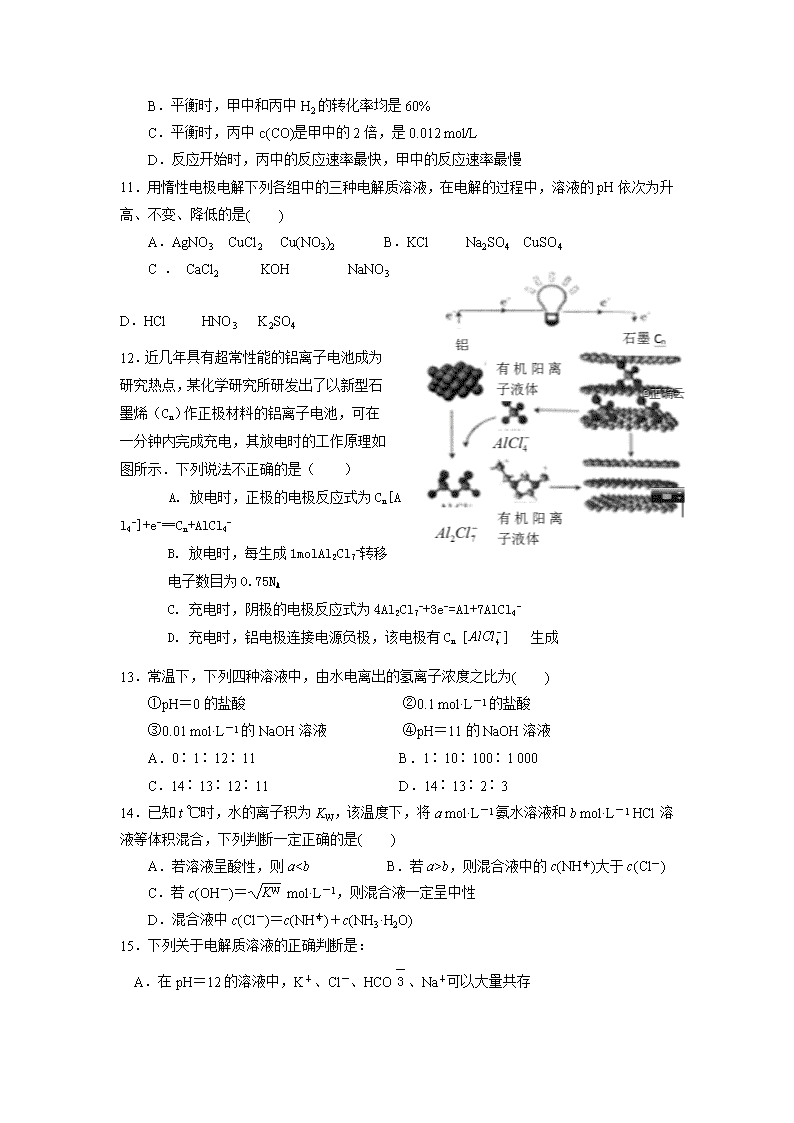
湘西自治州2018年下学期高二年级12月四校联考 化学试题 命题:廖小芳 审题:泸溪一中 高一化学备课组 时间:90分钟 总分:100分 相对原子质量:H-1 Zn- 65 Cu- 64 Fe -56 Mg- 24 Al -27 S- 32 O- 16 C -12 一、选择题(每小题只有一个选项符合题意,每小题3分,共48分) 1.反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( ) 2.下列有关能量的判断和表示方法正确的是( ) A.由C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ,可知:金刚石比石墨更稳定 B.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量更多 C.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ 3.100 mL 2 mol·L-1 H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量( ) A.硝酸钠溶液 B.NaCl固体 C.硫酸铜溶液 D.醋酸钠溶液 4.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1④v(D)=0.45 mol·L-1·s-1。下列有关反应速率的比较中正确的是( ) A.④>③=②>① B.①>②>③>④ C.①>④>②=③ D.④>③>②>① 5.某化学反应其△H=—122 kJ/mol,∆S= 231 J/(mol·K),下列说法正确的是: A.在任何温度下都不能自发进行 B.在任何温度下都能自发进行 C.仅在高温下自发进行 D.仅在低温下自发进行 6.可逆反应2NO22NO+O2,在恒容密闭容器中反应,达到平衡状态的标志是: ①单位时间内生成n molO2的同时生成2n molNO2 ②单位时间内生成n molO2的同时生成2n mol NO ③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 A.①④ B.②③⑤ C.①③④ D.①②③④⑤ 7、下列事实不能用勒夏特列原理解释的是: A. 黄绿色的氯水光照后颜色变浅 B. 温度过高对合成氨不利 C. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 D. 溴水中有平衡:Br2+ H2OHBr+ HBrO,当加入AgNO3溶液后,溶液颜色变浅 8.可逆反应mA(g)+nB(s)pC(g)+qD(g),在反应过程中,当其他条件不变时,D的百分含量与温度(T)和压强(P)的关系如图所示,判断下列叙述中不正确的是: A.达到平衡后,升高温度,平衡向逆反应方向移动 B.达到平衡后,若使用催化剂,D的物质的量分数不变 C.化学方程式中一定有m<p+q D.平衡后增大B的量,有利于平衡向正反应方向移动 9、在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.35 mol/L,下列有关判断正确的是: A. x+y<z B. 平衡正向移动 C. A的转化率降低 D. C的体积分数升高 10.某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K=,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示, 起始浓度 甲 乙 丙 c(H2)(mol/L) 0.010 0.020 0.020 c(CO2)(mol/L) 0.010 0.010 0.020 下列判断不正确的是: A.平衡时,乙中H2的转化率大于60% B.平衡时,甲中和丙中H2的转化率均是60% C.平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢 11.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( ) A.AgNO3 CuCl2 Cu(NO3)2 B.KCl Na2SO4 CuSO4 C.CaCl2 KOH NaNO3 D.HCl HNO3 K2SO4 12.近几年具有超常性能的铝离子电池成为研究热点,某化学研究所研发出了以新型石墨烯(Cn)作正极材料的铝离子电池,可在一分钟内完成充电,其放电时的工作原理如图所示.下列说法不正确的是( ) A. 放电时,正极的电极反应式为Cn[AlCl4-]+e-═Cn+AlCl4- B. 放电时,每生成1molAl2Cl7-转移电子数目为0.75NA C. 充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- D. 充电时,铝电极连接电源负极,该电极有Cn 生成 13.常温下,下列四种溶液中,由水电离出的氢离子浓度之比为( ) ①pH=0的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH溶液 ④pH=11的NaOH溶液 A.0∶1∶12∶11 B.1∶10∶100∶1 000 C.14∶13∶12∶11 D.14∶13∶2∶3 14.已知t ℃时,水的离子积为KW,该温度下,将a mol·L-1氨水溶液和b mol·L-1 HCl溶液等体积混合,下列判断一定正确的是( ) A.若溶液呈酸性,则ab,则混合液中的c(NH)大于c(Cl-) C.若c(OH-)= mol·L-1,则混合液一定呈中性 D.混合液中c(Cl-)=c(NH)+c(NH3·H2O) 15.下列关于电解质溶液的正确判断是: A.在pH=12的溶液中,K+、Cl-、HCO、Na+可以大量共存 B.在pH=0的溶液中,Na+、NO、SO、K+可以大量共存 C.由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH===B++OH- D.由0.1 mol/L一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2OHA+OH- 16.常温下,浓度均为0.1 mol·L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG随lg 的变化如图所示。下列叙述正确的是( ) A.相同条件下NaX溶液的pH大于NaY溶液的pH B.水的电离程度:a=b查看更多