【化学】河北省2020届高三全国Ⅰ卷模拟试卷19(解析版)
河北省2020届高三全国Ⅰ卷模拟试卷19
一、选择题:本题共 7 小题,每小题 6 分,共 42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活、生产密切相关。下列说法错误的是( )
A.铁质器件附有铜质配件,在接触处易生铁锈
B.燃煤中加入生石灰可有效减少污染物的排放量
C.二氧化硫可广泛用于食品的漂白
D.漂白粉可作棉、麻的漂白剂,也可用作环境的消毒剂
解析:铁质器件附有铜配件时,在接触电解质溶液时,铁是原电池的负极,易被腐蚀生成铁锈,故A正确;利用生石灰可以“固硫”,反应为2CaO+2SO2+O2===2CaSO4,所以可以减少二氧化硫的排放,故B正确;SO2不能用于漂白食品,故C错误;漂白粉具有强氧化性、漂白性,可作棉、麻的漂白剂,也可用作环境的消毒剂,故D正确。
答案:C
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.密闭容器中2 mol NO与2 mol O2充分反应,体系中的原子总数为8NA
B.100 g质量分数为9.8%的硫酸水溶液中含氧原子的数目为0.4NA
C.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D.常温下,0.1 mol·L-1的Na2SO4溶液中含有的离子总数为0.3NA
解析:A.由于NO和氧气均为双原子分子,故2 mol NO和2 mol O2中含8 mol原子,而反应过程中满足原子个数守恒,故将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA,故A正确;B.在硫酸溶液中,除了硫酸外,水也含氧原子,故溶液中含有的氧原子的个数多于0.4NA个,故B错误;C.0.1 mol Fe在0.1 mol氯气中燃烧,铁过量,氯气完全反应,而氯气反应后化合价变为-1价,故0.1 mol氯气转移0.2 mol电子即0.2NA,故C错误;D.未注明溶液的体积,无法计算0.1 mol·L-1的Na2SO4溶液中含有的离子总数,故D错误。
答案:A
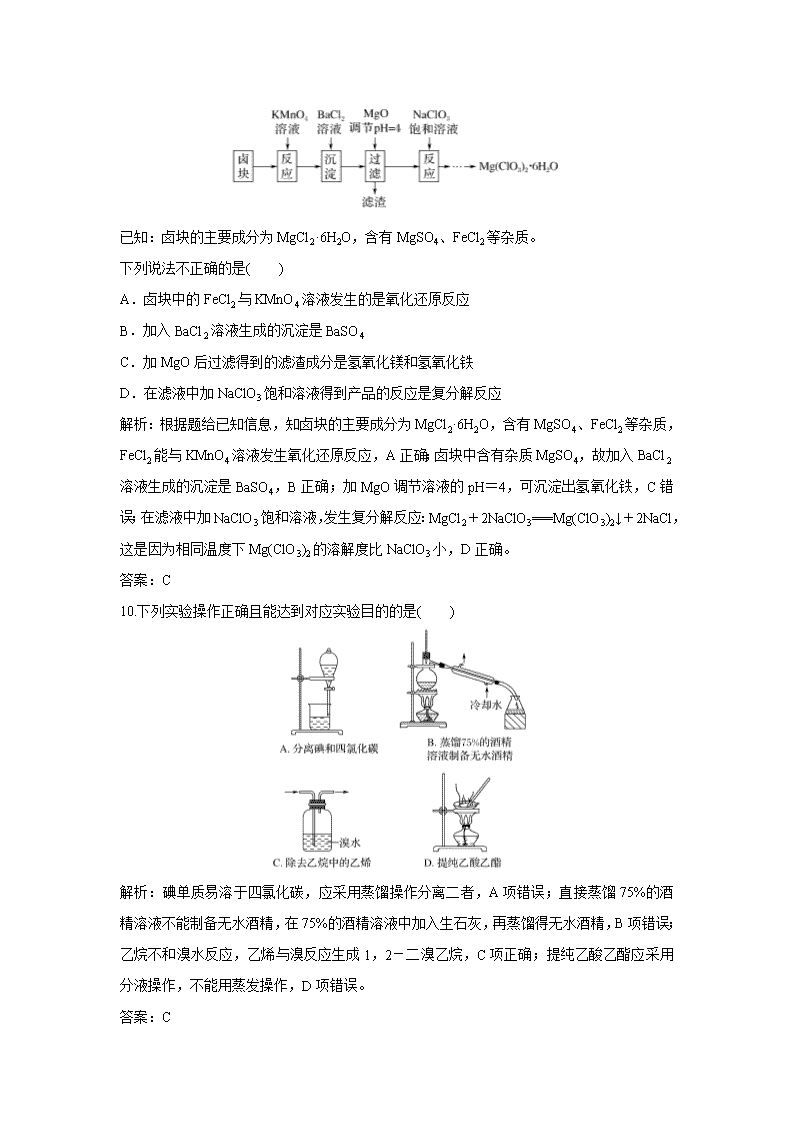
9.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
下列说法不正确的是( )
A.卤块中的FeCl2与KMnO4溶液发生的是氧化还原反应
B.加入BaCl2溶液生成的沉淀是BaSO4
C.加MgO后过滤得到的滤渣成分是氢氧化镁和氢氧化铁
D.在滤液中加NaClO3饱和溶液得到产品的反应是复分解反应
解析:根据题给已知信息,知卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质,FeCl2能与KMnO4溶液发生氧化还原反应,A正确;卤块中含有杂质MgSO4,故加入BaCl2溶液生成的沉淀是BaSO4,B正确;加MgO调节溶液的pH=4,可沉淀出氢氧化铁,C错误;在滤液中加NaClO3饱和溶液,发生复分解反应:MgCl2+2NaClO3===Mg(ClO3)2↓+2NaCl,这是因为相同温度下Mg(ClO3)2的溶解度比NaClO3小,D正确。
答案:C
10.下列实验操作正确且能达到对应实验目的的是( )
解析:碘单质易溶于四氯化碳,应采用蒸馏操作分离二者,A项错误;直接蒸馏75%的酒精溶液不能制备无水酒精,在75%的酒精溶液中加入生石灰,再蒸馏得无水酒精,B项错误;乙烷不和溴水反应,乙烯与溴反应生成1,2-二溴乙烷,C项正确;提纯乙酸乙酯应采用分液操作,不能用蒸发操作,D项错误。
答案:C
11.短周期1~10号元素W、X、Y、Z的原子序数依次增大,W的最高正价和最低负价的代数和为0;X的一种核素在考古时常用来鉴定此文物的年代,Y的常见氢化物和最高价氧化物的水化物能反应生成一种离子化合物,工业上采用液态空气分馏方法来生产Y的单质。Z是地壳中含量最高的元素。根据以上叙述,下列说法中不正确的是( )
A.元素简单气态气化物的热稳定性:Z>Y>X
B.W可与同主族的元素形成离子化合物
C.W、X、Y、Z四种元素可形成水溶液显中性的盐
D.X、Z分别与W形成化合物的沸点一定有:X
1
C.向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO)+2c(XO)+2c(OH-)
D.实线M表示pOH与lg的变化关系
答案:B
解析:Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO)、c(OH-)均减小,温度不变,Kw不变,因此c(H+)增大,Na2XO3溶液加水稀释,一直增大,A错误;==,根据图像当lg=0时,溶液的pOH=4,水解大于电离,溶液显碱性,所以Kh/Ka1>1,即在NaHXO
3溶液中:>1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时:溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO)+2c(XO)+c(OH-),C错误;Na2XO3为强碱弱酸盐,水解显碱性,分两步水解:XO+H2OHXO+OH-, HXO+H2OH2XO3+OH-;水解的第一步程度较大,因此比值较大,当=10-4时,溶液的碱性最强,pOH=0;第二步水解受到第一步抑制,水解程度较小,比值较小,当=10-9时,溶液的碱性最强,pOH=0;所以实线M表示pOH与lg的变化关系,D错误。
二、非选择题:共 58 分。第26~28 题为必考题,每个试题考生都必须作答。第 35题~第 36题为选考题,考生根据要求作答。
26.(2019·长沙市长郡中学高三上学期一模,27)如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为_______________________________________________。
(2)滤液①需要加过量Z,检验Z过量的方法是________________________________。
(3)写出生成CuCl的化学方程式:____________________________________。
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置图中的________(填选项字母),过滤后,洗涤CuCl的试剂宜选用____________(填“无水乙醇”或“稀硫酸”)。
(5)CuCl加入饱和NaCl溶液中会部分溶解生成CuCl,在一定温度下建立两个平衡:
Ⅰ.CuCl (s)Cu+(aq)+Cl- (aq) Ksp=1.4×10-6
Ⅱ.CuCl(s)+Cl- (aq)CuCl(aq) K=0.35。
分析c(Cu+)、c(CuCl)和Ksp、K的数学关系,在图中画出c(Cu+)、c(CuCl)的关系曲线(要求至少标出一个坐标点)。
(6)氯化亚铜的定量分析:
①称取样品0.25 g于250 mL锥形瓶中,加入10 mL过量的FeCl3溶液,不断摇动:
②待样品溶解后,加入20 mL蒸馏水和2滴指示剂;
③立即用0.100 0 mol·L-1硫酸铈标准溶液滴定至绿色为终点;
④重复三次,消耗硫酸铈溶液的平均体积为24.30 mL。
上述相应化学反应为CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+,则样品中CuCl的纯度为________(保留三位有效数字)。
解析:(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,说明反应速率快,因为滤渣①中有铁和铜单质,与盐酸反应时能形成无数微小的原电池,极大地加快了反应速率;(2)检验溶液中通入的氯气已过量,可取蚀刻液少量于试管中,加入KBr溶液少量和四氯化碳,若下层液体呈橙色,说明氯气已过量。(3)根据流程图可知,SO2、CuSO4、CuCl2反应生成H2SO4、CuCl,因此化学方程式为:CuCl2+CuSO4+SO2+2H2O===2CuCl↓+2H2SO4。(4)生产中为了提高CuCl产品的质量,尽可能减少CuCl被空气中氧气氧化,宜采用抽滤法快速过滤,所以过滤装置选择B项。洗涤CuCl宜选用无水乙醇,因为CuCl难溶于无水乙醇,洗涤时可减少CuCl的溶解损失,而且后续干燥中易除去乙醇。不选用稀硫酸,虽然CuCl难溶于稀硫酸,但用稀硫酸洗涤,会给CuCl表面带来少量的H+和SO杂质。(5)据反应式CuCl(s)+Cl- (aq)CuCl(aq)和K的定义式有:K=,将分子、分母同乘以c(Cu+)得:K==,将题给的K和Ksp的数据代入得c(CuCl)×c(Cu+)=1.4×10-6×0.35=4.9×10-7。取其中(0.7,0.7)做为一个坐标点,图像示意如下:
(6)根据题给的相应化学反应CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+,可得CuCl和Ce4+的反应配比是1∶1,所以可得CuCl的纯度:×100%=96.7%。
答案:(1)滤渣①中有铁和铜,与盐酸反应时形成无数微小的原电池,极大地加快了反应速率
(2)取蚀刻液少量于试管中,加入KBr溶液少量和四氯化碳,如下层液体呈橙色,说明氯气已过量(其他合理答案均可)
(3)CuCl2+CuSO4+SO2+2H2O===2CuCl↓+2H2SO4
(4)B 无水乙醇
(5)
(6)96.7%
27.(2019·河南中原名校第一次质量考评)某小组同学进行实验研究FeCl3溶液和Na2S溶液的反应。
[实验一]
已知:FeS、Fe2S3均为黑色固体,均能溶于盐酸。H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:
ⅰ.Fe3+与S2-反应直接生成沉淀Fe2S3 ⅱ.Fe3+被S2-还原,生成沉淀FeS和S
甲同学进行如下实验:
操作
现象
取少量FeS固体,加入稀盐酸
固体溶解,有臭鸡蛋气味气体生成
取少量Fe2S3固体,加入稀盐酸
固体溶解,出现淡黄色浑浊,有臭鸡蛋气味气体生成
根据上述实验现象和资料,甲同学得出结论:黑色沉淀是Fe2S3。
(1)0.1 mol·L-1 Na2S溶液的pH为12.5。用离子方程式表示其显碱性的原因:________________________________________________________________________。
(2)乙同学认为甲同学的结论不严谨,理由是______________________________________
________________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的原因可能是_________________________________________。
[实验二]
步骤
操作
现象
Ⅰ
开始时,局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失,同时溶液中产生淡黄色浑浊和臭鸡蛋气味的气体
Ⅱ
继续滴加Na2S溶液
一段时间后,产生大量的黑色沉淀,振荡,沉淀不消失
(4)进一步实验证实,步骤Ⅰ中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。步骤Ⅰ中黑色沉淀溶解的反应的离子方程式是________________________________________________________________________。
(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与________相关。
解析:(1)0.1 mol·L-1 Na2S溶液的pH为12.5,呈碱性的原因是S2-水解,离子方程式为S2-+H2OHS-+OH-。(2)乙同学认为甲同学的结论不严谨,理由是黑色沉淀还可能是FeS和Fe2S3的混合物。(3)根据溶解平衡理论,当Fe2S3的溶解度比Fe(OH)3的溶解度小时,反应会生成溶解度更小的Fe2S3沉淀。(4)少量的Na2S溶液与过量的FeCl3溶液反应生成少量的黑色沉淀Fe2S3,由于黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应,所以Fe2S3溶解是与H+作用生成Fe3+和H2S,然后Fe3+与H2S反应,所以步骤Ⅰ
中黑色沉淀溶解的离子方程式是Fe2S3+4H+===2Fe2++S↓+2H2S↑。(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与试剂的相对用量、反应体系的酸碱性相关。
答案:(1)S2-+H2OHS-+OH-
(2)黑色沉淀可能是FeS和Fe2S3的混合物
(3)Fe2S3的溶解度比Fe(OH)3的更小
(4)Fe2S3+4H+===2Fe2++S↓+2H2S↑
(5)试剂的相对用量、反应体系的酸碱性
28. 请应用化学反应原理的相关知识解决下列问题:
(1)已知NaCl的溶解热为3.8 kJ·mol-1(吸热)
Na(s)-e-===Na+(aq) ΔH=-240 kJ/mol
Cl2(g)+e-===Cl-(aq) ΔH=-167 kJ/mol
写出钠在氯气中燃烧的热化学方程式________________________________。
(2)一定条件下,在2 L恒容密闭容器中充入1.5 mol CO2和3 mol H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500 K的条件下,该反应10 min达到平衡;
①该反应是________ (填“吸热”或“放热”)反应。
②在0~10 min时段反应速率v(H2)为________。
③若改充入2 mol CO2和3 mol H2,图中的曲线会________(填“上移”或“下移”)。
(3)根据下表数据回答问题:
表1 25 ℃时浓度为0.1 mol/L两种溶液的pH
溶质
NaClO
Na2CO3
pH
9.7
11.6
表2 25 ℃时两种酸的电离平衡常数
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
①根据表1能不能判断出H2CO3与HClO酸性强弱? ________(填“能”或“不能”)。
②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为________。
③H2SO3溶液和NaHCO3溶液反应的离子方程式为______________________________。
(4)已知:t ℃时,Ksp(AgCl)=1.5×10-10、Ksp(Ag2CrO4)=2.0×10-12;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀,t ℃时,向Cl-和CrO浓度均为0.1 mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为_____________。
解析:(1)已知:①NaCl的溶解热为3.8 kJ/mol(吸热),NaCl(s)===Na+(aq)+Cl-(aq) ΔH1=+3.8 kJ/mol,②Na(s)-e-===Na+(aq) ΔH2=-240 kJ/mol,③Cl2(g)+e-===Cl-(aq) ΔH3=-167 kJ/mol,Na在氯气中燃烧的方程式为Na(s)+Cl2(g)===NaCl(s),该反应可由②+③-①得到,根据盖斯定律,该反应的焓变ΔH=ΔH2+ΔH3-ΔH1=-410.8 kJ/mol;(2)①随着温度升高,CO2平衡转化率降低,表明温度升高不利于反应正向进行,所以反应为放热反应;②温度为500 K时,CO2的平衡转化率为60%,CO2转化的浓度分别为Δc(CO2)==0.45 mol/L,根据化学计量数之比等于速率之比,可知H2转化的浓度Δc(H2)=3Δc(CO2)=1.35 mol/L,所以其化学反应速率v(H2)===0.135 mol·L-1·min-1;③改充入2 mol CO2 和3 mol H2,相当于增加了CO2的比例,可使H2的转化率上升,自身转化率下降;所以图中的曲线会下移;
(3)①因H2CO3为二元弱酸,第一步电离得到的HCO,第二步电离生成CO,所以根据NaClO和Na2CO3的pH值只能比较HClO和HCO的酸性强弱,不能比较HClO和H2CO3的酸性强弱;②0.1 mol/L Na2SO3溶液中,SO水解使溶液显碱性,溶液中存在SO+H2OHSO+OH-,HSO+H2OH2SO3+OH-,H2OH++OH-,综合考虑溶液中离子浓度大小顺序为:c(Na+)>c(SO)>c(OH-)>c(HSO)>c(H+);③根据电离常数及强酸制弱酸的原理分析,H2SO3的酸性比H2CO3的酸性强,因此H2SO3与NaHCO3溶液反应生成CO2,所以H2SO3与NaHCO3溶液发生的反应的离子方程式为:H2SO3+HCO===HSO+H2O+CO2
↑;(5)开始形成AgCl时,需要的Ag+的浓度c(Ag+)== mol/L=1.5×10-9 mol/L,同理可得开始形成Ag2CrO4时,需要的Ag+的浓度c(Ag+)= mol/L≈4.5×10-6 mol/L,显然先生成沉淀AgCl,再生成沉淀Ag2CrO4,向Cl-和CrO浓度均为0.1 mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为:先生成白色沉淀,后来变成砖红色。
答案:(1)Na(s)+Cl2(g)===NaCl(s) ΔH=-410.8 kJ/mol
(2)①放热 ②0.135 mol·L-1·min-1 ③下移
(3)①不能 ②c(Na+)>c(SO)>c(OH-)>c(HSO)>c(H+) ③H2SO3+HCO===HSO+H2O+CO2↑
(4)先生成白色沉淀,后来变成砖红色
35.(1)①丙酮()分子中碳原子轨道的杂化类型是____________,1 mol丙酮分子中含有σ键的数目为__________________。
②乙醇的沸点高于丙酮,这是因为_______________________________________________。
(2)①碳的一种单质的结构如图a所示。该单质的晶体类型为________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为____________________。
②SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
③四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图b所示。
ⅰ.SiX4的沸点依F、Cl、Br、I顺序升高的原因是____________________________________
________________________________________________________________________。
ⅱ.结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I顺序,PbX2中的化学键的离子性________、共价性________。(填“增强”“不变”或“减弱”)
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
①1 mol HCHO分子中含有σ键的数目为________mol。
②HOCH2CN分子中碳原子轨道的杂化类型为________。
③与H2O分子互为等电子体的阴离子为________。
④[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为________________。
(4)①V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中S原子价层电子对数是________对,分子的立体构型为________;SO3气态为单分子,该分子中S原子的杂化轨道类型为________;SO3的三聚体环状结构如图c所示,该结构中S原子的杂化轨道类型为________;该结构中S—O键长有两类,一类键长约140 pm,另一类键长约为160 pm,较短的键为________(填图c中字母),该分子中含有________个σ键。
②V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为________;也可以得到偏钒酸钠,其阴离子呈如图d所示的无限链状结构,则偏钒酸钠的化学式为________。
解析:(1)①甲基上的碳原子为sp3杂化,羰基上的碳原子为sp2杂化。单键全为σ键,1个双键中含有1个π键和1个σ键,故1 mol丙酮中含有9 mol σ键。②乙醇中含有羟基,可以形成分子间氢键,故沸点高于丙酮。(2)①该单质为石墨,石墨属于混合型晶体,层内碳原子之间形成σ键和π键;石墨中碳原子有3个σ键,无孤电子对,因此杂化类型为sp2;②SiCl4中心原子是Si,有4个σ键,孤电子对数为=0,价层电子对数为4,立体构型为正四面体形,属于非极性分子;③ SiX4属于分子晶体,不含分子间氢键,范德华力越大,熔沸点越高,范德华力随着相对分子质量的增大而增大,即熔沸点增高;同主族从上到下非金属性逐渐减弱,得电子能力逐渐减弱,因此PbX2中化学键的离子性减弱,共价性增强。(3)①HCHO的结构式为,单键为σ键,双键中有1个σ键和1个π键,1个HCHO分子中含有3个σ键,故1 mol HCHO中含有σ键3 mol。②根据HOCH2
CN的结构简式可知,—CH2—中的C原子形成4个σ键,该碳原子采取sp3杂化;—CN中的C原子形成2个σ键、2个π键,该碳原子采取sp杂化。③等电子体是指原子总数相同、价电子总数相同的微粒,H2O分子中有3个原子、8个价电子,根据左右移位法可知,符合条件的阴离子为NH。④Zn2+提供空轨道,CN-中C原子提供孤电子对,两者形成配位键,结构可表示为或。(4)①SO2分子中S原子的价层电子对数为:2+(6-2×2)=3,分子的立体构型为V形;SO3气态为单分子,该分子中S原子的杂化轨道类型为sp2杂化;SO3的三聚体环状结构中,S原子形成4个σ键,S原子杂化轨道类型为sp3杂化;该结构中S—O键长有两类,较短的键为a,该分子中含有12个σ键。②钒酸钠(Na3VO4)中阴离子的立体构型为正四面体形,偏钒酸钠的化学式为NaVO3。
答案:(1)①sp2和sp3 9NA ②乙醇分子间存在氢键
(2)①混合型晶体 σ键、π键 sp2 ②4 正四面体形 非极性 ③ⅰ.均为分子晶体,范德华力随相对分子质量增大而增大 ⅱ.减弱 增强
(3)①3 ②sp3和sp ③NH
④或
(4)①3 V形 sp2 sp3 a 12
②正四面体形 NaVO3
36.(2019·唐山期末)高分子化合物G是一种重要的化工产品,可由烃A(C3H6)和苯合成。合成G的流程图如下:
已知:①B和C中核磁共振氢谱分别有4种和3种峰
②CH3Cl+NaCN―→CH3CN+NaCl
③CH3CNCH3COOH
请回答下列问题:
(1)A的名称是________。
(2)①的反应类型是________,⑥的反应类型是________________________。
(3)D的结构简式是________________。
(4)E中官能团的名称是____________。
(5)⑦的反应的化学方程式是___________________________________________________。
(6)F的同分异构体有多种,符合下列条件的有_______种。
①苯环上仅有两个取代基,且位于对位,其中一个是—NH2
②能水解
③核磁共振氢谱有5种峰
写出符合上述条件的一种同分异构体的结构简式________________。
(7)参照上述流程图,写出用乙烯、NaCN为原料制备聚酯的合成路线(其他无机物任选)。______________________________________________________
解析:由G知,B中—NO2在烷基对位,G上有2个甲基,说明B为,C为,D为E为,F为
(6)能水解,说明含有酯基,且苯环上只有两个取代基并位于对位,符合条件的同分异构体的结构简式为
(7)分析目标产物知,需要增长碳链。先要制备乙二醇和丁二酸。
答案:(1)丙烯
(2)加成反应 还原反应
(7)