云南省玉溪市2020届高三毕业生教学质量检测化学试题
2019~2020学年玉溪市普通高中毕业生第二次教学质量检测
理科综合能力测试化学部分
可能用到的相对原子质量: H -1 C-12 O-16 Na -23 Mg-24 Al -27 Cl-35.5 Fe-56 Zn -65
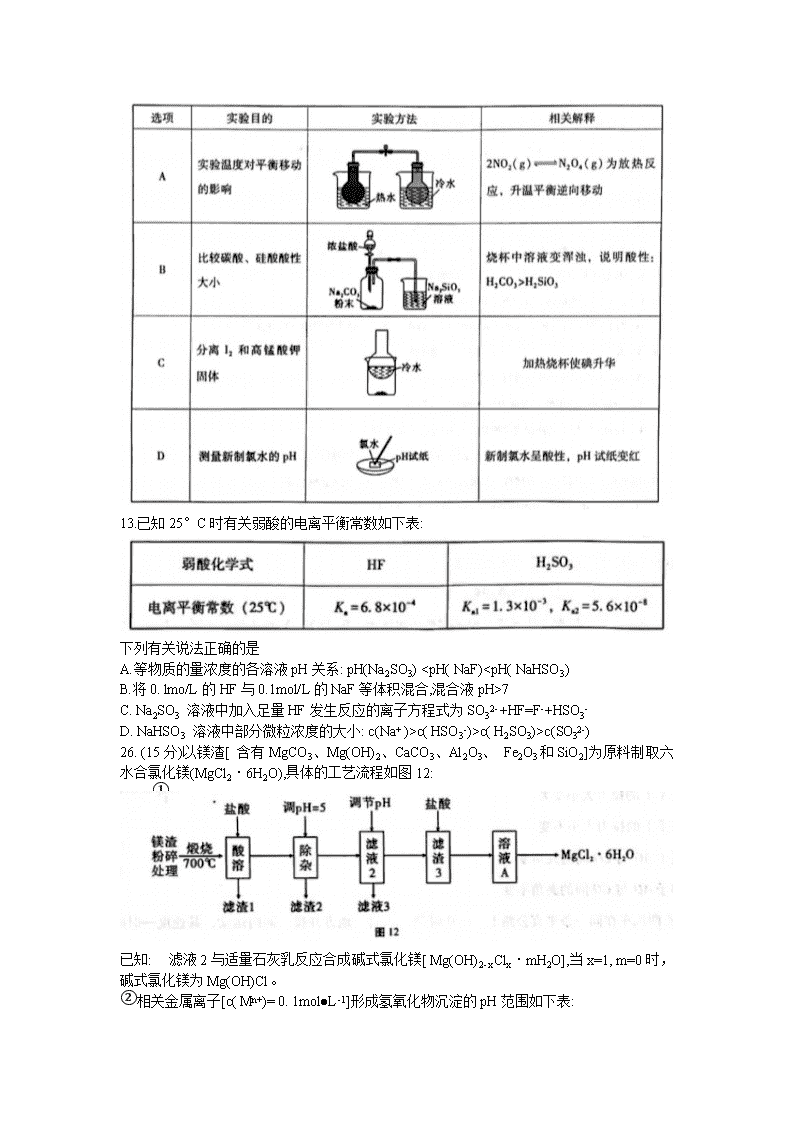
7.化学与生活、社会发展息息相关。下列有关说法不正确的是
A.新版人民币票面文字处的油墨中所含有的Fe3O4是一种磁性氧化物
B.5G技术联通世界离不开光缆,光缆的主要成分是晶体硅
C.雷雨过后感觉到空气清新是因为空气中产生了臭氧
D.“白墙黑瓦青石板,烟雨小巷油纸伞" ,诗中伞骨架主要成分可用(C6H10O3)。 表示
8. NA为阿伏加德罗常数的值。下列说法正确的是
A.36g冰中含有氢键的数目为2NA
B.100g 30%的甲醛水溶液中所含的氧原子数目为1NA
C.1mol Cl2与足量铁粉完全燃烧,转移的电子数为3NA
D.14g Fe发生电化学腐蚀最终生成Fe2O3 · xH2O,电极反应转移的电子数为0.5NA
9.熔喷布是口罩最核心的材料,以聚丙烯为主要原料。下列说法正确的是
A.糖类、蛋白质、聚丙烯都是天然有机高分子化合物
B.聚丙烯和乙烯是同系物
C.聚丙烯的单体中最多7个原子共平面
D.聚丙烯能使酸性高锰酸钾溶液褪色
10.W、X、Y、Z为短周期主族元素且原子序数依次增大。W和Y,X和Z均位于同一主族,Z单质与Y的最高价氧化物对应水化物反应可生成“84”消毒液的主要成分。下列说法正确的是
A. X和Z的氢化物的沸点: X
Y>X
11.一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4ZnMn2O4.(07
C. Na2SO3 溶液中加入足量HF发生反应的离子方程式为SO32- +HF=F-+HSO3-
D. NaHSO3 溶液中部分微粒浓度的大小: c(Na+ )>c( HSO3-)>c( H2SO3)>c(SO32-)
26. (15分)以镁渣[ 含有MgCO3、Mg(OH)2、CaCO3、Al2O3、 Fe2O3和SiO2]为原料制取六水合氯化镁(MgCl2·6H2O),具体的工艺流程如图12:
已知:①滤液2与适量石灰乳反应合成碱式氯化镁[ Mg(OH)2- xClx·mH2O],当x=1, m=0时,碱式氯化镁为Mg(OH)Cl。
②相关金属离子[c( Mn+)= 0. 1mol●L-1]形成氢氧化物沉淀的pH范围如下表:
请回答下列问题:
(1)实验室煅烧样品的实验仪器为______
(2)滤渣2的主要成分是_______________
(3)通过调节滤液2的pH来获取Mg(OH)2沉淀,则溶液pH的范围为________
(4)向溶液A中先加入_______(填化学式)酸化,然后_______、冷却结晶、过滤、洗涤和低温干燥得到MgCl2·6H2O,取少量低温干燥得到的MgCl2·6H2O晶体溶于水后发现溶液呈碱性,则含有的杂质是_______从操作上分析引入杂质的原因是_________________________。
(5)热重分析法是程序控制温度下测最物质的质量与温度关系的一种实验技术。MgCl2·6H2O的热重曲线如图13。已知: MgCl2 ●6H2O在空气中受热脱水时,不产生无水氯化镁。
①试确定200°C时固态物质的化学式:____________________
②温度升至554°C时分解得到的主要产物为白色固体和一种酸性气体,写出该反应的化学方程式:____________________________.
27. (14 分)氯化亚铁是重要的还原剂。常用于检测硒,生产氯化铁、聚合氯化铝铁絮凝剂。制备FeCl2 的方法有多种。已知:
请回答下列问题:
(1)在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,______、_______固液分离,洗涤,快速干燥制得。
(2)如图14,用H2还原无水FeCl3制取FeCl2。
①图A是用干燥的Cl2和铁粉制取无水FeCl3的装置。硬质玻璃管和收集器用大口管连接的原因是_____________________________________。
②装置B、C、D、E是用H2还原无水FeCl3制取FeCl2的装置。连接顺序为(可重复使用)_______,仪器C中盛放的试剂是__________________________。
(3)按图15所示装置, 用162. 5g无水氯化铁和225g氯苯,控制反应温度加热3h。冷却,分离提纯得到粗产品。反应为:
2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
①仪器B的作用是______________; C中倒挂漏斗的作用是________
②反应的温度最好控制在132°C左右。则最佳的加热方式为_______(填序号)。
A.直接用酒精灯加热 B.隔石棉网用酒精灯加热
C.水浴加热 D.油浴加热
③通过烧杯C现象变化可以监控氯化铁的转化率。若烧杯C中试剂为加有酚酞且含18g NaOH的溶液,则氯化铁转化率理论上达到或超过_____ %。
28. (14分)中国是世界上最大的钨储藏国,超细钨粉是生产硬质合金所必须的原料。
(1)工业上可以采用铝热还原法生产钨铁合金,已知:
①WO3(s) +2Al(s)= =W(s)+Al2O3(s) ∆H1
②3Fe3O4(s) +8Al(s)=9Fe(s)+4Al2O3(s) ∆H2
则四氧化三铁与钨反应的热化学方程式为_________(反应热写为∆H3并用含△H1、AH2的代数式表示);在反应②中若有0.1mol Fe3O4参加反应,则转移电子_____ mol。
(2)自然界中钨主要存在于黑钨矿中(主要成分是铁和锰的钨酸盐),从中制备出黄钨(WO3)后再用H2逐级还原: WO3 →WO2.90→WO2.72→WO2的→W,总反应为3H2(g)+WO3(s) W(s)+3H2O(g) ∆H, 实验测得一定条件下平衡时H2的体积分数曲线如图16所示:
①由图可知,该反应的∆H_______(填“>”或“<”) 0; a点处的v正______v逆
(填“>”“<”或“=”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是
_________(填序号)。
A. v正(H2)=v逆( H2O) B.加入WO3,则H2的转化率增大
C.容器内气体的密度不变时,一定达到平衡状态 D.容器内压强不变时, 一定达到平衡状态
③由图可知900K,氢气的平衡转化率为_______,Kp(900K)=_______(用平衡分压代替平衡浓度计算,已知:平衡分压=p总×气体物质的量分数)。
④已知在高温下,氧化钨会与水蒸气反应生成一种挥发性极强的水钨化合物WO2(OH)2,因此在反应中要适当加快氢气的流速,原因是________________________________。
35. [化学---选修3: 物质结构与性质] (15 分)
氢氧化镍在乙醇的悬浊液中可发生反应生成单质镍的配合物: Ni(OH)2+5CH3NC =(CH3NC)4Ni+CH3NCO+H2O。
(1)基态镍原子的未成对电子数为_______, 钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,基态钯原子的外围电子排布式为_______。
(2) CH3NCO中四种元素的第一电离能由大到小的顺序为_________.CH3NC (结构简式为
CH3—N≡C)分子中甲基碳原子的杂化轨道类型是_____。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO.与COCl2 互为等电子体的一种阴离子为_________。
(4)如图22,在镍的催化作用下,甲基呋哺与氨在高温下反应得到甲基吡咯。甲基吡咯的熔、沸点高于甲基呋喃的原因是_____________。
(5) (CH3NC)4Ni 可作为储氢材料,某种镁铝合金也可作为储氢材料,该合金晶胞结构如图23所示,晶胞棱长为a nm,该合金的化学式为________,该晶体
的密度为__________g· cm-3 (阿伏加德罗常数的数值用NA表示)。
36. [化学一选修5: 有机化学基础] (15 分)
合成某药物的中间体G的流程如图24:
请回答下列问题:
(1) A的名称为_______ (系统命名法), F的分子式为_______。反应⑤的反应类型是________。
(2) C中含氧官能团的名称为________________________。
(3)已知一定条件下2分子乙酸分子间脱水生成1分子乙酸酐,写出该反应的化学方程式:
_________________________________________________________。
(4)写出满足下列条件的E的同分异构体的结构简式:___________________。
①苯环上只有三个取代基;
②核磁共振氢谱图中只有4组吸收峰;
③1mol该物质与足量NaHCO3溶液反应生成2mol CO2。
(5)根据已有知识并结合相关信息,写出以C6H5—OOCCH2CH3为原料制备
的合成路线流程图(无机试剂任选)。__________________________________________。