- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届内蒙古杭锦后旗奋斗中学高二下学期第一次月考(2018
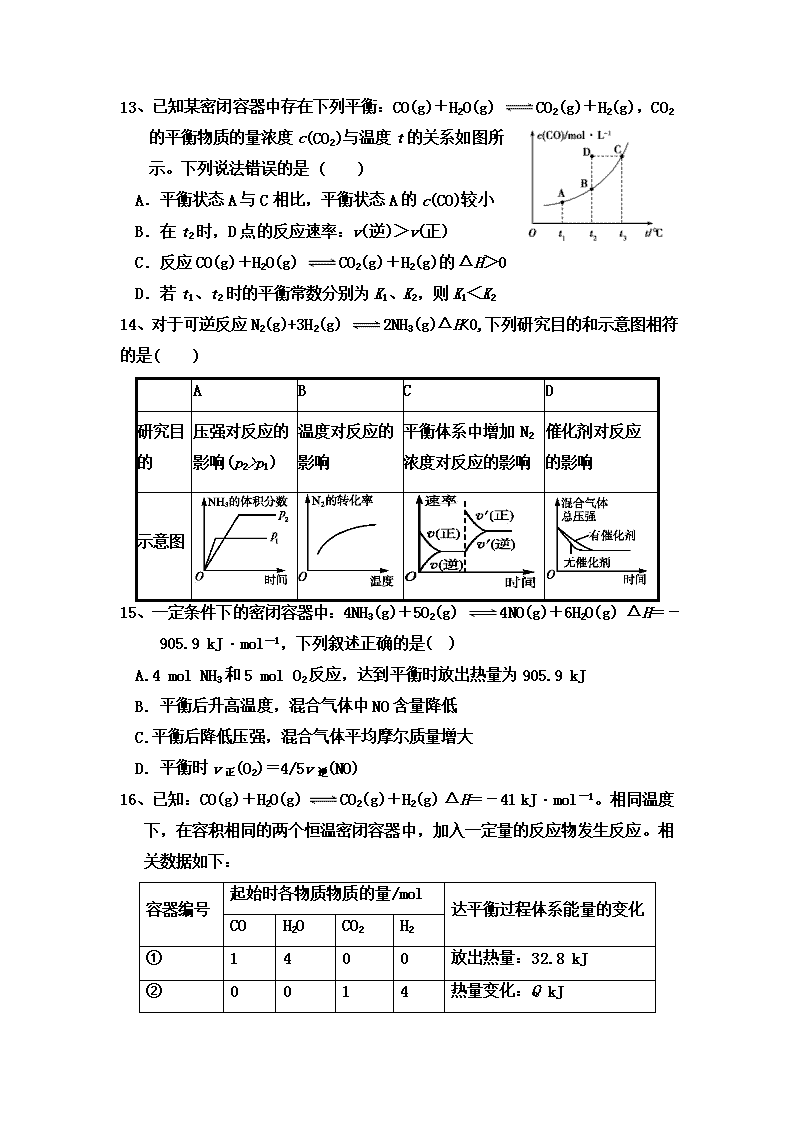
奋斗中学高二年级第一次阶段性考试 化学试题 说明:本试卷共分Ⅰ卷(选择题)Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。 Ⅰ卷(选择题) 一:选择题(每题只有一个正确选项,每题3分,共54分) 1、某反应CH3OH(l)+NH3(g) = CH3NH2(g)+H2O(g)在高温度时才能自发进行,则该反应过程的△H、△S判断正确的是( ) A、△H>0 、△S<0 B、△H<0 、△S>0 C、△H<0 、△S<0 D、△H>0 、△S>0 2、在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g) 2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( ) A.2molH2(g)和1molI2(g) B.3molHI(g) C.2molH2(g)和2molI2(g) D.1molI2(g)和2molHI(g)[来科 3、将等物质的量的A、B混合于2L的恒容密闭容器中,发生如下的反应:3A(g )+B(g) xC(g)+2D(g),经5min后,测得D的量为1mol,C的平均反应速率为0.1mol/(L﹒min)。则x的值为( ) A.4 B.3 C.2 D.1 4、已知450℃时,反应H2(g)+I2(g)⇌2HI(g)的K=50,由此推测在450℃时,反应 2HI(g)H2(g)+I2(g)的化学平衡常数为( ) A.0.02 B. 50 C.100 D.无法确定 5、对于X+YZ的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是( ) A.X为液态,Z为气态 B.X为固态,Z为气态 C.X为气态,Z为气态 D.无法确定 6、在水溶液中存在反应:Ag++Fe2+Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( ) A.升高温度 B.加水稀释 C.增大Fe2+的浓度 D.常温下加压 7、在一化学平衡状态体系中,发生下列量的变化,其中一定会使平衡发生移动的是( ) A.体系的压强 B.反应物的浓度 C.正、逆反应速率 D.反应物的转化率 8、反应CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g) △H<0,达到平衡时,下列说法正确的是( ) A.加入催化剂,平衡常数不变 B.减小容器体积,正反应速率增大、逆反应速率减小 C.增大CO(NH2)2的量, CO2的转化率减小 D.降低温度,平衡向逆反应方向移动 9、在一体积可变的容器中,当反应2HI(g) H2(g)+I2(g) 达到平衡时,欲使混合气体的颜色加深,采取的措施不能达到此目的是( ) A.恒容下充入HI(g) B.恒容下充入H2(g) C.恒容下充入I2(g) D.减小容器体积 10、在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g), C物质的浓度(c%)与温 度、压强的关系如图所示。下列判断正确的是( ) A.△H<0、△S>0 B.△H>0、△S<0 C.△H>0、△S>0 D.△H<0、△S<0 11、对于反应C(s)+H2O(g) CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是( ) A.平衡常数表达式为 B.增大压强,平衡常数K不变 C.升高体系温度,平衡常数K减小 D.增加C(s)的量,平衡正向移动 12、一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g) CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( ) A.v生成(CH3OH)=v消耗(CO) B.CO、H2、CH3OH的浓度比为1:2:1 C.混合气体的密度不再改变D.混合气体的平均相对分子质量不再改变 13、已知某密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2的平衡物质的量浓度c(CO2)与温度t的关系如图所示。下列说法错误的是 ( ) A.平衡状态A与C相比,平衡状态A的c(CO)较小[来源] B.在t2时,D点的反应速率:v(逆)>v(正) C.反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH>0 D.若t1、t2时的平衡常数分别为K1、K2,则K1<K2 14、对于可逆反应N2(g)+3H2(g) 2NH3(g)ΔH<0,下列研究目的和示意图相符的是( ) A B C D 研究目的 压强对反应的影响(p2>p1) 温度对反应的影响 平衡体系中增加N2浓度对反应的影响 催化剂对反应的影响 示意图 15、一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是( ) A.4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ B. 平衡后升高温度,混合气体中NO含量降低 C.平衡后降低压强,混合气体平均摩尔质量增大 D. 平衡时v正(O2)=4/5v逆(NO) 16、已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下: 容器编号 起始时各物质物质的量/mol 达平衡过程体系能量的变化 CO H2O CO2 H2 ① 1 4 0 0 放出热量:32.8 kJ ② 0 0 1 4 热量变化:Q kJ 下列说法中,不正确的是( ) A.容器①中反应达平衡时,CO的转化率为80% B.容器①中CO的转化率等于容器②中CO2的转化率 C.平衡时,两容器中CO2的浓度相等 D.容器①时CO的反应速率等于H2O的反应速率 17、在体积均为1.0L的恒容密闭容器中加入足量 的相同的碳粉,再分别加入0.1molCO2和0.2mol CO2,在不同温度下反应CO2(g)+c(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度 c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( ) A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) C.体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ) D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) 18、对利用甲烷消除NO2污染进行研究,CH4+2NO2 N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( ) 组别 温度 时间/min n/mol 0 10 20 40 50 ① T1 n(CH4) 0.50 0.35 0.25 0.10 0.10 ② T2 n(CH4) 0.50 0.30 0.18 … 0.15 A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1 B. 由实验数据可知实验控制的温度T1查看更多