- 2021-07-02 发布 |
- 37.5 KB |
- 28页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版卤素、硅、硫及其化合物学案
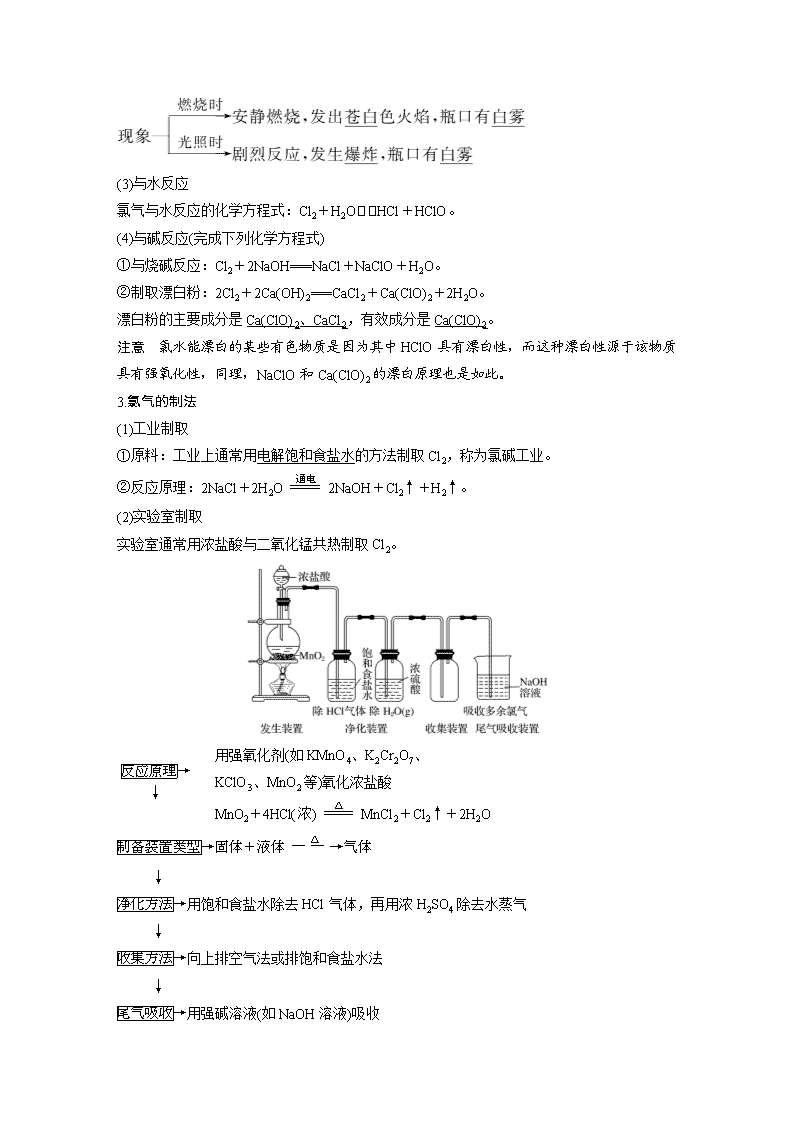
考点一 氯气的性质与制法 [考试标准] 知识条目 必考要求 加试要求 1.氯气的工业制法 a b 2.实验室制取氯气的反应原理及其装置 a b 3.氯气的净化、收集和检验,尾气的处理 b b 4.氯气的物理性质及用途 a a 5.氯气的化学性质(跟某些金属、H2、H2O、碱的反应),HClO的漂白作用 c c 1.氯气的物理性质 颜色 状态 气味 密度 毒性 溶解性 黄绿色 气体 刺激性 比空气大 有毒 1体积水溶解 约2体积Cl2 2.从氯的原子结构认识氯气的化学性质——氧化性 (1)与金属反应:与变价金属反应生成高价金属氯化物。 ①与铁反应:2Fe+3Cl22FeCl3。 ②与铜反应:Cu+Cl2CuCl2。 (2)与非金属反应 与H2反应:H2+Cl22HCl。 (3)与水反应 氯气与水反应的化学方程式:Cl2+H2OHCl+HClO。 (4)与碱反应(完成下列化学方程式) ①与烧碱反应:Cl2+2NaOH===NaCl+NaClO+H2O。 ②制取漂白粉:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。 漂白粉的主要成分是Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2。 注意 氯水能漂白的某些有色物质是因为其中HClO具有漂白性,而这种漂白性源于该物质具有强氧化性,同理,NaClO和Ca(ClO)2的漂白原理也是如此。 3.氯气的制法 (1)工业制取 ①原料:工业上通常用电解饱和食盐水的方法制取Cl2,称为氯碱工业。 ②反应原理:2NaCl+2H2O2NaOH+Cl2↑+H2↑。 (2)实验室制取 实验室通常用浓盐酸与二氧化锰共热制取Cl2。 → ↓ 用强氧化剂(如KMnO4、K2Cr2O7、 KClO3、MnO2等)氧化浓盐酸 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O → ↓ →用饱和食盐水除去HCl气体,再用浓H2SO4除去水蒸气 ↓ →向上排空气法或排饱和食盐水法 ↓ →用强碱溶液(如NaOH溶液)吸收 ↓ (3)注意事项 ①必须用浓盐酸,稀盐酸不反应。 ②为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl挥发。 ③实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。 ④尾气吸收时,不能使用澄清的石灰水,因为石灰水浓度太小,吸收不完全。 正误辨析 正误判断,正确的打“√”,错误的打“×” (1)新制取的漂白粉是纯净物(×) (2)用pH试纸测定氯水的pH为4(×) (3)Cl2具有很强的氧化性,在化学反应中只能作氧化剂(×) (4)漂白粉和明矾都常用于自来水的处理,二者的作用原理不同(√) (5)除去Cl2中少量HCl气体的方法是将混合气体依次通入盛有饱和食盐水和浓H2SO4的洗气瓶(√) (6)MnO2与浓盐酸反应制Cl2的离子方程式:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O(×) (7)氯气在饱和食盐水中的溶解度小于在纯水中的溶解度(√) 题组一 氯气及其化合物的性质 1.(2016·温州8月选考模拟)下列有关氯及其化合物的说法不正确的是( ) A.电解饱和食盐水可制取氯气 B.氯气和氢气在点燃或光照条件下反应的产物不同 C.新制氯水能使红色布条褪色 D.工业上以氯气和石灰乳为原料制造漂白粉 答案 B 解析 H2和Cl2在点燃或光照条件下均生成HCl气体。 2.(2016·嘉兴一中高二期末)下列说法不正确的是( ) A.Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性 B.红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3 C.利用溴单质的氧化性可以把碘离子转化为碘单质 D.实验室常用NaOH溶液吸收多余的Cl2以避免污染 答案 A 解析 A项,氯气溶于水产生的次氯酸具有漂白性,氯气没有漂白性,A错误;B项,红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3,B正确;C项,利用溴单质的氧化性可以把碘离子转化为碘单质,C正确;D项,实验室常用NaOH溶液吸收多余的Cl2以避免污染,D正确。答案选A。 3.(2016·台州9月选考质量评估)下列有关氯及其化合物的说法正确的是( ) A.常温下干燥的Cl2可储存于钢瓶,说明Cl2不与铁反应 B.电解饱和氯化钠溶液可得到氯气、氢气和钠 C.工业上以氯气和澄清石灰水为原料制取漂白粉 D.次氯酸能使染料等有机色素褪色,有漂白性,还能杀死水中的细菌,起消毒作用 答案 D 解析 A项,Cl2与铁在点燃的条件下可生成FeCl3,错误;B项,电解饱和食盐水可得到Cl2、H2和NaOH,错误;C项,工业上可用Cl2和石灰乳为原料制取漂白粉,错误;D项正确。 氯水性质的多重性 新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。 题组二 氯气的制法 4.某化学小组用如图所示装置制取氯气。下列说法正确的是( ) A.该装置图中至少存在三处明显错误 B.该实验中收集氯气的方法不正确 C.如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 答案 A 解析 A项,该装置的错误有:没有用酒精灯加热,MnO2不与浓盐酸发生反应,从而得不到Cl2;装置中没有用分液漏斗而采用长颈漏斗导致气体外逸和HCl的挥发;没有进行尾气处理;B项,Cl2的密度比空气大,该收集方法正确;C项,要得到干燥纯净的Cl2,首先应将气体通过饱和食盐水除去HCl,再通过浓硫酸除去水蒸气;D项,根据反应:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,盐酸浓度变稀后便不再反应,使产生的Cl2的物质的量小于0.5 mol,转移的电子小于1 mol。 5.下图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。 装置B、C、D的作用分别是 B________________________________________________________________________; C________________________________________________________________________; D________________________________________________________________________。 答案 向上排空气收集氯气 安全瓶作用,防止D中的液体倒吸入B中 吸收尾气,防止氯气扩散到空气中污染环境 考点二 溴、碘的制备与性质 [考试标准] 知识条目 必考要求 加试要求 1.溴、碘单质的物理性质 a a 2.氯、溴、碘单质间的置换反应 b b 3.海水中提取溴、碘 b 4.检验Br-、I-的常用方法 b 1.溴、碘单质物理性质比较 性质 Br2 I2 颜色 深红棕色 紫黑色 状态 液体 固体 溶解性 水中 溶解度不大 溶解度不大 有机溶剂中 易溶 易溶 特性 易挥发、有毒 ①易升华 ②使淀粉变蓝 2.Cl2、Br2、I2之间的置换 氯、溴、碘单质的氧化性强弱是Cl2>Br2>I2,阴离子的还原性强弱是Cl-查看更多
相关文章
- 当前文档收益归属上传用户