- 2021-07-02 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版常见气体的实验室制备、净化、收集和检验学案
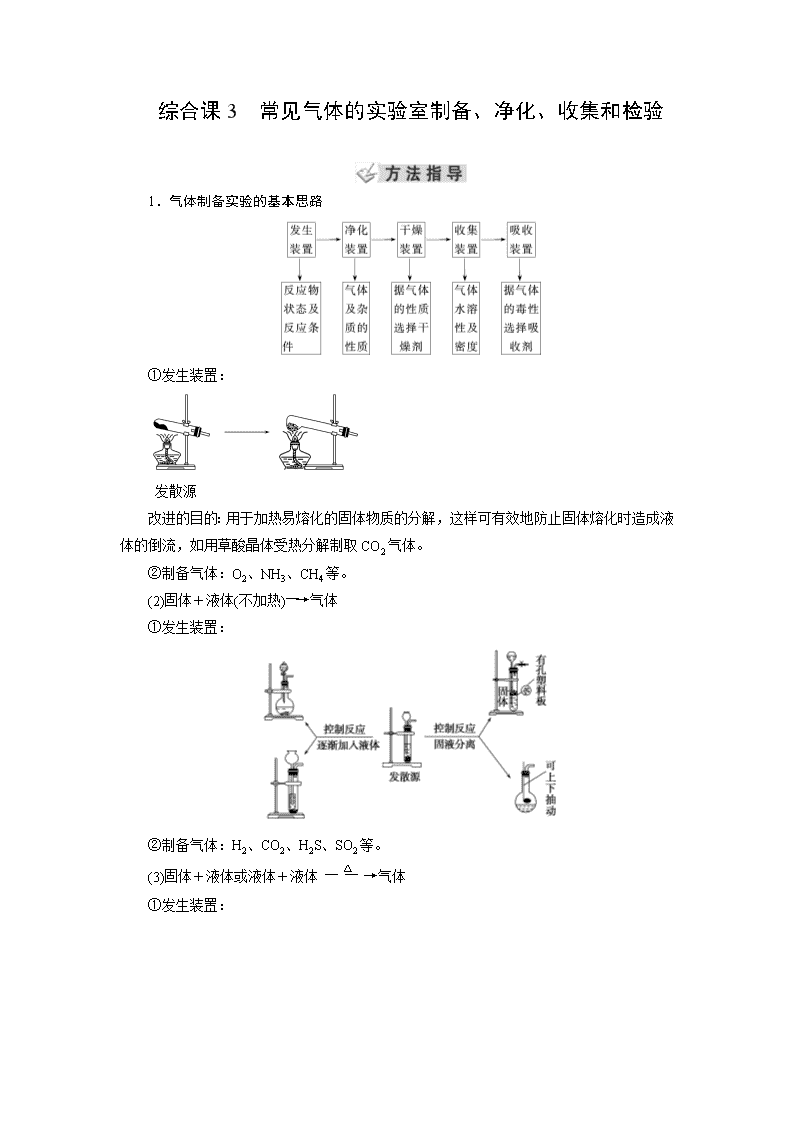
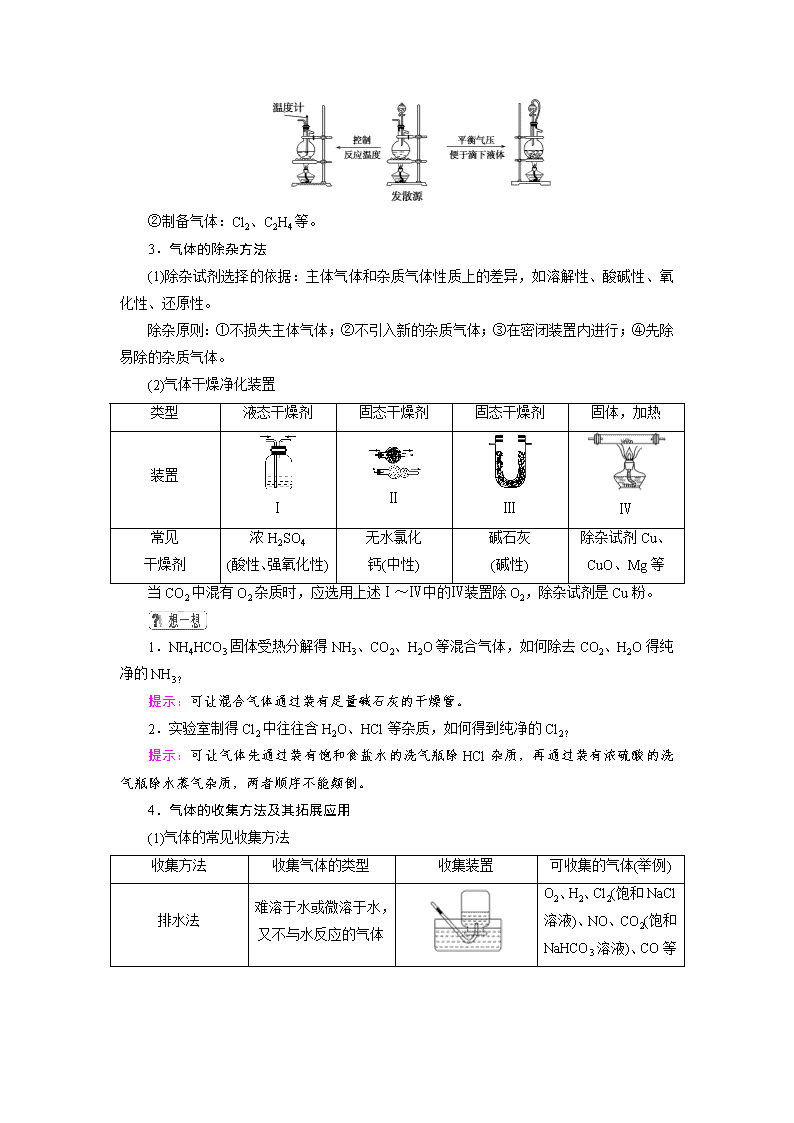
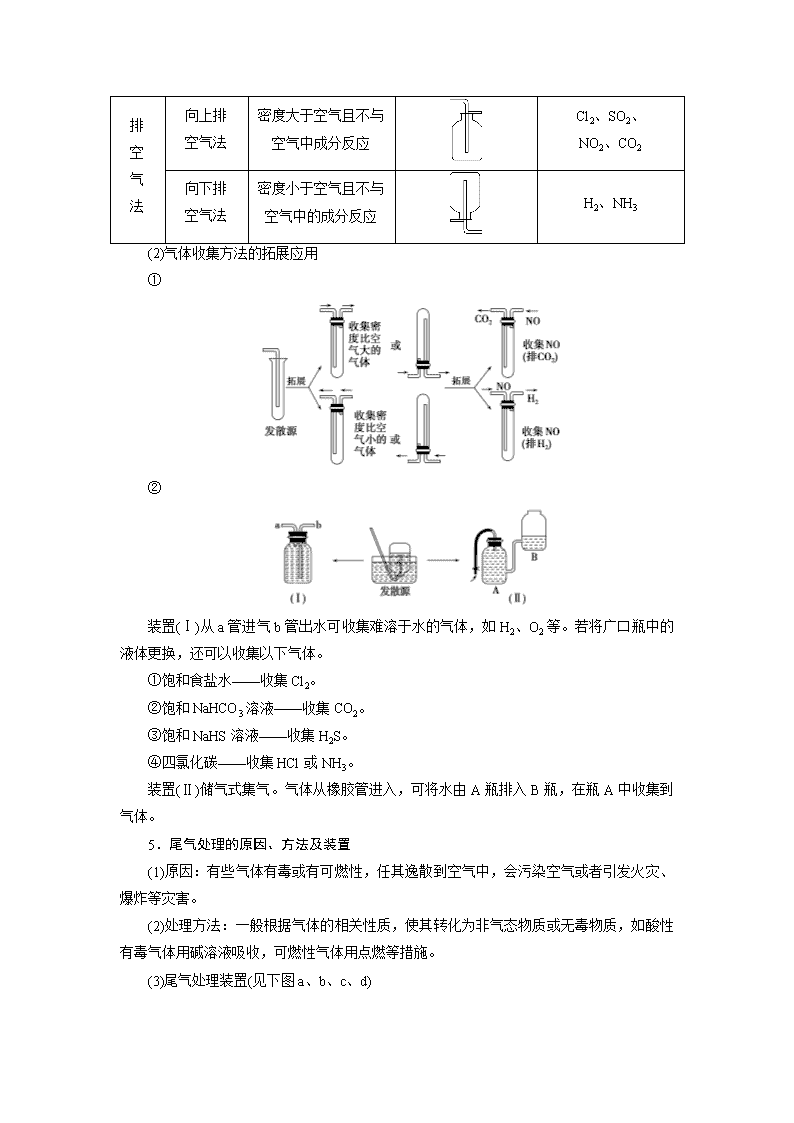
综合课3 常见气体的实验室制备、净化、收集和检验 1.气体制备实验的基本思路 ①发生装置: 发散源 改进的目的:用于加热易熔化的固体物质的分解,这样可有效地防止固体熔化时造成液体的倒流,如用草酸晶体受热分解制取CO2气体。 ②制备气体:O2、NH3、CH4等。 (2)固体+液体(不加热)―→气体 ①发生装置: ②制备气体:H2、CO2、H2S、SO2等。 (3)固体+液体或液体+液体气体 ①发生装置: ②制备气体:Cl2、C2H4等。 3.气体的除杂方法 (1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。 除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。 (2)气体干燥净化装置 类型 液态干燥剂 固态干燥剂 固态干燥剂 固体,加热 装置 Ⅰ Ⅱ Ⅲ Ⅳ 常见 干燥剂 浓H2SO4 (酸性、强氧化性) 无水氯化 钙(中性) 碱石灰 (碱性) 除杂试剂Cu、 CuO、Mg等 当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。 1.NH4HCO3固体受热分解得NH3、CO2、H2O等混合气体,如何除去CO2、H2O得纯净的NH3? 提示:可让混合气体通过装有足量碱石灰的干燥管。 2.实验室制得Cl2中往往含H2O、HCl等杂质,如何得到纯净的Cl2? 提示:可让气体先通过装有饱和食盐水的洗气瓶除HCl杂质,再通过装有浓硫酸的洗气瓶除水蒸气杂质,两者顺序不能颠倒。 4.气体的收集方法及其拓展应用 (1)气体的常见收集方法 收集方法 收集气体的类型 收集装置 可收集的气体(举例) 排水法 难溶于水或微溶于水,又不与水反应的气体 O2、H2、Cl2(饱和NaCl溶液)、NO、CO2(饱和NaHCO3溶液)、CO等 排 空 气 法 向上排 空气法 密度大于空气且不与空气中成分反应 Cl2、SO2、 NO2、CO2 向下排 空气法 密度小于空气且不与空气中的成分反应 H2、NH3 (2)气体收集方法的拓展应用 ① ② 装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。若将广口瓶中的液体更换,还可以收集以下气体。 ①饱和食盐水——收集Cl2。 ②饱和NaHCO3溶液——收集CO2。 ③饱和NaHS溶液——收集H2S。 ④四氯化碳——收集HCl或NH3。 装置(Ⅱ)储气式集气。气体从橡胶管进入,可将水由A瓶排入B瓶,在瓶A中收集到气体。 5.尾气处理的原因、方法及装置 (1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。 (2)处理方法:一般根据气体的相关性质,使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施。 (3)尾气处理装置(见下图a、b、c、d) ①实验室制取Cl2时,尾气的处理可采用ab装置。 ②制取CO时,尾气处理可采用cd装置。 ③制取H2时,尾气处理可采用cd装置。 ④制取NH3、HCl时尾气处理可采用b装置。 6.气体性质的检验 检验气体是根据气体的性质,一般从以下5方面考虑:①气体的颜色和气味;②水溶液的酸碱性;③助燃、可燃及燃烧现象和产物;④遇空气的变化;⑤其他特征。 待检物 操作步骤 现象 O2 用试管或集气瓶取待检气体,然后向试管或集气瓶中插入带有火星的木条 带火星的木条复燃 H2 使待检气体通过尖嘴玻璃导气管并点燃,在火焰上方罩一个干而冷的烧杯 有浅蓝色火焰,烧杯里有水雾生成 NH3 ①用湿润的红色石蕊试纸检验 变蓝 ②把待检气体收集在集气瓶里,盖上玻璃片,用玻璃棒蘸取浓盐酸,开启玻璃片放在瓶口上方 生成白烟 SO2 在洁净试管里加入5 mL品红溶液,再通入待检气体,再加热待颜色变化后 品红溶液褪色,加热后又恢复红色 CO2 闻气味,并将其通入澄清石灰水中 无色无味,石灰水变浑浊,继续通入后变澄清 Cl2 用湿润的KI-淀粉试纸靠近集气瓶口 变蓝 Br2 (蒸气) ①观察气体颜色,并用湿润的淀粉-KI试纸检验 红棕色气体,能够使湿润的淀粉-KI试纸变蓝色 ②观察气体颜色,并把该气体通入水中,再观察溶液的颜色 红棕色气体,其水溶液呈橙色 NO2 观察气体颜色,溶于水再观察溶液的颜色,并用蓝色的石蕊试纸检验 红棕色气体,其水溶液呈无色,能使湿润的蓝色石蕊试纸显红色 NO 观察气体颜色,并与空气混合 无色气体遇空气变为红棕色 3.将气体通入澄清石灰水中,若石灰水先变浑浊,后又变澄清,能否判断该气体一定是CO2? 提示:不能。若气体是SO2,也有相同的现象发生。若该气体无色无味,则可以判断是CO2。 题组一 气体的制备与收集 1.(2018·株洲检测)以下气体发生装置中,不易控制反应产生气体的量的是( ) 解析:选B A项可通过控制加入液体的量来控制产生气体的量;C、D两项中装置类似于启普发生器,可通过活塞的开关调节反应器的压强,控制反应与否,来控制产生气体的量。 2.用下列装置制取并收集NO2气体,其中最合理的是( ) 答案:C 3.(1)如图是实验室制取某些气体的装置。 ①该制气装置在加入反应物前,应事先进行的操作是________。 ②若用该装置制取O2,反应物除了可选择二氧化锰和________(填试剂名称)外,还能选择________(填试剂化学式)和水。 ③利用该装置还可制取________(填字母)等气体。 a.H2 b.CO2 c.NH3 d.SO2 (2)此装置中加入漂白粉和浓盐酸也可以制取Cl2。 ①写出该反应的离子方程式: ________________________________________________________________________ ________________________________________________________________________。 ②若使用在空气中放置的漂白粉和浓盐酸发生反应,则制取的Cl2中可能含有的杂质为 ________________________________________________________________________。 解析:(1)制备气体的装置在加入反应物之前均应先检查装置的气密性。该装置所制气体应满足固体(液体)和液体不需加热制备气体。符合此条件的制备氧气的反应可为H2O2在MnO2作催化剂时分解,或Na2O2与H2O反应。该装置可制备的气体有H2、CO2、O2、NH3等。(2)ClO-、Cl-在酸性条件下发生反应生成Cl2。漂白粉在空气中放置会部分变为CaCO3,浓盐酸有很强的挥发性,因而制取的Cl2中常含有HCl、CO2和H2O(g)。 答案:(1)①检查装置气密性 ②双氧水(或过氧化氢) Na2O2 ③abcd (2)①ClO-+Cl-+2H+===Cl2↑+H2O ②HCl、CO2、H2O(g) 题组二 气体的干燥、除杂及尾气处理 4.(2018·濮阳测试)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( ) 选项 a中的物质 b中的物质 c中收集的气体 d中的物质 A 浓氨水 CaO NH3 H2O B 浓硫酸 Na2SO3 SO2 NaOH溶液 C 稀硝酸 Cu NO2 H2O D 浓盐酸 MnO2 Cl2 NaOH溶液 解析:选B 氨气的密度比空气小,应该用向下排空气收集,A错误;浓硫酸与Na2SO3发生复分解反应生成SO2,因SO2的密度比空气大,所以可用向上排空气法收集,SO2是大气污染物,要进行尾气处理,SO2很容易与NaOH溶液发生反应,用NaOH溶液吸收尾气时,为防止倒吸现象的发生,可以安装一个倒扣的漏斗,B正确;稀硝酸与Cu发生反应产生的气体是NO,不是NO2,且不能用水处理尾气,C错误;MnO2 与浓盐酸在加热时才能发生反应制取Cl2,该装置没有加热仪器,浓盐酸易挥发,C中收集的气体不纯净,应在b、c之间添加除去HCl气体的装置,D错误。 5.(2017·辽宁六校期末)如图为常用玻璃仪器组成的七种实验装置,根据需要可在其中加入液体或固体试剂。下列说法错误的是( ) A.A、B装置既能用于收集Cl2,又能用于收集NO B.装有浓硫酸的F装置可用于干燥CO2气体 C.C、E装置可用于尾气吸收,能防止液体倒吸到气体发生装置中 D.G装置可用于合成氨实验中,可干燥、混合并能大致观察H2和N2的体积比 答案:B 题组三 气体的检验 6.(2018·孝感市六校联考)如图装置可用于收集气体并验证某些化学性质,下列有关说法正确的是( ) 选项 气体 试剂 现象 结论 A NH3 酚酞试液 溶液变红色 NH3的水溶液显碱性 B Cl2 紫色石蕊试液 溶液先变红后褪色 Cl2有酸性和漂白性 C C2H4 溴水 溶液褪色 C2H4分子中含碳碳双键 D X KI淀粉溶液 溶液变蓝 X可能是Cl2或NO2 答案:D 7.(2017·东营期末)某种气体可能是由CO、CO2、H2、NH3、HCl和H2O(g)中的一种或几种组成,使其依次通过下列药品: ①澄清石灰水 ②Ba(OH)2溶液 ③浓H2SO4 ④灼热的CuO ⑤无水CuSO4粉末,结果观察到的实验现象是:①中未见浑浊,②中变浑浊,③中无明显现象,④中有红色物质产生,⑤中固体变蓝。若以上实验中,每一步反应都充分进行,则原混合气体中( ) A.一定有CO2和HCl,可能有H2 B.一定有H2、CO2和CO,可能有HCl C.一定有H2、CO2和HCl,可能有CO和H2O(g),肯定无NH3 D.一定有H2,一定没有CO 解析:选C 气体通过①②的现象说明气体中含有HCl和CO2,HCl和CO2在与碱反应时,强酸性气体HCl先与碱反应,气体中含HCl,一定不含NH3,气体通过③后,得到的气体一定是干燥的,此气体通过灼热的CuO,有红色物质产生说明气体中有CO或H2,而得到的气体再通过无水CuSO4粉末,固体变蓝,说明气体中含有H2,而CO和H2O(g)不能确定。 题组四 综合应用 8.(2017·全国卷Ⅰ,10)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( ) A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 解析:选B A错:若③中为焦性没食子酸溶液,则进入④中的气体还会有水蒸气。B对:若在④处收集气体点燃,发出“噗”声,则证明制取的氢气较纯,可以加热管式炉。C错:为了防止生成的W被氧化,反应结束时应先停止加热,待管式炉冷却后再关闭活塞K。D错:二氧化锰与浓盐酸反应制取氯气需要加热,而启普发生器不能加热。 9.(2017·江苏卷,4)下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( ) 解析:选B A错:铜片和稀硫酸不反应,无法制取SO2。B对:SO2能使品红溶液褪色,因此可以验证SO2的漂白性。C错:SO2密度比空气大,用排空气法收集SO2时,导气管应“长进短出”。D错:SO2和饱和NaHSO3溶液不反应,因此NaHSO3溶液不能作为吸收液,可用NaOH溶液。 10.(2016·全国卷Ⅰ,26)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题: (1)氨气的制备 ①氨气的发生装置可以选择上图中的________,反应的化学方程式为 ________________________________________________________________________。 ②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→__________(按气流方向,用小写字母表示)。 (2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。 操作步骤 实验现象 解释原因 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 ①Y管中________ ②反应的化学方程式________ 将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝聚 打开K2 ③________ ④________ 解析:(1)①在实验室通常是用加热氯化铵和消石灰固体混合物制取氨气,应选用发生装置A,其反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑,或选用发生装置B,直接加热浓氨水生成氨气:NH3·H2ONH3↑+H2O;②氨气是碱性气体,可用碱石灰干燥,密度小于空气,应采用向下排空气法收集,氨气极易溶于水,尾气处理时应防止倒吸,则要收集一瓶干燥的氨气,仪器的连接顺序为:发生装置→d、c→f、e→i。 (2)打开K1,推动注射器活塞将氨气缓慢通入Y管中,在一定温度和催化剂的作用下发生反应:6NO2+8NH3催化剂,7N2+12H2O,随着反应的发生Y管中红棕色气体颜色变浅;反应生成的水蒸气液化后,NO2和NH3反应后气体的物质的量减小,反应容器中的压强减小,打开K2,Z中的溶液倒吸入Y管中。 答案:(1)①A 2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑(或B NH3·H2ONH3↑+H2O) ②dcfei(2)红棕色气体慢慢变浅 6NO2+8NH37N2+12H2O Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,Y管中压强小于外压查看更多