- 2021-07-02 发布 |
- 37.5 KB |
- 72页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习常见的金属元素及其化合物课件(72张)(全国通用)
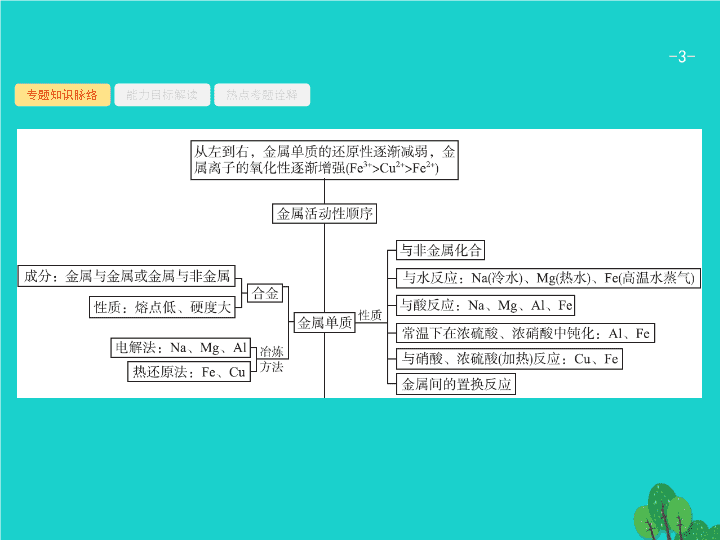
专题二 常见的无机物及其应用 第 1 讲 常见的金属元素及其化合物 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 - 5 - 专题知识脉络 能力目标解读 热点考题诠释 - 6 - 专题知识脉络 能力目标解读 热点考题诠释 - 7 - 专题知识脉络 能力目标解读 热点考题诠释 - 8 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 1 .(2016 全国甲 ) 某白色粉末由两种物质组成 , 为鉴别其成分进行如下实验 : ① 取少量样品加入足量水仍有部分固体未溶解 ; 再加入足量稀盐酸 , 有气泡产生 , 固体全部溶解 ; ② 取少量样品加入足量稀硫酸有气泡产生 , 振荡后仍有固体存在。 该白色粉末可能为 ( ) A.NaHCO 3 、 Al(OH) 3 B.AgCl 、 NaHCO 3 C.Na 2 SO 3 、 BaCO 3 D.Na 2 CO 3 、 CuSO 4 答案 解析 解析 关闭 本题的解题关键在于熟悉各物质的水溶性及相应反应规律。 NaHCO 3 可溶 ,Al(OH) 3 不溶 , 加足量稀盐酸时 ,NaHCO 3 与盐酸反应放出 CO 2 气体 , 而 Al(OH) 3 完全溶解。向样品中加入足量稀硫酸时 , 有气泡产生 , 且固体全部溶解 , 不符合实验② ,A 项不符合题意。 AgCl 不溶于盐酸 , 不符合实验① ,B 项不符合题意。 C 项中两物质符合实验①现象 , 加入足量水后有固体物质 (BaCO 3 不溶 ), 再加入稀盐酸 , 产生 SO 2 、 CO 2 气体 , 固体全部溶解 ; 也符合实验②现象 , 加入足量稀硫酸产生 SO 2 、 CO 2 气体 , 并生成 BaSO 4 沉淀 ,C 项符合题意。 D 项中两物质符合实验①现象 , 加入足量水后的固体物质为 CuCO 3 , 再加入稀盐酸 , 产生 CO 2 气体 , 固体全部溶解 ; 但不符合实验②的现象 , 振荡后无固体存在 ,D 项不符合题意。 答案 解析 关闭 C - 9 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 2 .(2015 全国课标 Ⅰ ) 下列实验中 , 对应的现象以及结论都正确且两者具有因果关系的是 ( ) - 10 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 答案 解析 解析 关闭 A 选项 , 稀硝酸与过量的 Fe 充分反应产物为硝酸亚铁、 NO 和水 , 所以加入 KSCN 溶液后 , 溶液不变血红色 , 现象和结论错误 ;B 选项 ,Cu 与硫酸铁发生氧化还原反应 , 生成硫酸铜和硫酸亚铁 , 无黑色固体出现 , 现象和结论错误 ;C 选项 , 铝在空气中加热 , 表面生成的氧化铝熔点较高 , 所以内部熔化的铝不会滴落 , 现象错误 ;D 选项 , 硫酸镁与氢氧化钠溶液反应生成氢氧化镁沉淀 , 再加入硫酸铜溶液 , 则生成氢氧化铜蓝色沉淀 , 符合溶解度较小的沉淀向溶解度更小的沉淀转化 , 又二者均为 AB 2 型化合物 , 所以相同温度下氢氧化铜的溶度积比氢氧化镁的溶度积小 , 现象和结论都正确。 答案 解析 关闭 D - 11 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 3 .(2016 全国甲 ) 某班同学用如下实验探究 Fe 2+ 、 Fe 3+ 的性质。回答下列问题 : (1) 分别取一定量氯化铁、氯化亚铁固体 , 均配制成 0.1 mol·L -1 的溶液。在 FeCl 2 溶液中需加入少量铁屑 , 其目的是 。 (2) 甲组同学取 2 mL FeCl 2 溶液 , 加入几滴氯水 , 再加入 1 滴 KSCN 溶液 , 溶液变红 , 说明 Cl 2 可将 Fe 2+ 氧化。 FeCl 2 溶液与氯水反应的离子方程式为 。 (3) 乙组同学认为甲组的实验不够严谨 , 该组同学在 2 mL FeCl 2 溶液中先加入 0.5 mL 煤油 , 再于液面下依次加入几滴氯水和 1 滴 KSCN 溶液 , 溶液变红 , 煤油的作用是 。 - 12 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 (4) 丙组同学取 10 mL 0.1 mol·L -1 KI 溶液 , 加入 6 mL 0.1 mol·L -1 FeCl 3 溶液混合。分别取 2 mL 此溶液于 3 支试管中进行如下实验 : ① 第一支试管中加入 1 mL CCl 4 充分振荡、静置 ,CCl 4 层显紫色 ; ② 第二支试管中加入 1 滴 K 3 [Fe(CN) 6 ] 溶液 , 生成蓝色沉淀 ; ③ 第三支试管中加入 1 滴 KSCN 溶液 , 溶液变红。 实验 ② 检验的离子是 ( 填离子符号 ); 实验 ① 和 ③ 说明 : 在 I - 过量的情况下 , 溶液中仍含有 ( 填离子符号 ), 由此可以证明该氧化还原反应为 。 (5) 丁组同学向盛有 H 2 O 2 溶液的试管中加入几滴酸化的 FeCl 2 溶液 , 溶液变成棕黄色 , 发生反应的离子方程式为 ; 一段时间后 , 溶液中有气泡出现 , 并放热 , 随后有红褐色沉淀生成。产生气泡的原因是 ; 生成沉淀的原因是 ( 用平衡移动原理解释 ) 。 - 13 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 - 14 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 - 15 - 热点一 热点二 热点三 热点四 金属单质的性质及冶炼 有关金属单质性质及冶炼思维路径 - 16 - 热点一 热点二 热点三 热点四 问题探究 金属单质及其化合物有怎样的相似性和递变性 ? - 17 - 热点一 热点二 热点三 热点四 - 18 - 热点一 热点二 热点三 热点四 - 19 - 热点一 热点二 热点三 热点四 - 20 - 热点一 热点二 热点三 热点四 我们除了应用上述金属活动性顺序进行记忆外 , 还要注意特性 , 如 Al 既能与酸反应 , 也能与碱反应 ;Fe 、 Al 在冷浓硫酸或冷浓硝酸的条件下钝化 ; 活泼性很强的金属 ( 如钠、钾 ) 不能把活泼性弱的金属从其盐溶液中置换出来。 - 21 - 热点一 热点二 热点三 热点四 例 1 (1) 为测定镀层厚度 , 用 NaOH 溶液溶解钢制品表面的铝镀层 , 当反应转移 6 mol 电子时 , 所得还原产物的物质的量为 mol 。 (2) 用铝粉和 Fe 2 O 3 做铝热反应实验 , 需要的试剂还有 。 a.KCl b.KClO 3 c.MnO 2 d.Mg 取少量铝热反应所得的固体混合物 , 将其溶于足量稀硫酸 , 滴加 KSCN 溶液无明显现象 , ( 填 “ 能 ” 或 “ 不能 ”) 说明固体混合物中无 Fe 2 O 3 , 理由是 ( 用离子方程式说明 ) 。 - 22 - 热点一 热点二 热点三 热点四 分析推理 (1) 解决电子转移数量的关键点。 当要求计算转移电子数时 , 首先应想到得失电子守恒 , 解决本题的关键是由化学方程式 2Al+2NaOH+2H 2 O 2NaAlO 2 +3H 2 ↑ 判断还原产物为 H 2 , 每转移 6 mol 电子生成 3 mol H 2 。 (2) 实验用品的记忆。 要由实验操作及原理记忆实验用品 , 如铝热反应实验中 , 用镁条及氯酸钾引发反应。 (3) 解答与铁有关试题的关键点。 有关铁的试题 , 一定要注意铁为变价金属 ; 滴加 KSCN 溶液无明显现象 , 说明溶液中无 Fe 3+ , 但是 , 固体溶于足量稀硫酸 , 由于 Fe 2 O 3 与 H 2 SO 4 反应生成 Fe 2 (SO 4 ) 3 , 生成的 Fe 2 (SO 4 ) 3 能与 Fe 反应生成 FeSO 4 , 所以不能说明固体中无 Fe 2 O 3 。 - 23 - 热点一 热点二 热点三 热点四 - 24 - 热点一 热点二 热点三 热点四 题后反思 (1) 铝与氢氧化钠溶液反应电子转移情况的分析 : (2) 按题目要求答题是关键。将 “b 、 d” 答成 “B 、 D” 丢分 ; 将 “ 不能 ” 写成 “ 不 ” 、 “ 否 ” 而丢分。要求写离子方程式而许多同学写成了化学方程式而丢分。 - 25 - 热点一 热点二 热点三 热点四 对点训练 1 下列叙述中正确的是 。 ① 铜具有良好的导电性 , 常用来制作印刷电路板 , 但在潮湿空气中长期保存 , 表面会有铜绿生成 ② 称取等质量的两份铝粉 , 分别加入过量的稀盐酸和过量的 NaOH 溶液 , 充分反应后 , 放出氢气的体积 ( 同温同压下 ) 相等 ③ 向 FeCl 3 溶液中加入过量铁粉 , 溶液由棕黄色变为浅绿色 ④ 铝合金的大量使用 , 归功于人们能使用焦炭等还原剂从氧化铝中获得铝 ⑤ Na 可以把硫酸铜溶液中的 Cu 置换出来 ⑥ 铝箔在空气中受热可以熔化 , 由于氧化膜的存在 , 熔化的铝并不会滴落 - 26 - 热点一 热点二 热点三 热点四 ⑦ 镁条在空气中燃烧生成的氧化物是 MgO , 可知钠在空气中燃烧生成的氧化物是 Na 2 O ⑧ 钠在空气中燃烧 , 发出黄色的火焰 , 生成淡黄色固体 ⑨ 目前我国流通的硬币是由合金材料制成的 ⑩ 铁不与水反应 , 所以铁锅可以烧水做饭 答案 解析 解析 关闭 答案 解析 关闭 - 27 - 热点一 热点二 热点三 热点四 常见金属氧化物及氢氧化物 有关金属氧化性及氢氧化物解题思维路径 - 28 - 热点一 热点二 热点三 热点四 问题探究 1 . 金属氧化物及氢氧化物有哪些特殊的物理性质 ? Na 2 O( 白色 ) 、 Na 2 O 2 ( 淡黄色 ) 、 MgO ( 白色粉末、熔点高 ) 、 Al 2 O 3 ( 白色、熔点高 ) 、 Fe 2 O 3 ( 红棕色 ) 、 FeO ( 黑色 ) 、 Fe 3 O 4 ( 黑色、具有磁性 ) 、 CuO ( 黑色 ) 、 Cu(OH) 2 ( 蓝色 ) 、 Fe(OH) 2 ( 白色 ) 、 Fe(OH) 3 ( 红褐色 ) 、 Cu 2 (OH) 2 CO 3 ( 绿色 ) 。 - 29 - 热点一 热点二 热点三 热点四 - 30 - 热点一 热点二 热点三 热点四 碱的稳定性 , 四大强碱 [ NaOH 、 KOH 、 Ba(OH) 2 、 Ca(OH) 2 ] 均溶于水 , 受热均不易分解 , 对应的氧化物 (Na 2 O 、 Na 2 O 2 、 K 2 O 、 BaO 、 CaO ) 也与水剧烈反应 , 生成碱 ; 其他金属氢氧化物一般不溶于水、受热分解 , 对应的氧化物也不与水反应 , 如 Cu(OH) 2 、 Mg(OH) 2 、 Fe(OH) 3 、 Al(OH) 3 等。 - 31 - 热点一 热点二 热点三 热点四 (2) 特性 : ① 金属氧化物 :Na 2 O 2 阴、阳离子个数比 1 ∶ 2, 可分别与 H 2 O 、 CO 2 反应生成 O 2 , 可做供氧剂、漂白剂 ;Al 2 O 3 与强碱反应生成偏铝酸盐 ; FeO 、 Fe 3 O 4 与强氧化性酸反应被氧化生成 Fe 3+ ,Fe 2 O 3 与强还原性酸反应被还原生成 Fe 2+ ,FeO 、 Fe 3 O 4 、 Fe 2 O 3 、 CuO 均能被 C 、 CO 、 H 2 、 Al 等还原剂还原 ,Cu 2 O 遇 H + 转化为 Cu 和 Cu 2+ 。 ② 碱 :Al(OH) 3 既能与酸反应 , 又能与强碱反应 ;Fe(OH) 2 极易被氧化 , 在空气中由白色沉淀迅速变成灰绿色 , 最后变成红褐色。 (3) 类别 : Na 2 O 2 、 Al 2 O 3 、 Fe 3 O 4 均不属于碱性氧化物 ,Al 2 O 3 属于两性氧化物。 - 32 - 热点一 热点二 热点三 热点四 例 2 某混合物 X 由 Cu 、 SiO 2 、 Al 2 O 3 、 Fe 2 O 3 中的一种或几种物质组成。进行如下实验。 请回答下列问题 : (1) 经 Ⅰ 得到蓝色溶液 , 该过程中一定发生的化学反应是 ( 用离子方程式表示 ) 、 。 (2)X 中一定含有的物质是 。反应 Ⅱ 的化学方程式是 。 - 33 - 热点一 热点二 热点三 热点四 (3) 为进一步确定上述混合物 X 的成分 , 另取 9.08 g X 进行如下实验。 ① 加入足量的 NaOH 溶液 , 过滤 , 将滤渣在氮气气流中干燥得固体 m g 。 ② 向滤渣中加入过量盐酸 , 过滤 , 将滤渣在氮气气流中干燥得固体 n g 。 上述 ①② 由于缺少 步骤 ( 填操作名称 ), 使得测定的质量 m 、 n 均 ( 填 “ 偏高 ”“ 偏低 ” 或 “ 不变 ”) 。 ③ 按正确步骤重新进行实验后得到 m =6.08 g 、 n =1.6 g 。计算原混合物中各成分的质量之比是 。 ( 不必化简 ) - 34 - 热点一 热点二 热点三 热点四 分析推理 (1) 蓝色溶液中一定含有 Cu 2+ ,X 中的 Cu 不与盐酸反应 , 那么 Cu 2+ 怎么得来的 ? 首先分析 X 物质中哪些与盐酸反应及反应产物 :Fe 2 O 3 、 Al 2 O 3 分别与盐酸反应生成 Fe 3+ 、 Al 3+ ,Cu 、 SiO 2 不与盐酸反应 ;Fe 3+ 把 Cu 氧化为 Cu 2+ , 所以蓝色溶液中一定含有 Cu 2+ 、 Fe 2+ , 可能含有 Al 3+ 。 (2) 怎样处理题中所给数据 ? 因为 SiO 2 完全溶于过量的 NaOH 溶液 , 所以 1.6 g 固体 C 为 Cu,B 中含有 4.6 g-1.6 g=3.0 g SiO 2 ; 固体 B 中含有 Cu 单质 , 所以蓝色溶液中一定无 Fe 3+ 。 第 (3) 小题 ① 加入过量 NaOH 溶液后的滤渣为 Cu 和 Fe 2 O 3 , 质量为 6.08 g, 质量减轻 3.0 g 是 SiO 2 的质量 , 所以 X 中无 Al 2 O 3 。 - 35 - 热点一 热点二 热点三 热点四 - 36 - 热点一 热点二 热点三 热点四 评分细则警示 (1) 不是书写离子方程式、未配平或任一物质的符号书写错误不给分 ;(2) 写物质化学式或名称均正确 ; 书写离子方程式错误。 - 37 - 热点一 热点二 热点三 热点四 对点训练 2 下列说法中正确的是 。 ① Al(OH) 3 能与 NaOH 溶液反应 , 则 Al(OH) 3 也能与氨水反应 ② 过氧化钠能与二氧化碳反应产生氧气 , 可用作高空飞行或潜水的供氧剂 ③ Fe(OH) 3 溶于氢碘酸的离子方程式为 Fe(OH) 3 +3H + Fe 3+ +3H 2 O ④ 等质量的 NaHCO 3 和 Na 2 CO 3 分别与足量盐酸反应 , 在同温同压下 , 生成的 CO 2 体积相同 ⑤ Fe 2 O 3 难溶于水 , 所以 Fe(OH) 3 不能通过化合反应直接制得 ⑥ Al 、 Fe 、 Cu 三者对应的氧化物均为碱性氧化物 ⑦ 将 Na 2 O 2 投入 NH 4 Cl 溶液中只可能生成一种气体 - 38 - 热点一 热点二 热点三 热点四 ⑧ 因为 Al 和 Al 2 O 3 既可以与酸反应又可以与碱反应 , 所以最好不要用铝制炊具盛放酸性或碱性较强的液体食物 ⑨ Na 2 O 和 Na 2 O 2 组成元素相同 , 化学性质也相同 ⑩ NaOH 溶液和 AlCl 3 溶液相互滴加的现象不同 答案 解析 解析 关闭 答案 解析 关闭 - 39 - 热点一 热点二 热点三 热点四 金属阳离子的检验 有关物质检验的思维路径 - 40 - 热点一 热点二 热点三 热点四 问题探究 1 . 如何鉴别常见金属阳离子 ? - 41 - 热点一 热点二 热点三 热点四 注意 : 阳离子的检验除了一些特殊的方法外 , 我们一般用 NaOH 溶液即可鉴别。 - 42 - 热点一 热点二 热点三 热点四 2 . 物质检验时对实验操作和化学反应有哪些要求 ? (1) 当试样是固体时 , 一般需要先将少量试样配成溶液 , 观察溶解后溶液的颜色 , 在溶解过程中有无气体产生、有无沉淀生成以及沉淀的颜色等。 (2) 反应要有明显的外部特征。如溶液颜色的改变、沉淀的生成或溶解、气体的产生等。 (3) 反应要在适宜的条件下进行。如溶液的酸碱性、浓度、温度的选择。 (4) 检验时常需排除其他离子的干扰。如用 检验 Ba 2+ , 应排除 Ca 2+ 、 Ag + 等离子的干扰。 (5) 检验反应要求具有一定的选择性和特效性。如品红溶液检验 SO 2 ,KSCN 溶液检验 Fe 3+ , 湿润的红色石蕊试纸检验 NH 3 。 - 43 - 热点一 热点二 热点三 热点四 例 3 (2015 浙江联考 ) 已知某溶液中含有下列 8 种离子中的 5 种 ( 忽略水的电离及离子的水解 ):K + 、 Cu 2+ 、 Al 3+ 、 Fe 2+ 、 Cl - 、 , 且 5 种离子的物质的量浓度相等。为了进一步探究该水溶液的组成 , 某同学进行了如下实验 : ① 用铂丝蘸取少量溶液 , 在火焰上灼烧 , 透过蓝色钴玻璃观察无紫色火焰 ② 另取溶液加入足量盐酸 , 有无色气体产生 , 该无色气体遇空气变红棕色 ③ 另取溶液加入 BaCl 2 溶液 , 有白色沉淀生成。 - 44 - 热点一 热点二 热点三 热点四 - 45 - 热点一 热点二 热点三 热点四 - 46 - 热点一 热点二 热点三 热点四 - 47 - 热点一 热点二 热点三 热点四 题后反思 ① 掌握离子的性质 , 特别是哪些离子之间不能共存。不知 Fe 2+ 与 不能大量共存 , 无法排除 D 项干扰。 ② 利用溶液中电荷守恒计算判断存在的离子是解题的关键 , 不能正确书写电荷守恒无法对 Cu 2+ 、 Al 3+ 、 Cl - 作出判断。 - 48 - 热点一 热点二 热点三 热点四 对点训练 3 (2015 成都七中检测 ) 现有一瓶标签上注明为葡萄糖酸盐 ( 钠、镁、钙、铁 ) 的复合制剂 , 某同学为了确认其成分 , 取部分制剂作为试液 , 设计并完成了如下实验 : - 49 - 热点一 热点二 热点三 热点四 已知 : 控制溶液 pH=4 时 ,Fe(OH) 3 沉淀完全 ,Ca 2+ 、 Mg 2+ 不沉淀。 该同学得出的结论正确的是 ( ) A. 根据现象 1 可推出该试液中含有 Na + B. 根据现象 2 可推出该试液中并不含有葡萄糖酸根 C. 根据现象 3 和 4 可推出该试液中含有 Ca 2+ , 但没有 Mg 2+ D. 根据现象 5 推出该溶液中一定含有 Fe 2+ 答案 解析 解析 关闭 答案 解析 关闭 - 50 - 热点一 热点二 热点三 热点四 无机化学工艺流程 有关无机化学工艺流程的思维路径 - 51 - 热点一 热点二 热点三 热点四 问题探究 1 . 如何对原料进行预处理 ? (1) 研磨 : 减小固体的颗粒 , 增大固体与液体或气体间的接触面积 , 加快反应速率。 (2) 水浸 : 与水接触反应或溶解。 (3) 酸 ( 碱 ) 浸 : 与酸 ( 碱 ) 接触反应或溶解 , 使可溶性金属离子进入溶液 , 不溶物通过过滤除去。 (4) 灼烧 : 除去可燃性杂质或使原料初步转化 , 如从海带中提取碘时的灼烧就是为了除去可燃性杂质。 (5) 煅烧 : 改变结构 , 使一些物质溶解 , 并使一些杂质在高温下氧化、分解 , 如煅烧高岭土。 - 52 - 热点一 热点二 热点三 热点四 2 . 如何理解流程题中表述性词语的作用 ? (1) 控制较低温度 : 应联想到物质的挥发、物质的不稳定性和物质的转化等。 (2) 加过量试剂 : 应联想到反应完全或增大转化率、产率等。 (3) 能否加其他物质 : 应联想到会不会引入杂质或是否影响产品的纯度。 (4) 在空气中或在其他气体中反应 : 应联想到 O 2 、 H 2 O 、 CO 2 或其他气体是否参与反应或是否要达到防氧化、防水解、防潮解等目的。 (5) 检验某物质的设计方案 : 通常取少量待检液于试管中 , 加入一种试剂产生某现象 , 然后得出结论。 (6) 用某些有机试剂清洗 : 应联想到降低物质的溶解度 , 有利于析出、减少损耗或提高利用率。 - 53 - 热点一 热点二 热点三 热点四 例 4 (2014 广东理综 ) 石墨在材料领域有重要应用。某初级石墨中含 SiO 2 (7.8%),Al 2 O 3 (5.1%),Fe 2 O 3 (3.1%) 和 MgO (0.5%) 等杂质。设计的提纯与综合利用工艺如下 : - 54 - 热点一 热点二 热点三 热点四 (1) 向反应器中通入 Cl 2 前 , 需通一段时间 N 2 , 主要目的是 。 (2) 高温反应后 , 石墨中氧化物杂质均转变为相应的氯化物 , 气体 Ⅰ 中的碳氧化物主要为 。由气体 Ⅱ 中某物质得到水玻璃的化学方程式为 。 (3) 步骤 ① 为 : 搅拌、 , 所得溶液 Ⅳ 中的阴离子有 。 (4) 由溶液 Ⅳ 生成沉淀 Ⅴ 的总反应的离子方程式为 。 100 kg 初级石墨最多可获得 Ⅴ 的质量为 kg 。 (5) 石墨可用于自然水体中铜件的电化学防腐。完成如图防腐示意图 , 并作相应标注。 - 55 - 热点一 热点二 热点三 热点四 分析推理 (1) 怎样分析实验目的 ? 从两个方面分析 : ① 通入氮气的目的是排出空气 ; ② 分析反应器中的物质 —— 只有石墨与空气中的氧气反应。 (2) 什么时候碳生成 CO 、 CO 2 ? ① 与氧气完全燃烧、与氧化物反应不强调高温时 , 一般生成 CO 2 , 如碳还原氧化铜生成 CO 2 ; ② 与氧气不完全燃烧、与氧化物反应强调高温时 , 一般生成 CO, 如 SiO 2 与碳在高温下反应生成 CO 。 - 56 - 热点一 热点二 热点三 热点四 (3) 怎样判断化工流程中发生的化学反应 ? 首先在流程图上相应位置写出原料中含有物质的化学式、已知产物的化学式 , 然后分析各物质的去向 ; 由纯化石墨可知 , 气体 Ⅰ 中含有 Si 、 Al 、 Fe 、 Mg 等元素 , 通入 Cl 2 , 产物为气体 , 所以高沸点的 SiO 2 、 Al 2 O 3 、 Fe 2 O 3 、 MgO 与碳和氯气在高温下反应生成低沸点的 SiCl 4 、 AlCl 3 、 FeCl 3 、 MgCl 2 ; 结合题意气体 Ⅱ 中含有 SiCl 4 , 无 AlCl 3 、 FeCl 3 、 MgCl 2 ,SiCl 4 与 NaOH 溶液反应生成水玻璃 Na 2 SiO 3 , 同时还有 NaCl 生成 , 配平即可 ;AlCl 3 、 FeCl 3 、 MgCl 2 冷却后只能在固体 Ⅲ 中 , 加入过 - 57 - 热点一 热点二 热点三 热点四 - 58 - 热点一 热点二 热点三 热点四 (5) 怎样判断金属电化学防腐的方法 ? 金属电化学防腐常用两种方法 : ① 利用原电池原理的牺牲阳极保护法 , ② 利用电解原理的外加电源的阴极保护法 ; 此题中所给电极为石墨、铜 , 保护铜 , 所以只能利用电解原理进行防腐。 - 59 - 热点一 热点二 热点三 热点四 - 60 - 热点一 热点二 热点三 热点四 评分细则警示 (1) 一定要写出防止石墨被氧化或损失等意思 ;(2)CO 或一氧化碳均正确 ; 不是书写化学方程式、未配平或任一物质的符号书写错误不得分 ;(3) 写出名称或离子符号均正确 ;(4) 不是书写离子方程式、未配平或任一物质的符号书写错误不得分 ;(5) 电极不标明石墨、铜 , 正负极画反均错误。 - 61 - 热点一 热点二 热点三 热点四 对点训练 4 (2015 安徽淮北模拟 ) 锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备 GeO 2 , 其工艺流程图如下。 已知 :GeO 2 是两性氧化物 ;PbO 2 不溶于稀硫酸 ;GeCl 4 易水解 , 沸点 86.6 ℃ 。 - 62 - 热点一 热点二 热点三 热点四 (1) 第 ① 步滤渣主要成分有 ( 填化学式 ), 实验室萃取操作用到的玻璃仪器有 。 - 63 - 热点一 热点二 热点三 热点四 (3) 第 ④ 步加入盐酸的作用是 ( 答两点即可 ) 。 (4) 第 ⑤ 步反应的化学方程式是 。 (5) 检验 GeO 2 · n H 2 O 是否洗涤干净的操作是 。 (6)GeO 2 产品中通常混有少量 SiO 2 。取样品 5.4 g, 测得其中氧原子的物质的量为 0.105 mol , 则该样品中 GeO 2 的物质的量为 mol 。 - 64 - 热点一 热点二 热点三 热点四 答案 (1)SiO 2 、 PbO 2 分液漏斗、烧杯 (2)8 (3) 中和 NaOH , 作反应物 , 抑制 GeCl 4 水解 (4)GeCl 4 +( n +2)H 2 O GeO 2 · n H 2 O+4HCl (5) 取最后一次洗涤液于试管中 , 往其中加入 HNO 3 酸化的 AgNO 3 溶液 , 若不产生白色沉淀 , 则说明洗涤干净。若产生白色沉淀 , 则说明未洗涤干净 (6)0.050 - 65 - 热点一 热点二 热点三 热点四 - 66 - 热点一 热点二 热点三 热点四 - 67 - 1 2 3 4 1 .(2016 江西上饶模拟 ) 将 a g 铁和氧化铁的混合物加入 800 mL pH=1 的盐酸中充分反应后 , 固体无剩余 , 盐酸全部消耗 , 放出气体 0.224 L( 标准状况下 ) 。则下列判断中正确的是 ( ) A. 原混合物中 n (Fe) ∶ n (Fe 2 O 3 )=2 ∶ 1 B. 向溶液中滴入无色的 KSCN 溶液 , 显红色 C. 无法计算出原混合物的质量 D. 此时溶液中 Fe 2+ 和 Fe 3+ 的物质的量之比为 3 ∶ 1 答案 解析 解析 关闭 答案 解析 关闭 - 68 - 1 2 3 4 答案 解析 解析 关闭 答案 解析 关闭 - 69 - 1 2 3 4 3 . 下表中的实验事实和结论均正确的是 ( ) 答案 解析 解析 关闭 答案 解析 关闭 - 70 - 1 2 3 4 4 .(2016 安徽怀宁模拟 ) 铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体 (CuCl 2 ·2H 2 O), 为制取纯净的 CuCl 2 ·2H 2 O, 首先将其制成水溶液 , 然后按下图步骤进行提纯 : Cu 2+ 、 Fe 3+ 和 Fe 2+ 的氢氧化物开始沉淀和沉淀完全时的 pH 见下表 : - 71 - 1 2 3 4 请回答下列问题。 (1) 最适合作氧化剂 X 的是 。 A.K 2 Cr 2 O 7 B.NaClO C.H 2 O 2 D.KMnO 4 (2) 加入的物质 Y 是 。 A.CuO B.NaOH C.Cu 2 (OH) 2 CO 3 D.NH 3 (3) 由溶液 Ⅲ 获得 CuCl 2 ·2H 2 O, 需要经过 、 、过滤等操作。 (4) 测定溶液 Ⅰ 中 Fe 2+ 的浓度 , 可用 KMnO 4 标准溶液滴定 , 取用 KMnO 4 溶液应使用 ( 填 “ 酸式 ” 或 “ 碱式 ”) 滴定管 , 反应的离子方程式为 。 - 72 - 1 2 3 4查看更多