【化学】江苏省无锡市2020届高三上学期期中调研考试(解析版)
江苏省无锡市2020届高三上学期期中调研考试
可能用到的相对原子质量:H-1 C-12 N-14 O-16 K-39 Fe-56
Ⅰ卷 选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意
1.2019年4月22日是第50个“世界地球日”,我国确定的活动主题为“珍爱美丽地球,守护自然资源”。下列行为符合这一活动主题的是( )
A. 推进垃圾分类处理 B. 将秸秆就地焚烧
C. 加快开采化石燃料 D. 使用含磷洗涤剂
【答案】A
【详解】A. 推进垃圾分类处理,将垃圾有效利用,减少资源浪费,减少污染物的形成,A正确;
B. 将秸秆就地焚烧,产生的固体污染物会对大气、水资源等造成不良影响,B错误;
C.化石燃料是不可再生能源,加快开采化石燃料,会减少地球资源,同时产生大量污染物,C错误;
D. 使用含磷洗涤剂,会使水体富营养化,严重污染水资源,D错误。
故选A。
2.实验室可利用NH4++OH-NH3↑+H2O这一原理制氨气。下列表示反应中相关微粒的化学用语正确的是( )
A. 氧原子的结构示意图: B. 中子数为8的氮原子:87N
C. 氨分子的结构式: D. OH-的电子式:
【答案】C
【详解】A. 是氧离子的结构示意图,A错误;
B. 中子数为8的氮原子应表示为,B错误;
C. 氨分子的结构式为,C正确;
D. OH-的电子式为,D错误。
故选C。
3.下列有关物质的性质与用途不具有对应关系的是( )
A. 浓硫酸具有脱水性,可用作干燥剂
B. 氧化铝熔点高,可用作耐高温材料
C. 氢氧化铁胶体具有吸附性,可用于净水
D. 小苏打能与盐酸反应,可用于治疗胃酸过多
【答案】A
【详解】A. 浓硫酸用作干燥剂,表现的性质是吸水性,A错误;
B. 氧化铝熔点高,可用作耐高温材料,B正确;
C. 氢氧化铁胶体具有吸附性,可用于净水,C正确;
D. 小苏打能与盐酸反应,可用于治疗胃酸过多,D正确。
故选A。
【点睛】气体的干燥,晶体中结晶水的去除,都可利用浓硫酸,此时浓硫酸表现吸水性;从有机物中脱掉相当于水组成的H、O元素,浓硫酸表现脱水性;金属的钝化、浓硫酸与铜等不活泼金属的反应、浓硫酸与非金属单质等的反应,表现出强氧化性。
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L−1的FeCl2溶液中:H+、Na+、Cl-、NO3-
B. 0.1 mol·L−1的HCl溶液中:Na+、K+、SO42-、CH3COO-
C. 0.1 mol·L−1的K2CO3溶液中:Na+、Ca2+、AlO2-、OH-
D. 0.1 mol·L−1的NaOH溶液中:K+、Ba2+、Cl-、NO3-
【答案】D
【详解】A. H+、NO3-能将Fe2+氧化为Fe3+,离子间不能大量共存,A错误;
B. CH3COO-能与H+反应,生成弱电解质CH3COOH,离子间不能大量共存,B错误;
C. Ca2+与CO32-会发生反应生成CaCO3沉淀,离子间不能大量共存,C错误;
D. K+、Ba2+、Cl-、NO3-碱性环境中能稳定存在,离子间不反应,D正确。
故选D。
【点睛】简单来说,离子能共存,就是离子间不发生反应。离子反应包括离子间直接反应,生成沉淀、气体或弱电解质,也可以是离子间发生成分的互换反应,如HSO3-与CO32-
能发生反应,生成SO32-和HCO3-。离子间发生氧化还原反应,也不能大量共存。如在酸性条件下,NO3-能表现出强氧化性,与Fe2+、S2-、SO32-等不能大量共存。离子的颜色,也可能是命题人设置的限制条件。
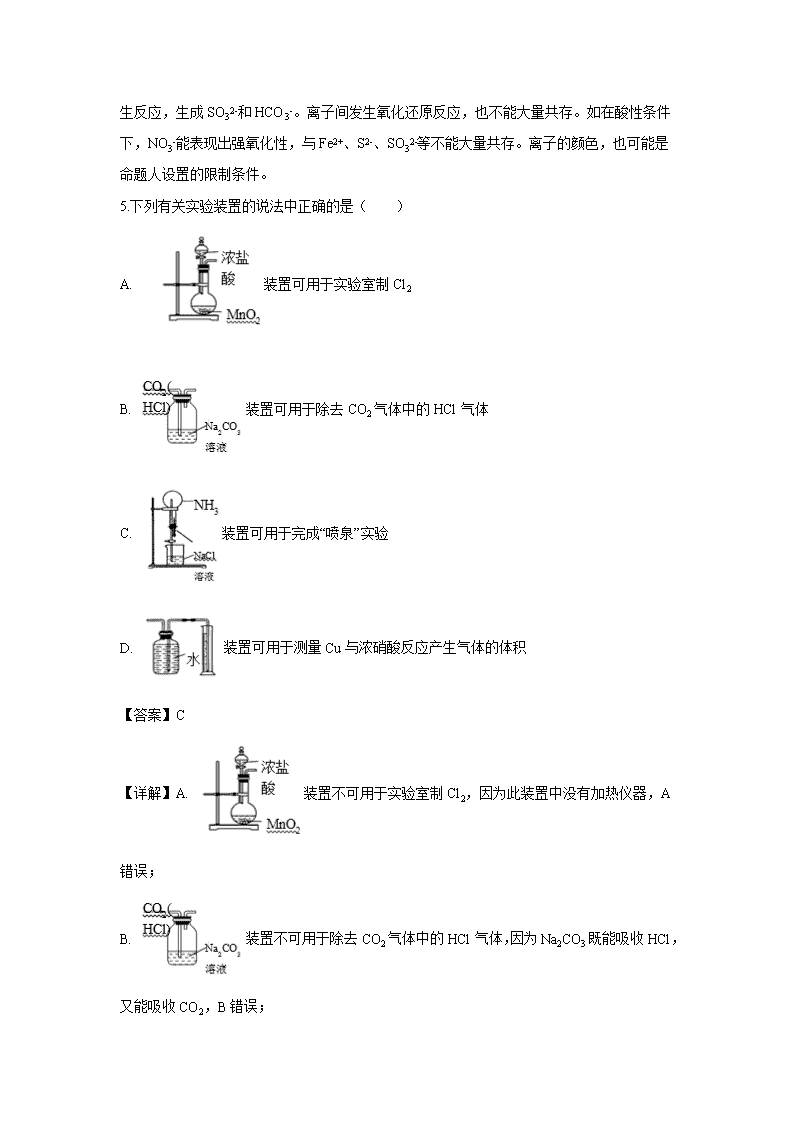
5.下列有关实验装置的说法中正确的是( )
A. 装置可用于实验室制Cl2
B. 装置可用于除去CO2气体中的HCl气体
C. 装置可用于完成“喷泉”实验
D. 装置可用于测量Cu与浓硝酸反应产生气体的体积
【答案】C
【详解】A. 装置不可用于实验室制Cl2,因为此装置中没有加热仪器,A错误;
B. 装置不可用于除去CO2气体中的HCl气体,因为Na2CO3既能吸收HCl,又能吸收CO2,B错误;
C. 虽然NaCl的存在不能为NH3在水中的溶解提供帮助,但NH3极易溶于水,此装置可完成NH3的“喷泉”实验,C正确;
D. Cu与浓硝酸反应产生气体为NO2,能与水反应,所以此装置不可用于测量Cu与浓硝酸反应产生的气体,D错误。
故选C。
6.下列叙述正确的是( )
A. 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质会发生变性
B. 不能用pH试纸测定新制氯水的pH值
C. 在蒸发皿中加热AlCl3溶液能得到无水AlCl3固体
D. 在海水中,为了防止船体腐蚀,在铁壳上镶嵌铜块
【答案】B
【详解】A. 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质会发生盐析而不是变性,A错误;
B. 因为氯水具有漂白性,它能使pH试纸先变红后褪色,所以不能用pH试纸测定新制氯水的pH,B正确;
C. 因为AlCl3是挥发性酸的弱碱盐,蒸干灼烧过程中会水解、分解,最终生成Al2O3,所以在蒸发皿中加热AlCl3溶液得不到无水AlCl3固体,C错误;
D. 在海水中,为了防止船体腐蚀,在铁壳上镶嵌锌块,若镶嵌铜块,将加速船体的腐蚀,D错误。
故选B。
【点睛】若想从挥发性酸的弱碱盐中获得该盐,可将溶液蒸发浓缩、冷却结晶、过滤,以获得带有结晶水的盐的晶体。然后在该盐对应酸的气流中加热,以去除结晶水,从而获得无水盐。
7.下列指定反应的离子方程式正确的是( )
A. 向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O= AlO2-+4NH4++2H2O
B. 向醋酸溶液中加入碳酸钙粉末:2H+ + CaCO3= Ca2+ + CO2↑+ H2O
C. 酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2= 2I2+2H2O
D. 向Ca(HCO3)2溶液中加入少量NaOH溶液:HCO3-+OH-=CO32-+H2O
【答案】C
【详解】A. 因为Al(OH)3不溶于氨水,所以,向氯化铝溶液中滴加过量氨水,最终产物为Al(OH)3和NH4+,A错误;
B. 因为醋酸是弱酸,所以不能拆成离子的形式,B错误;
C. 酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2= 2I2+2H2O,C正确;
D. 向Ca(HCO3)2溶液中加入少量NaOH溶液,生成的CO32-将与溶液中的Ca2+反应,生成CaCO3沉淀,D错误。
故选C。
【点睛】Al(OH)3虽然是两性氢氧化物,若要显碱性,能溶于强酸和弱酸中的醋酸、氢氟酸、磷酸等,但它不溶于更弱的酸(如碳酸);若要显酸性,能溶于强碱,但不能溶于弱碱(如氨水)。所以,在书写方程式时,遇到过量的情况,一定要清楚Al(OH)3是否会溶解。
8.短周期主族元素X、Y、Z、W原子序数依次增大,X、Y、Z三种原子的最外层电子数之和与W原子的最外层电子数相等,X的最低负价为-4。下列说法正确的是( )
A. 原子半径:r(Y)>r(Z)>r(W)
B. Y的最高价氧化物的水化物碱性比Z的弱
C. W的氧化物的水化物酸性一定比X的强
D. W与Z形成的化合物ZW2中既含有离子键又含有共价键
【答案】A
【分析】X的最低负价为-4,则其为碳;X、Y、Z三种原子的最外层电子数之和与W原子的最外层电子数相等,则Y、Z的最外层电子数之和为3,W的最外层电子数为7。从而得出X、Y、Z、W分别为C、Na、Mg、Cl。
【详解】A. 同周期元素,从左往右,原子半径依次减小,所以原子半径:r(Na)>r(Mg)>r(Cl),A正确;
B. 同周期元素,从左往右,金属性依次减弱,所以Na的最高价氧化物的水化物碱性比Mg的强,B错误;
C. 虽然Cl的非金属性比C强,但W的氧化物的水化物若为HClO,则酸性比H2CO3的弱,C错误;
D. W与Z形成的化合物MgCl2中,只含有离子键不含有共价键,D错误。
故选A。
【点睛】此题中有形的信息很少,我们只能推出X的最外层电子数为4,它可能是C,也可能是Si。所以我们需要使用周期表这个无形的信息。若X为Si,因为主族元素的最外层电子数不超过7,无法满足“X、Y、Z三种原子的最外层电子数之和与W原子的最外层电子数相等”这一限制条件,所以X只能是C。Y、Z不可能是同主族元素,也就是最外层电子数不可能都为1,但又必须满足二者的最外层电子数之不大于3(W的最外层电子最多为7),所以Y的最外层电子数为1,Z的最外层电子数为2,W的最外层电子数为7,从而确定Y、Z、W分别为Na、Mg、Cl。
9.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq) Na(s) Na2O2(s)
B. SiO2(s) Si(s) SiCl4(l)
C. SO2(g) NH4HSO3(aq) (NH4)2SO4(aq)
D. Cu2(OH)2CO3(s) CuO(s) Cu(OH)2(s)
【答案】C
【详解】A. NaCl(aq) Na(s) Na2O2(s),电解熔融的氯化钠得到金属钠,前一转化不能实现,A错误;
B. SiO2(s) Si(s) SiCl4(l),硅与氯气高温下反应,后一转化不能实现,B错误;
C. SO2(g) NH4HSO3(aq) (NH4)2SO4(aq),两转化都能实现,C正确;
D. Cu2(OH)2CO3(s) CuO(s) Cu(OH)2(s),氧化铜不溶于水,与水不反应,后一转化不能实现,D错误。
故选C。
10.下列说法正确的是( )
A. 1 mol N2与4 mol H2混合充分反应,则反应中转移的电子数目为6 mol
B. 反应2Mg(s)+CO2(g)= C(s)+2MgO(s) 能自发进行,则该反应的ΔH>0
C. 向0.1 mol·L−1 CH3COONa溶液中加入少量水,溶液中减小
D. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol−1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L−1 的NaOH溶液混合,放出的热量大于57.3 kJ
【答案】D
【详解】A.因为N2与H2的反应为可逆反应,所以1 mol N2与4 mol H2混合充分反应,实际参加反应的N2物质的量小于1mol,则反应中转移的电子数目小于6 mol,A错误;
B. 反应2Mg(s)+CO2(g)= C(s)+2MgO(s)能自发进行,因为ΔS<0,所以该反应的ΔH<0,B错误;
C. 向0.1 mol·L−1 CH3COONa溶液中加入少量水,溶液中c(CH3COO-)、c(OH-)减小,c(H+)增大,增大,C错误;
D. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol−1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L−1 的NaOH溶液混合,因为浓硫酸溶解放热,放出的热量为溶解热与中和热之和,所以放出的热量大于57.3 kJ,D正确。
故选D。
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
11.一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1—)O2
【答案】D
【详解】A.放电时,O2与Li+在多孔碳电极处反应,说明电池内,Li+向多孔碳电极移动,因为阳离子移向正极,所以多孔碳电极为正极,A错误;
B.因为多孔碳电极为正极,外电路电子应该由锂电极流向多孔碳电极(由负极流向正极),B错误;
C.充电和放电时电池中离子的移动方向应该相反,放电时,Li+向多孔碳电极移动,充电时向锂电极移动,C错误;
D.根据图示和上述分析,电池的正极反应是O2与Li+得电子转化为Li2O2-X,电池的负极反应是单质Li失电子转化为Li+,所以总反应为:2Li + (1—)O2 = Li2O2-X,充电的反应与放电的反应相反,所以为Li2O2-X = 2Li +(1—)O2,选项D正确;
答案选D。
12.室温下进行下列实验,根据实验操作和现象所得出的结论正确的是 ( )
选项
实验操作和现象
结论
A
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
气体X一定具有强氧化性
B
某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,再滴加AgNO3溶液,有白色沉淀生成
溶液中一定含有Cl-
C
向Na2CO3溶液中加入盐酸,将产生的气体直接通入硅酸钠溶液中,产生白色胶状沉淀
酸性:盐酸>碳酸>硅酸
D
向盛有5 mL 0.1 mol·L−1AgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液,有黄色沉淀产生
Ksp(AgCl) >Ksp(AgI)
【答案】B
【详解】A. 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀, 气体X可能具有强氧化性,也可能具有碱性,A错误;
B.某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,说明溶液中不含有SO42-、SO32-;再滴加AgNO3溶液,有白色沉淀生成,溶液中一定含有Cl-,B正确;
C.向Na2CO3溶液中加入盐酸,将产生的气体CO2直接通入硅酸钠溶液中,产生白色胶状沉淀,因为没有去除CO2气体中混有的HCl,所以不能肯定是CO2与硅酸钠溶液的反应,也就不能得出结论“酸性:盐酸>碳酸>硅酸”,C错误;
D.向盛有5 mL 0.1 mol·L−1AgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液,有黄色沉淀产生,不能肯定I-是与AgCl发生的反应,也就不能得出结论“Ksp(AgCl) >Ksp(AgI)”,D错误。
故选B。
13.下列图示与对应的叙述相符的是( )
A. 表示在相同的密闭容器中,反应A(g)+B(g) 2C(g)在一定温度下C的体积分数随时间的变化情况,则该反应的ΔH>0
B. 表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1HX溶液的滴定曲线,则HX可能为醋酸
C. 表示A、B两物质的溶解度随温度变化情况,将T1 ℃时A、B的饱和溶液分别升温至T2 ℃,则溶质的质量分数:w(A)>w(B)
D. 表示25 ℃时,分别加水稀释体积均为100 mL pH=2的CH3COOH溶液和HX溶液,则25 ℃时电离平衡常数:Ka(HX)
T1;温度低,C的体积分数大,说明降温平衡正向移动,正反应为放热反应,则该反应的ΔH<0,A错误。
B. 从图中可以看出,当滴加的NaOH体积为20mL时,溶液的pH=7,而此时,NaOH与HX刚好完全反应,所以HX应为一元强酸,可能为盐酸或硝酸,但不可能为醋酸,B错误;
C. 从溶解度曲线看,A、B的溶解度随温度的升高而增大,所以将T1 ℃时A、B的饱和溶液分别升温至T2 ℃,不会有晶体析出,溶质的质量分数保持不变,w(A)=w(B),C错误;
D. 从曲线中可以看出,加水稀释相同倍数时,醋酸溶液的pH大,则其c(H+)小,说明相同浓度时,醋酸的电离程度大,从而说明25 ℃时电离平衡常数:Ka(HX) c(CH3COO-) > c(H+)>c(OH-)
B. pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C. 0.1 mol·L−1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D. 0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
【答案】BD
【详解】A. 0.1 mol·L−1 CH3COOH溶液中,电离方程式为:CH3COOHCH3COO-+H+、H2OH++OH-,溶液中的H+有两个来源,显然,c(H+)> c(CH3COO-),A错误;
B. CH3COOH和CH3COONa混合溶液,pH=8,说明以CH3COO-的水解为主,溶液中发生的反应为:CH3COO-+H2OCH3COOH+OH-、H2OH++OH-,c(Na+)﹣c(CH3COO-) = c(OH-)- c(H+)=9.9×10-7 mol·L-1,B正确;
C. 0.1 mol·L−1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)=0.2mol·L-1,3c(CH3COO-)+3c(CH3COOH)=3(0.05mol·L−1+0.1 mol·L-1)=0.45mol·L-1,显然2c(Na+)≠ 3c(CH3COO-)+3c(CH3COOH),C错误;
D. 0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合,发生反应,所得溶液中c(CH3COOH)= 0.05mol·L−1,c(CH3COO-)= 0.05mol·L−1;反应后溶液中存在下列平衡:CH3COOHCH3COO-+H+、H2OH++OH-,c(CH3COO-)-(CH3COOH)= 2[c(H+)=c(OH-)],从而得出:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-),D正确;
故选BD。
15.T ℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是( )
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C. T ℃时,该反应的化学平衡常数K=0.025
D. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v正>v逆
【答案】CD
【详解】A.从图中提取如下信息:50 s时,n(PCl3)=0.16mol,c(PCl3)=0.08mol/L,v(PCl3)==0.0016mol·L-1·s-1,A错误;
B. PCl5(g) PCl3(g)+Cl2(g)
起始量 0.5mol/L 0 0
变化量 0.1mol/L 0.1mol/L 0.1mol/L
平衡量 0.4mol/L 0.1mol/L 0.1mol/L
α(PCl5)=;相同温度下,起始时向容器中充入1.0 mol PCl3和1.0 mol Cl2,达到平衡时,PCl3的转化率为80%。相同温度下,起始时向容器中充入1.0 mol PCl3和1.0 mol Cl2,则相当于原平衡体系加压,使气体体积变为原来的一半,平衡逆向移动,达到平衡时,PCl3的转化率大于80%,B错误;
C. T ℃时,该反应的化学平衡常数K==0.025,C正确;
D. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,浓度商Q==0.02<0.025,所以平衡正向移动,反应达到平衡前v正>v逆,D正确。
故选CD。
【点睛】对于一个可逆反应,达平衡时,反应物的转化率与生成物的产率之和为1;从反应物开始时反应的热效应,与从生成物开始时反应的热效应,二者的绝对值之和等于该反应的热效应的绝对值。
Ⅱ卷 非选择题(共80分)
16.煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为__________________________________。
②双碱法洗除SO2的优点为____________________________________________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
①Ⅰ中反应的化学方程式为______________________________________________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5
中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_____________________________。
【答案】(1). 2OH-+SO2=SO32-+H2O (2). 用CaO可使NaOH再生 (3). 减小 (4). 2 (5). Na2CO3+2SO2+H2O=2NaHSO3+CO2 (6). Na2SO3 (7). 得到NaHSO3过饱和溶液
【分析】(1)①SO2与NaOH反应,生成Na2SO3和H2O,据此写出离子方程式;
②双碱法洗除SO2的优点为CaO可使NaOH再生;
(2)①吸收剂溶液发生的反应为ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+,反应产生氢离子,所以溶液的pH逐渐减小;
②根据ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+和ClO-+SO2+H2O=Cl-+SO42-+2H+进行分析;
(3)①Ⅰ中,pH=4.1,说明反应生成酸性物质,只能为NaHSO3,据此条件写出化学方程式;
②若Ⅲ中通入SO2不足,则溶液为Na2SO3和NaHSO3的混合物,结晶脱水得到的Na2S2O5中混有的主要杂质是Na2SO3;
③通过题干信息可知“生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得”,据此进行分析。
【详解】(1)①SO2与NaOH反应,生成Na2SO3和H2O,反应的离子方程式为2OH-+SO2=SO32-+H2O;
答案为:2OH-+SO2=SO32-+H2O;
②双碱法洗除SO2的优点为CaO可使NaOH再生;
答案为:CaO可使NaOH再生;
(2)①随着吸收反应的进行,吸收剂溶液发生的反应为ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+,所以溶液的pH逐渐减小;
答案为:减小;
②如果采用NaClO替代NaClO2,反应的离子方程式为ClO-+SO2+H2O=Cl-+SO42-+2H+;根据ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+反应可知,吸收等量的SO2,所需NaClO的物质的量是NaClO2的2倍;
答案为:2;
(3)①Ⅰ中,pH=4.1,说明反应生成酸性物质,只能为NaHSO3,反应的化学方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2;
答案为:Na2CO3+2SO2+H2O=2NaHSO3+CO2 ;
②若Ⅲ中通入SO2不足,则溶液为Na2SO3和NaHSO3的混合物,结晶脱水得到的Na2S2O5中混有的主要杂质是Na2SO3;
答案为:Na2SO3;
③题干信息告诉我们“生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得”。工艺中加入Na2CO3固体,并再次充入SO2的目的,显然是为了最终获得NaHSO3过饱和溶液;
故答案为:得到NaHSO3过饱和溶液。
17.一水硫酸锰(MnSO4•H2O)是一种重要的化工中间体,工业上可由高铁菱锰矿(主要成分为MnCO3,含有FeCO3、Al2O3、MgO、CaO、SiO2等杂质)制备,部分工艺流程如下:
相关金属离子[c(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的 pH范围如下:
金属离子
Mn2+
Fe2+
Fe3+
Al3+
Mg2+
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
(1)“酸浸”时高铁菱锰矿需要粉碎,并进行充分搅拌,为提高锰的浸出率还可采取的措施有__________________________________。(写出其中一种)
(2)“氧化”时发生反应的化学方程式为___________________________________________。
(3)“调pH”范围至5~6,得到滤渣2的主要成分除MnO2外还有___________________。
(4)“除杂”过程中加入MnF2的目的是____________________________________________。已知:Ksp(MgF2)=5.16×10-11,Ksp(CaF2)=5.3×10-9。
(5)“沉锰”过程中发生反应的离子方程式为________________________________________。
(6)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4•H2O 晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4•H2
O晶体,洗涤、烘干。晶体烘干时温度不能过高的原因是_____________________________。
【答案】 (1). 升高温度或适当增大硫酸浓度 (2). 2FeSO4 + MnO2 + 2H2SO4= Fe2(SO4)3 + MnSO4 + 2H2O (3). Al(OH)3、Fe(OH)3 (4). 除去Ca2+ 和Mg2+ (5). Mn2+ + HCO + NH3•H2O = MnCO3↓ + NH4+ + H2O (6). 适量的稀硫酸 (7). 90℃ (8). 防止MnSO4•H2O失去结晶水
【详解】(1)“酸浸”时高铁菱锰矿需要粉碎,并进行充分搅拌,为提高锰浸出率,还可采取的措施有升高温度或适当增大硫酸浓度。答案为:升高温度或适当增大硫酸浓度
(2)“氧化”时,主要是利用MnO2将Fe2+氧化为Fe3+,发生反应的化学方程式为2FeSO4 + MnO2 + 2H2SO4= Fe2(SO4)3 + MnSO4 + 2H2O。
答案为:2FeSO4 + MnO2 + 2H2SO4= Fe2(SO4)3 + MnSO4 + 2H2O
(3)查表中数据知,“调pH”范围至5~6,可将Fe3+、Al3+转化为沉淀。得到滤渣2的主要成分除MnO2外还有Al(OH)3、Fe(OH)3。答案为:Al(OH)3、Fe(OH)3
(4)此时溶液中还存在Mg2+、Ca2+ 两种杂质离子,后续操作中没有除杂质的操作,所以“除杂”过程中加入MnF2的目的是除去Ca2+ 和Mg2+。答案为:除去Ca2+ 和Mg2+
(5)“沉锰”过程中,加入NH4HCO3和氨水,目的是将Mn2+转化为MnCO3沉淀,发生反应的离子方程式为Mn2+ + HCO + NH3•H2O = MnCO3↓ + NH4+ + H2O。
答案为:Mn2+ + HCO + NH3•H2O = MnCO3↓ + NH4+ + H2O
(6)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4•H2O晶体的方法是:因为要将MnCO3转化为MnSO4,所以应溶于适量的稀硫酸。
答案为:适量的稀硫酸
为降低MnSO4的溶解度,参照表中数据,需控制温度为90℃以上结晶。答案为:90℃
得到MnSO4•H2O晶体,洗涤、烘干。
因为晶体受热易失去结晶水,所以晶体烘干时温度不能过高,其原因是防止MnSO4•H2O失去结晶水。答案为:防止MnSO4•H2O失去结晶水
18.烟道气的主要成分为粉尘、空气、H2O、NOx,其中NOx是主要的大气污染物之一,为了监测某工厂烟道气中NOx含量,采集标准状况下50.00 L烟道气样经除尘、干燥后缓慢通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3−,除去多余的H2O2并加水稀释至100.00 mL。量取20.00 mL该溶液,加入30.00 mL 0.01000 mol·L−1FeSO4标准溶液(过量),充分反应后,用0.001000 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00 mL。滴定过程中发生如下反应:
Fe2+ + NO3− + H+ — NO↑ + Fe3+ + H2O (未配平)
+ Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
(1)NO被H2O2氧化为NO3−的离子方程式是__________________________________。
(2)配制100mL 0.001000 mol·L−1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有___________________、___________________。
(3)若FeSO4标准溶液部分变质,会使NOx含量测定结果_________(填“偏高” 、“偏低”或“无影响 ”)。
(4)标准状况下该工厂烟道气中NOx(折合成NO2)的含量为______________mg·m−3(写出计算过程)。
【答案】 (1). 2NO+3H2O2=2H++2NO+2H2O (2). 胶头滴管 (3). 100mL容量瓶 (4). 偏高 (5). 368 mg·m−3
【分析】(1)NO被H2O2氧化为NO3−,H2O2被还原为H2O,据此写出反应的离子方程式;
(2)配制一定浓度的溶液,需用到烧杯、量筒、玻璃棒、胶头滴管、100mL容量瓶,据此进行解答。
(3)若FeSO4标准溶液部分变质,则消耗K2Cr2O7溶液的体积减小,计算时求得NO3-的物质的量增大,会使NOx含量测定结果偏高;
(4)根据 +6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O、3Fe2+ + NO3− + 4H+ = NO↑ + 3Fe3+ +2 H2O反应中各量之间的关系进行计算。
【详解】(1)NO被H2O2氧化为NO3−,H2O2被还原为H2O,反应的离子方程式是2NO+3H2O2=2H++2NO+2H2O;
答案为:2NO+3H2O2=2H++2NO+2H2O;
(2)配制100mL 0.001000 mol·L−1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有胶头滴管、100mL容量瓶;
答案为:胶头滴管、100mL容量瓶;
(3)若FeSO4标准溶液部分变质,则消耗K2Cr2O7溶液的体积减小,计算时求得NO3-的物质的量增大,会使NOx含量测定结果偏高;
答案为:偏高;
(4)根据反应 +6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O
1mol 6mol
5×10-5mol 3×10-4mol
3Fe2+ + NO3− + 4H+ = NO↑ + 3Fe3+ +2 H2O
3mol 1mol
15×10-4mol-3×10-4mol 4×10-4mol
标准状况下该工厂烟道气中NOx(折合成NO2)的含量为=368mg·m−3;
答案为:368。
19.叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:
查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质
熔点℃
沸点℃
溶解性
CH3OH
-97
64.7
与水互溶
水合肼(N2H4·H2O)
-40
118.5
与水、醇互溶,不溶于乙醚
亚硝酸甲酯(CH3ONO)
-17
-12
溶于乙醇、乙醚
叠氮化钠(NaN3)
275(410易分解)
——
易溶于水,微溶于醇,
不溶于乙醚
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
①制取N2H4·H2O的离子方程式为____________________________________________。
②实验中通过分液漏斗滴加的溶液是_________________________,理由是___________________________________________________________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是________________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_____________________________ ______________________________________________________________________ [实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
【答案】(1). ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O + (2). NaClO碱性溶液 (3). 防止过量的NaClO溶液将水合肼氧化 (4). 20℃(冷)水浴 (或缓慢通入CH3ONO 气体) (5). 蒸馏 (6). 蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥
【分析】(1)①NaClO碱性溶液与尿素CO(NH2)2水溶液反应生成N2H4·H2O,NaCl、Na2CO3,据此写出离子方程式;
②因为水合肼具有强还原性,易被次氯酸钠溶液氧化,可以通过分液漏斗控制NaClO碱性溶液的滴加速度,以此控制用量;
(2)①该反应在20℃左右反应的选择性和转化率最高,所以应设法把温度控制在20℃左右,据此分析实验时可以采取的措施;
②从混合液中可以采用蒸馏的方法回收甲醇;
③由B溶液获得叠氮化钠(NaN3)产品,需考虑先让叠氮化钠从溶液中结晶析出(蒸发浓缩、(冷却)结晶),过滤(布氏漏斗),洗涤(易溶于水,需采用非水洗液,常用乙醇,不使用乙醚,是因为还要考虑杂质离子的去除及环境保护),烘干(具有强还原性,需考虑隔绝空气)。
【详解】①NaClO碱性溶液与尿素CO(NH2)2水溶液制取N2H4·H2O,则反应物为ClO-、OH-、CO(NH2)2,生成物为N2H4·H2O、Cl-、CO32-(C由+2价被氧化为+4价的CO2,再与OH-反应),反应的离子方程式为ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +。
答案为:ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +;
②因为水合肼具有强还原性,防止过量的NaClO溶液将水合肼氧化,所以需控制NaClO的用量,实验中通过分液漏斗滴加的溶液是NaClO碱性溶液;
答案为:防止过量的NaClO溶液将水合肼氧化;
(2)①该反应在20℃左右反应的选择性和转化率最高,所以应设法把温度控制在20℃左右,实验时可以采取的措施是20℃(冷)水浴 (或缓慢通入CH3ONO 气体);
答案为:20℃(冷)水浴 (或缓慢通入CH3ONO 气体);
②步骤Ⅱ为从溶液中回收CH3OH,则其实验操作名称为蒸馏;
答案为:蒸馏;
③由B溶液获得叠氮化钠(NaN3)产品,需考虑先让叠氮化钠从溶液中结晶析出(蒸发浓缩、(冷却)结晶),过滤(布氏漏斗),洗涤(易溶于水,需采用非水洗液,常用乙醇,不使用乙醚,是因为还要考虑杂质离子的去除及环境保护),烘干(具有强还原性,需考虑隔绝空气);
答案为:蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥。
20.CO2是一种廉价的碳资源,综合利用CO2对构建低碳社会有重要意义。
(1)已知: H2(g)+ O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+ O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=_____________。
(2)工业生产中可利用H2还原CO2制备清洁能源甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0
①保持温度、体积一定,能说明上述反应达到平衡状态的是_________。
A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图所示,催化效果最好的是催化剂________(填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是________________
_______________________________________________。
(3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如图。
①电源正极为________(填“a”或“b”),电极c上发生的电极反应式为__________________、___________________________________。
②阴阳两极生成的气体的物质的量之比为_____________。
【答案】 (1). +524.8kJ·mol-1 (2). AD (3). Ⅰ (4). 该反应为放热反应,达平衡后,随温度升高,平衡逆向移动,CO2的转化率降低 (5). b (6). H2O+2e-=H2↑+O2- (7). CO2+2e-=CO+O2- (8). 2:1
【分析】(1)根据盖斯定律进行分析计算;
(2)①根据平衡状态判断标准进行分析:v正= v逆,各组分的浓度及由此引出相关的物质的量的变化情况进行分析;
②从图中看,相同温度下,Ⅰ 中CO2
的转化率最大,说明反应速率最快,催化效果最好;该反应在a点达到平衡状态,a点的转化率比b点的高,说明继续升高温度,平衡逆向移动,从而得出其原因是该反应为放热反应,据此进行分析;
(3)①从图中看出,H2O、CO2在c电极转化为H2、CO,说明此电极为阳极,则与之相连的a电极为负极,电源正极为b;电极c为电解池的阴极,发生还原反应;
②阳极的电极反应为2O2—4e- =O2↑,根据电子得失守恒规律,计算出阴阳两极生成的气体的物质的量之比。
【详解】(1)H2(g)+ O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 ①
CO2(g) = CO(g)+ O2(g) ΔH=+283.0kJ·mol-1 ②
根据盖斯定律将②-①得:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH= +524.8kJ·mol-1;
答案为:+524.8kJ·mol-1;
(2)①A.因为反应前后气体分子数不等,所以容器内压强不变时,反应达平衡状态,A符合题意;
B.3v正(CH3OH)= v正(H2),反应向同一方向进行,不一定是平衡状态,B不正确;
C.因为气体的质量不变,容器的容积不变,所以容器内气体的密度始终不变,C不正确;
D.CO2与H2O的物质的量之比保持不变,则平衡不发生移动,D达平衡状态,符合题意;
故选AD;
②从图中看,相同温度下,Ⅰ 中CO2的转化率最大,说明反应速率最快,催化效果最好;
该反应在a点达到平衡状态,a点的转化率比b点的高,说明继续升高温度,平衡逆向移动,从而得出其原因是该反应为放热反应,达平衡后,随温度升高,平衡逆向移动,CO2的转化率降低;
答案为:Ⅰ;该反应为放热反应,达平衡后,随温度升高,平衡逆向移动,CO2的转化率降低;
(3)①从图中看出,H2O、CO2在c电极转化为H2、CO,说明此电极为阳极,则与之相连的a电极为负极,电源正极为b;电极c上发生的电极反应式为H2O+2e-=H2↑+O2-、CO2+2e-=CO+O2-;
答案为:b;H2O+2e-=H2↑+O2-、CO2+2e-=CO+O2-;
②阳极的电极反应为2O2—4e- =O2↑,按得失电子总数相等的原则,设电路中通过4mole-,则阳极生成1molO2,阴极生成2molH2
,或2molCO,或2mol二者的混合气,从而得出阴阳两极生成的气体的物质的量之比为2:1;
答案为2:1。